氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是___________ (至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:___________ 。
(2)以甲烷为原料可制得氢气。下图是一定温度、压强下, 与
与 反应生成CO(g)和
反应生成CO(g)和 的能量(KJ)变化示意图,写出该反应的热化学方程式
的能量(KJ)变化示意图,写出该反应的热化学方程式___________ ( 用
用 、
、 、
、 表示)。
表示)。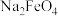 ,同时获得氢气:通由
,同时获得氢气:通由 ,工作原理如图所示。装置通电后,铁电极附近生成紫红色的
,工作原理如图所示。装置通电后,铁电极附近生成紫红色的 ,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:
,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知: 只在强碱性条件下稳定,易被
只在强碱性条件下稳定,易被 还原。
还原。 降低的区域在
降低的区域在___________ (填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是___________ 。
③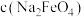 随初始c(NaOH)的变化如下图,分析N点
随初始c(NaOH)的变化如下图,分析N点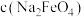 低于最高值的原因:
低于最高值的原因:___________ 。
(1)与汽油相比,氢气作为燃料的优点是
(2)以甲烷为原料可制得氢气。下图是一定温度、压强下,
 与
与 反应生成CO(g)和
反应生成CO(g)和 的能量(KJ)变化示意图,写出该反应的热化学方程式
的能量(KJ)变化示意图,写出该反应的热化学方程式 用
用 、
、 、
、 表示)。
表示)。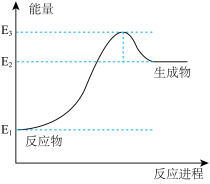
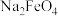 ,同时获得氢气:通由
,同时获得氢气:通由 ,工作原理如图所示。装置通电后,铁电极附近生成紫红色的
,工作原理如图所示。装置通电后,铁电极附近生成紫红色的 ,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:
,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知: 只在强碱性条件下稳定,易被
只在强碱性条件下稳定,易被 还原。
还原。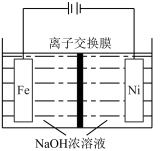
 降低的区域在
降低的区域在②电解过程中,须将阴极产生的气体及时排出,其原因是
③
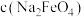 随初始c(NaOH)的变化如下图,分析N点
随初始c(NaOH)的变化如下图,分析N点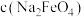 低于最高值的原因:
低于最高值的原因: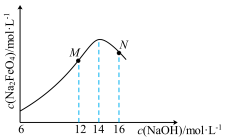
更新时间:2023/12/18 23:12:53
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】生产生活中的化学反应都伴随能量的变化,请根据有关知识回答下列问题:
(1)制作有降温、保鲜和镇痛的冷敷袋可以利用_______ (填“放热”或“吸热”)的化学变化或物理变化。
(2)“即热饭盒”可利用下面_______ (填字母序号)反应释放的热量加热食物。
A.生石灰和水B.浓硫酸和水C.钠和水
(3)沼气是一种能源,它的主要成分是 ,常温下
,常温下 完全燃烧生成
完全燃烧生成 和水时,放出445kJ热量,则其热化学方程式是
和水时,放出445kJ热量,则其热化学方程式是_______ 。
(4)火箭推进器中盛有强还原剂液态肼( )和强氧化剂液态
)和强氧化剂液态 。当它们混合发生反应时,立即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态
。当它们混合发生反应时,立即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态 反应,生成水蒸气和氮气,放出256.652kJ的热量。该反应的热化学方程式为
反应,生成水蒸气和氮气,放出256.652kJ的热量。该反应的热化学方程式为_______ 。
(5)共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量或形成1mol共价键所放出的能量。工业合成氨是人类科学技术的一项重大突破,其反应如下:
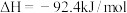 ,若断裂
,若断裂 和
和 需要吸收的能量分别为436kJ和391kJ,则断裂
需要吸收的能量分别为436kJ和391kJ,则断裂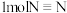 需要吸收的能量为
需要吸收的能量为_______ kJ。
(6)参考下表中的数据,判断下列分子受热时最稳定的是_______。
(1)制作有降温、保鲜和镇痛的冷敷袋可以利用
(2)“即热饭盒”可利用下面
A.生石灰和水B.浓硫酸和水C.钠和水
(3)沼气是一种能源,它的主要成分是
 ,常温下
,常温下 完全燃烧生成
完全燃烧生成 和水时,放出445kJ热量,则其热化学方程式是
和水时,放出445kJ热量,则其热化学方程式是(4)火箭推进器中盛有强还原剂液态肼(
 )和强氧化剂液态
)和强氧化剂液态 。当它们混合发生反应时,立即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态
。当它们混合发生反应时,立即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量液态 反应,生成水蒸气和氮气,放出256.652kJ的热量。该反应的热化学方程式为
反应,生成水蒸气和氮气,放出256.652kJ的热量。该反应的热化学方程式为(5)共价键都有键能之说,键能是指拆开1mol共价键所需要吸收的能量或形成1mol共价键所放出的能量。工业合成氨是人类科学技术的一项重大突破,其反应如下:

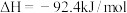 ,若断裂
,若断裂 和
和 需要吸收的能量分别为436kJ和391kJ,则断裂
需要吸收的能量分别为436kJ和391kJ,则断裂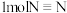 需要吸收的能量为
需要吸收的能量为(6)参考下表中的数据,判断下列分子受热时最稳定的是_______。
| 化学键 |  |  |  |  |
键能 | 436 | 565 | 431 | 368 |
A. | B.HF | C.HCl | D.HBr |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】现有A、B、C、D、E、F、G七种短周期元素,原子序数依次增大。已知A与E、D与F分别同主族, E、F、G同周期;A、C的最外层电子数之和与D的最外层电子数相等,A与D形成的化合物常温下为液态,A分别与F、G形成的气体分子电子总数相等、B有多种同素异形体,其中一种是原子晶体,是自然界中最硬的物质,可做首饰品或做切削工具。
请回答下列问题:
(1)元素C在周期表中的位置是_______________
元素E的原子结构示意图为________________
(2)C的气态氢化物的水化物与其最高价氧化物的水化物可发生反应,离子方程式为:
______________________________________________________________________________
(3)在一定条件下,A、D的单质和A、D、E形成的离子化合物的水溶液可构成电池,该电池负极的电极反应式为___________________________________________________ , 该电池在放电过程中,电解质溶液的pH将________ (填“增大”、“减小”或“不变”)。
(4)化合物C2A4(g) 是一种高效清洁的火箭燃料,0.25 mol C2A4完全燃烧的生成物是一种气态单质和一种气态化合物,它们对环境无污染,同时放出热量133.5 kJ的热量。则该反应的热化学方程式为(用具体物质化学式表示)____________________________________ 。
请回答下列问题:
(1)元素C在周期表中的位置是
元素E的原子结构示意图为
(2)C的气态氢化物的水化物与其最高价氧化物的水化物可发生反应,离子方程式为:
(3)在一定条件下,A、D的单质和A、D、E形成的离子化合物的水溶液可构成电池,该电池负极的电极反应式为
(4)化合物C2A4(g) 是一种高效清洁的火箭燃料,0.25 mol C2A4完全燃烧的生成物是一种气态单质和一种气态化合物,它们对环境无污染,同时放出热量133.5 kJ的热量。则该反应的热化学方程式为(用具体物质化学式表示)
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】化学反应过程伴随有热量的变化。
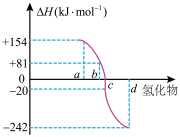
(1)一定条件下,由稳定单质反应生成1mol化合物的反应热叫该化合物的生成热(ΔH)。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热ΔH越小。硫化氢发生分解反应的热化学方程式为_______ 。
(2)利用CH4可制备乙烯及合成气(CO、H2)。有关化学键键能(E)的数据如下表:
①已知2CH4(g)=CH2=CH2(g)+2H2(g)ΔH=+167kJ/mol,则a=_______ 。
②制备合成气反应历程分两步(步骤I、步骤II),反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:

步骤I反应的焓变ΔH1为_______ kJ/mol(选用E1~E5的关系式表示)
③反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的焓变为ΔH2,与步骤I焓变ΔH1相比,ΔH1_______ ΔH2(填“>”或“<”)
(3)在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)⇌NH2COONH4(s)ΔH1
反应II:NH2COONH4(s)⇌CO(NH2)2(s)+H2O(g)ΔH2=+72.49kJ·mol-1
总反应:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g)ΔH3=-86.98kJ·mol-1
则反应I的ΔH1=_______ kJ·mol-1。
(1)一定条件下,由稳定单质反应生成1mol化合物的反应热叫该化合物的生成热(ΔH)。下图为VIA族元素(O、S、Se、Te)氢化物a、b、c、d的生成热数据示意图。已知非金属元素气态氢化物的稳定性越强,其氢化物的生成热ΔH越小。硫化氢发生分解反应的热化学方程式为

(2)利用CH4可制备乙烯及合成气(CO、H2)。有关化学键键能(E)的数据如下表:
| 化学键 | H-H | C=C | C-C | C-H |
| E(kJ/mol) | 436 | a | 348 | 413 |
①已知2CH4(g)=CH2=CH2(g)+2H2(g)ΔH=+167kJ/mol,则a=
②制备合成气反应历程分两步(步骤I、步骤II),反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:

步骤I反应的焓变ΔH1为
③反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的焓变为ΔH2,与步骤I焓变ΔH1相比,ΔH1
(3)在尿素合成塔中的主要反应可表示如下:
反应I:2NH3(g)+CO2(g)⇌NH2COONH4(s)ΔH1
反应II:NH2COONH4(s)⇌CO(NH2)2(s)+H2O(g)ΔH2=+72.49kJ·mol-1
总反应:2NH3(g)+CO2(g)⇌CO(NH2)2(s)+H2O(g)ΔH3=-86.98kJ·mol-1
则反应I的ΔH1=
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】阅读下列关于燃料电池的短文并填空。
化学电池用途广泛,燃料电池具有能量转化率高、对环境友好等优点。燃料电池在工作时,从负极连续通入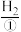 、
、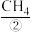 、
、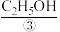 等燃料,从正极连续通入
等燃料,从正极连续通入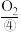 ,以
,以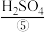 溶液或
溶液或 为电解质溶液,发生反应生成
为电解质溶液,发生反应生成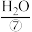 、
、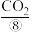 或
或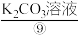 等,同时产生电能,目前已研制成功
等,同时产生电能,目前已研制成功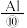 —空气燃料电池,它可以代替汽油为汽车提供动力,也可用作照明电源。
—空气燃料电池,它可以代替汽油为汽车提供动力,也可用作照明电源。
(1)在上述十种物质中,属于电解质的是___ (填序号,下同);属于非电解质的是___ 。
(2)氢氧燃料电池通常有酸式和碱式两种:
①以稀硫酸为电解质溶液时,正极的电极反应式为___ 。
②以KOH溶液为电解质溶液时,负极的电极反应式为___ 。
③用氢氧燃料电池提供动力的汽车作为上海世博园中的交通工具之一,下列有关说法不正确的是___ (填标号)。
A.太阳光催化分解水制氢气比电解水制氢气更节能
B.用氢氧燃料电池提供汽车动力更能保护环境
C.分别以稀硫酸、KOH溶液为电解质溶液的两种氢氧燃料电池的负极电极反应式相同
D.分别以稀硫酸、KOH溶液为电解质溶液的两种氢氧燃料电池的总反应式相同
(3)Al—空气燃料电池反应原理:负极的金属Al在氯化钠溶液中与空气中的O2发生反应生成Al(OH)3。若负极有9gAl参加反应,则正极消耗O2的质量为___ g。
化学电池用途广泛,燃料电池具有能量转化率高、对环境友好等优点。燃料电池在工作时,从负极连续通入
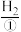 、
、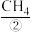 、
、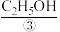 等燃料,从正极连续通入
等燃料,从正极连续通入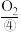 ,以
,以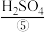 溶液或
溶液或 为电解质溶液,发生反应生成
为电解质溶液,发生反应生成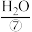 、
、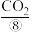 或
或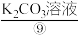 等,同时产生电能,目前已研制成功
等,同时产生电能,目前已研制成功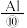 —空气燃料电池,它可以代替汽油为汽车提供动力,也可用作照明电源。
—空气燃料电池,它可以代替汽油为汽车提供动力,也可用作照明电源。(1)在上述十种物质中,属于电解质的是
(2)氢氧燃料电池通常有酸式和碱式两种:
①以稀硫酸为电解质溶液时,正极的电极反应式为
②以KOH溶液为电解质溶液时,负极的电极反应式为
③用氢氧燃料电池提供动力的汽车作为上海世博园中的交通工具之一,下列有关说法不正确的是
A.太阳光催化分解水制氢气比电解水制氢气更节能
B.用氢氧燃料电池提供汽车动力更能保护环境
C.分别以稀硫酸、KOH溶液为电解质溶液的两种氢氧燃料电池的负极电极反应式相同
D.分别以稀硫酸、KOH溶液为电解质溶液的两种氢氧燃料电池的总反应式相同
(3)Al—空气燃料电池反应原理:负极的金属Al在氯化钠溶液中与空气中的O2发生反应生成Al(OH)3。若负极有9gAl参加反应,则正极消耗O2的质量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】科学家预言,燃料电池是21世纪获得电子的重要途径。甲醇燃料电池是采用铂或碳化钨作电极催化剂,在硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。试回答以下问题:
(1)配平电池放电时发生的化学反应方程式:_______ 。
_______CH3OH+_______O2→_______CO2+_______H2O
(2)在硫酸电解液中,电解液中的H+向_______ 极移动,请写出此电池的正极的电极反应式_______ 。
(3)如图所示装置,装置A是甲醇碱性燃料电池,已知该装置工作时电子从b极流出,a极流入。

①A池中b电极反应式为_______
②当装置A中消耗0.25mol甲醇时,装置A中溶液的pH会_______ (填写“增大”“减小”或“不变”);装置B中C电极收集到_______ L气体(标准状况下)。
(4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先燃料电池的能量转换效率高,其次是_______ 。
(1)配平电池放电时发生的化学反应方程式:
_______CH3OH+_______O2→_______CO2+_______H2O
(2)在硫酸电解液中,电解液中的H+向
(3)如图所示装置,装置A是甲醇碱性燃料电池,已知该装置工作时电子从b极流出,a极流入。

①A池中b电极反应式为
②当装置A中消耗0.25mol甲醇时,装置A中溶液的pH会
(4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其中主要有两点:首先燃料电池的能量转换效率高,其次是
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】 是一种重要的含碳化合物,它与生产、生活息息相关。
是一种重要的含碳化合物,它与生产、生活息息相关。
(1)汽车尾气中 、
、 在一定条件下可发生反应:
在一定条件下可发生反应: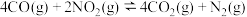 ,一定温度下,向容积固定的2L的密闭容器中充入一定量的
,一定温度下,向容积固定的2L的密闭容器中充入一定量的 和
和 ,反应经
,反应经 达到化学平衡。
达到化学平衡。 的物质的量随时间的变化曲线如图所示:
的物质的量随时间的变化曲线如图所示:

① 内该反应的平均反应速率
内该反应的平均反应速率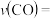
_______ ;
②A点的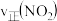
_______ 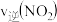 (填“>”“<”或“=”);
(填“>”“<”或“=”);
③下列不能说明该反应一定达到化学平衡的是_______ (填序号);
A.单位时间内,每消耗
 的同时生成
的同时生成

B. 在该条件下达到最大转化率
在该条件下达到最大转化率
C.容器内混合气体密度保持不变
D.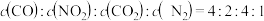
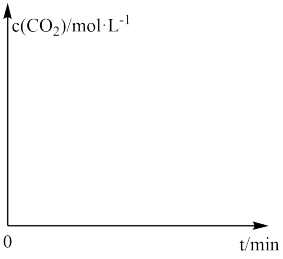
④在下图中画出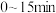 时间内,
时间内, 的浓度随时间变化的曲线图
的浓度随时间变化的曲线图_________ 。
(2)一氧化碳一氧燃料电池是使用 制造成储存能量的电池,其总反应方程式为:
制造成储存能量的电池,其总反应方程式为: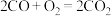 ,一氧化碳一氧燃料电池在酸性条件下放电时,正极的电极反应式:
,一氧化碳一氧燃料电池在酸性条件下放电时,正极的电极反应式:_______ 。
 是一种重要的含碳化合物,它与生产、生活息息相关。
是一种重要的含碳化合物,它与生产、生活息息相关。(1)汽车尾气中
 、
、 在一定条件下可发生反应:
在一定条件下可发生反应: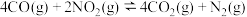 ,一定温度下,向容积固定的2L的密闭容器中充入一定量的
,一定温度下,向容积固定的2L的密闭容器中充入一定量的 和
和 ,反应经
,反应经 达到化学平衡。
达到化学平衡。 的物质的量随时间的变化曲线如图所示:
的物质的量随时间的变化曲线如图所示:
①
 内该反应的平均反应速率
内该反应的平均反应速率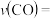
②A点的
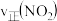
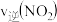 (填“>”“<”或“=”);
(填“>”“<”或“=”);③下列不能说明该反应一定达到化学平衡的是
A.单位时间内,每消耗

 的同时生成
的同时生成

B.
 在该条件下达到最大转化率
在该条件下达到最大转化率C.容器内混合气体密度保持不变
D.
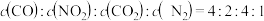
④在下图中画出
 时间内,
时间内, 的浓度随时间变化的曲线图
的浓度随时间变化的曲线图
(2)一氧化碳一氧燃料电池是使用
 制造成储存能量的电池,其总反应方程式为:
制造成储存能量的电池,其总反应方程式为: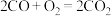 ,一氧化碳一氧燃料电池在酸性条件下放电时,正极的电极反应式:
,一氧化碳一氧燃料电池在酸性条件下放电时,正极的电极反应式:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性, H3PO2也可用电渗析法制备。“四室电渗析法”工作原理如下图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):写出阳极的电极反应式:_______ ,分析产品室可得到H3PO2的原因:_______ 。


您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】电解原理在化学工业中有广泛应用。图表示一个电解也,其中a为电解质溶液, 、
、 是两块电极板,通过导线与直流电源相连。请回答以下问题:
是两块电极板,通过导线与直流电源相连。请回答以下问题:
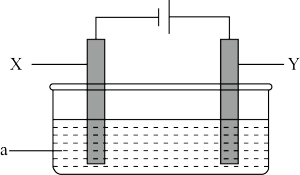
(1)X的电极名称是_________  填写“阳极”或“阴极”
填写“阳极”或“阴极” 。
。
(2)若 、
、 都是惰性电极。
都是惰性电极。 是饱和食盐水,实验开始时,同时在两边各滴入几滴酚酞溶液,一段时间后,
是饱和食盐水,实验开始时,同时在两边各滴入几滴酚酞溶液,一段时间后, 极上的电极反应式为
极上的电极反应式为__________________ 。
(3)若 、
、 都是惰性电极,
都是惰性电极, 是
是 溶液,电解一段时间后,阳极上产生气体的体积为0.224L标准状况下
溶液,电解一段时间后,阳极上产生气体的体积为0.224L标准状况下 ,则阳极上的电极反应式为
,则阳极上的电极反应式为__________________ ,阴极上析出金属的质量为______________  。
。
(4)若要用该装置电解精炼粗铜,电解液 选用
选用 溶液,则
溶液,则 电极的材料是
电极的材料是___________________ 。
(5)若要用电镀方法在铁表面镀一层金属银,应该选择的的方案是________ 。 填字母编号
填字母编号
 、
、 是两块电极板,通过导线与直流电源相连。请回答以下问题:
是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)X的电极名称是
 填写“阳极”或“阴极”
填写“阳极”或“阴极” 。
。(2)若
 、
、 都是惰性电极。
都是惰性电极。 是饱和食盐水,实验开始时,同时在两边各滴入几滴酚酞溶液,一段时间后,
是饱和食盐水,实验开始时,同时在两边各滴入几滴酚酞溶液,一段时间后, 极上的电极反应式为
极上的电极反应式为(3)若
 、
、 都是惰性电极,
都是惰性电极, 是
是 溶液,电解一段时间后,阳极上产生气体的体积为0.224L标准状况下
溶液,电解一段时间后,阳极上产生气体的体积为0.224L标准状况下 ,则阳极上的电极反应式为
,则阳极上的电极反应式为 。
。(4)若要用该装置电解精炼粗铜,电解液
 选用
选用 溶液,则
溶液,则 电极的材料是
电极的材料是(5)若要用电镀方法在铁表面镀一层金属银,应该选择的的方案是
 填字母编号
填字母编号
| 方案 |  |  |  溶液 溶液 |
 | 银 | 石墨 |  |
 | 银 | 铁 |  |
 | 铁 | 银 | 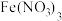 |
 | 铁 | 银 |  |
您最近一年使用:0次
【推荐3】(1)一种甲醇燃料电池以稀硫酸为电解质溶液,其中一个电极上加入甲醇(CH3OH),同时另一个电极通入空气:
①此电池的负极反应式是_________________________________ ;
②总反应方程式式是_____________________________________ ;
③电解质溶液中的H+向_____________ (填“甲醇”或“空气”)极移动。
(2)氯碱工业中,用惰性电极电解精制饱和食盐水
①电解总离子反应是____________________________________ ;
②阴极离子反应式是____________________________________ ;
③电解过程中阴极PH_____________ (填“增大”、“减小”或“不变”)
(3)碱性锌锰电池(负极Zn,正极MnO2,电解质溶液KOH溶液)
①总反应化学方程式是_______________________________________ ;
②负极反应是___________________________________________ 。
①此电池的负极反应式是
②总反应方程式式是
③电解质溶液中的H+向
(2)氯碱工业中,用惰性电极电解精制饱和食盐水
①电解总离子反应是
②阴极离子反应式是
③电解过程中阴极PH
(3)碱性锌锰电池(负极Zn,正极MnO2,电解质溶液KOH溶液)
①总反应化学方程式是
②负极反应是
您最近一年使用:0次



