化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)碱性锌锰干电池(如图所示)是应用最普遍的电池之一,电池总反应为 ,碱性锌锰干电池的负极材料是
,碱性锌锰干电池的负极材料是______ (填名称),负极上发生的电极反应为______ 。若反应消耗13g负极材料,则电池中转移电子的物质的量______ mol。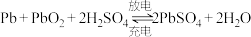 。下列说法正确的是______(填标号)。
。下列说法正确的是______(填标号)。
(3)镁铝电池的构造如图所示,当电解质溶液为 溶液时,可知电池的负极材料为
溶液时,可知电池的负极材料为______ (填“Mg”或“Al”)反应式为______ 。
(1)碱性锌锰干电池(如图所示)是应用最普遍的电池之一,电池总反应为
 ,碱性锌锰干电池的负极材料是
,碱性锌锰干电池的负极材料是
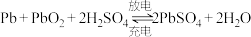 。下列说法正确的是______(填标号)。
。下列说法正确的是______(填标号)。A.电解液中 的浓度始终保持不变 的浓度始终保持不变 |
B.放电时正极上的电极反应式为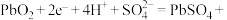 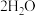 |
C.放电时,当外电路通过 电子时,理论上负极质量增加 电子时,理论上负极质量增加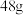 |
D.放电时,溶液中的 向正极移动 向正极移动 |
(3)镁铝电池的构造如图所示,当电解质溶液为
 溶液时,可知电池的负极材料为
溶液时,可知电池的负极材料为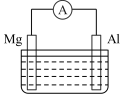
更新时间:2024-05-21 17:29:14
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】燃料电池可以将燃料的化学能直接转化为电能,能量利用率高。
(1)碱性燃料电池(AFC)是最早进入实用阶段的燃料电池之一,也是最早用于车辆的燃料电池,以KOH、NaOH溶液之类的强碱性溶液为电解质溶液。其优点为性能可靠,具有较高的效率。甲烷碱性燃料电池正极的电极反应式为_______
(2)某燃料电池主要构成要素如图所示
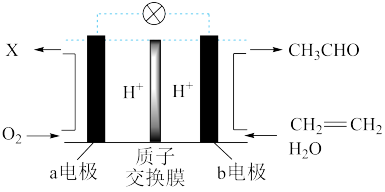
电流方向为__ ;电池工作时,X为___ ; a电极的反应式为___ ; b电极的反应式为____ 。
(1)碱性燃料电池(AFC)是最早进入实用阶段的燃料电池之一,也是最早用于车辆的燃料电池,以KOH、NaOH溶液之类的强碱性溶液为电解质溶液。其优点为性能可靠,具有较高的效率。甲烷碱性燃料电池正极的电极反应式为
(2)某燃料电池主要构成要素如图所示

电流方向为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】请根据有关知识,填写下列空白:
(1)已知拆开1 mol H-H键、1 mol I-I、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ,则由1 mol氢气和1 mol碘反应生成HI会放出_______ kJ的热量
(2)某同学做如下实验,以检验反应中的能量变化。

①在实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是_______ 热反应;
②根据能量守恒定律,(b)中反应物的总能量应该_______ 其生成物的总能量(填“>”或“<”)。
(3)下列过程中不一定放热的是_______ (填字母)。
a.铝热反应 b.炸药爆炸 c.燃料燃烧 d.分解反应 e.酸碱中和
(4)分别按下图 A、B、C 所示装置进行实验,三个烧杯里的溶液为同浓度的稀硫酸。回答下列问题:
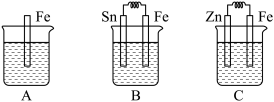
①下列叙述中,正确的是_______ 。
A.B 、C 中铁片均是为负极 B.三个烧杯中铁片表面均无气泡产生
C.产生气泡的速率 A 中比B中慢 D.C 溶液中SO 向Fe片电极移动
向Fe片电极移动
②若把Ba(OH)2·8H2O 晶体与 NH4Cl晶体反应设计成原电池,你认为是否可行?_______ (填“是”或“否”)。
(1)已知拆开1 mol H-H键、1 mol I-I、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ,则由1 mol氢气和1 mol碘反应生成HI会放出
(2)某同学做如下实验,以检验反应中的能量变化。

①在实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是
②根据能量守恒定律,(b)中反应物的总能量应该
(3)下列过程中不一定放热的是
a.铝热反应 b.炸药爆炸 c.燃料燃烧 d.分解反应 e.酸碱中和
(4)分别按下图 A、B、C 所示装置进行实验,三个烧杯里的溶液为同浓度的稀硫酸。回答下列问题:

①下列叙述中,正确的是
A.B 、C 中铁片均是为负极 B.三个烧杯中铁片表面均无气泡产生
C.产生气泡的速率 A 中比B中慢 D.C 溶液中SO
 向Fe片电极移动
向Fe片电极移动②若把Ba(OH)2·8H2O 晶体与 NH4Cl晶体反应设计成原电池,你认为是否可行?
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】现有如下两个反应:
A.NaOH+HCl=NaCl+H2O;B.Cu+2AgNO3=Cu(NO3)2+2Ag
(1)根据两反应本质判断,能用于设计原电池的是___________ 。
(2)请画出实验装置图___________ (注明电解质溶液名称和正负极材料)
电子流动方向___________ ,电流方向___________ 。
___________ 是正极,正极反应式:___________ ;
___________ 是负极,负极反应式:___________ 。
A.NaOH+HCl=NaCl+H2O;B.Cu+2AgNO3=Cu(NO3)2+2Ag
(1)根据两反应本质判断,能用于设计原电池的是
(2)请画出实验装置图
电子流动方向
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】如图为原电池装置示意图。
⑴将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是___________ (填字母)。
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式:________________ 。
⑵若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。写出B电极反应式:________________ ;该电池在工作时,A电极的质量将___________ (填“增加”“减小”或“不变”)。若该电池反应消耗了0.1mol H2SO4,则转移电子的数目为____________ 。
⑶若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入C3H8和O2,该电池即为丙烷燃料电池,写出B电极反应式:_________________ ;A极的反应物C3H8的一氯代物有__________ 种同分异构体。

⑴将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是
A.铝片、铜片 B.铜片、铝片 C.铝片、铝片 D.铜片、铜片
写出插入烧碱溶液中形成的原电池的负极反应式:
⑵若A为Pb,B为PbO2,电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。写出B电极反应式:
⑶若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入C3H8和O2,该电池即为丙烷燃料电池,写出B电极反应式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径。
(1)下列措施中,有利于降低大气中的CO2、SO2、NOx浓度的有______ (填字母)。
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
(2)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为_________ (只要求写一种)。
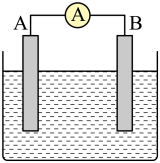
(3)有学者设想以下图所示装置用电化学原理将CO2、SO2转化为重要化工原料。
①若A为CO2,B为H2,C为CH3OH,则正极电极反应式为______________ 。
②若A为SO2,B为O2,C为H2SO4。科研人员希望每分钟从C处获得100mL10mol/LH2SO4,则A处通入烟气(SO2的体积分数为1%)的速率为_______ L/min(标准状况)。
(1)下列措施中,有利于降低大气中的CO2、SO2、NOx浓度的有
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
(2)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为
(3)有学者设想以下图所示装置用电化学原理将CO2、SO2转化为重要化工原料。

①若A为CO2,B为H2,C为CH3OH,则正极电极反应式为
②若A为SO2,B为O2,C为H2SO4。科研人员希望每分钟从C处获得100mL10mol/LH2SO4,则A处通入烟气(SO2的体积分数为1%)的速率为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】某化学兴趣小组的同学用以下装置研究电化学的问题。
(1)理论上讲,任何自发的氧化还原反应都可以设计成原电池。有甲,乙两位同学设计了如图所示的原电池。

写出甲中正极上的电极反应式:_______ 。
(2)乙中负极为_______ (填名称),总反应的离子方程式为_______ 。
(3)若用丙装置进行电解,U型管内装有电解液c,M、N是两块电极板,通过导线与直流电源相连。

请回答以下问题:
①若要进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,电解液c选用CuSO4溶液,则:N电极的材料是_______ ,N电极反应式是_______ 。(说明:杂质发生的电极反应不必写出)。下列说法正确的是_______ 。
A.电能全部转化为化学能
B.在电解精炼中,电解液中有Al3+、Zn2+产生
C.溶液中Cu2+向阳极移动
D.阳极泥中可回收Ag、Pt、Au等金属
②用惰性电极电解CuSO4溶液。若阴极析出Cu的质量为16g,则阳极上产生的气体在标准状况下的体积为_______ L 。
(1)理论上讲,任何自发的氧化还原反应都可以设计成原电池。有甲,乙两位同学设计了如图所示的原电池。

写出甲中正极上的电极反应式:
(2)乙中负极为
(3)若用丙装置进行电解,U型管内装有电解液c,M、N是两块电极板,通过导线与直流电源相连。

请回答以下问题:
①若要进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,电解液c选用CuSO4溶液,则:N电极的材料是
A.电能全部转化为化学能
B.在电解精炼中,电解液中有Al3+、Zn2+产生
C.溶液中Cu2+向阳极移动
D.阳极泥中可回收Ag、Pt、Au等金属
②用惰性电极电解CuSO4溶液。若阴极析出Cu的质量为16g,则阳极上产生的气体在标准状况下的体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)根据构成原电池的本质判断,下列反应方程式正确且能设计成原电池的是____ 。
(2)为了探究化学反应中的能量变化,某同学设计了如图两个实验(如图)。有关实验现象,下列说法正确的是____ 。
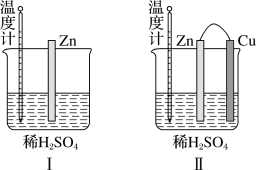
(3)图II中,正极电极反应式:____ ;电子流向:____ 极沿导线流入____ 极(Zn或Cu)。
(4)电动汽车上用的铅蓄电池是以一组充满海绵状态铅的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,负极电极反应式为:Pb-2e-+SO =PbSO4。
=PbSO4。
①写出放电时正极的电极反应式:____ 。
②铅蓄电池放电时,负极质量将____ (填“增大”“减小”或“不变”)。
(1)根据构成原电池的本质判断,下列反应方程式正确且能设计成原电池的是
| A.KOH+HCl=KCl+H2O | B.Cu+Fe3+=Fe2++Cu2+ |
| C.Na2O+H2O=2NaOH | D.Fe+H2SO4=FeSO4+H2↑ |

| A.图I中温度计的示数高于图II的示数 |
| B.图I和图II中温度计的示数相等,且均高于室温 |
| C.图I和图II的气泡均产生于锌棒表面 |
| D.图II中产生气体的速率比I慢 |
(4)电动汽车上用的铅蓄电池是以一组充满海绵状态铅的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O,负极电极反应式为:Pb-2e-+SO
 =PbSO4。
=PbSO4。①写出放电时正极的电极反应式:
②铅蓄电池放电时,负极质量将
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
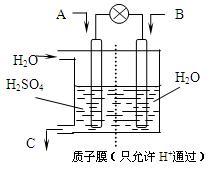
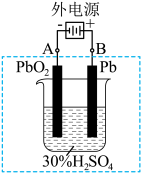
【推荐2】Ⅰ.铅蓄电池的总反应式为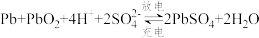 。请回答下列问题(不考虑氢、氧的氧化还原):
。请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时,正极的电极反应式是___________ ;电解液中 浓度将变
浓度将变___________ (填“大”或“小”);当外电路通过 电子时,理论上负极板的质量增加
电子时,理论上负极板的质量增加___________ g。
(2)在完全放电耗尽 和
和 时,若按如图所示连接,电解一段时间后,则在A电极上的电极反应式为
时,若按如图所示连接,电解一段时间后,则在A电极上的电极反应式为___________ ,B电极上生成___________ 。
Ⅱ.我国科学家最近发明了一种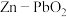 电池,电解质为
电池,电解质为 、
、 和KOH,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,结构示意图如图。回答下列问题:
和KOH,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,结构示意图如图。回答下列问题:
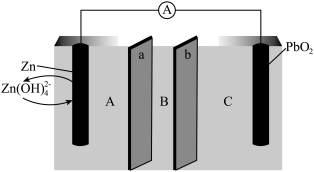
(3)电池中,B区域的电解质为___________ (填“ ”“
”“ ”或“KOH”)。
”或“KOH”)。
(4)电池反应的离子方程式为___________ 。
(5)阳离子交换膜为图中的___________ (填“a”或“b”)膜。
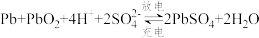 。请回答下列问题(不考虑氢、氧的氧化还原):
。请回答下列问题(不考虑氢、氧的氧化还原):(1)放电时,正极的电极反应式是
 浓度将变
浓度将变 电子时,理论上负极板的质量增加
电子时,理论上负极板的质量增加(2)在完全放电耗尽
 和
和 时,若按如图所示连接,电解一段时间后,则在A电极上的电极反应式为
时,若按如图所示连接,电解一段时间后,则在A电极上的电极反应式为
Ⅱ.我国科学家最近发明了一种
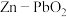 电池,电解质为
电池,电解质为 、
、 和KOH,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,结构示意图如图。回答下列问题:
和KOH,由a和b两种离子交换膜隔开,形成A、B、C三个电解质溶液区域,结构示意图如图。回答下列问题:
(3)电池中,B区域的电解质为
 ”“
”“ ”或“KOH”)。
”或“KOH”)。(4)电池反应的离子方程式为
(5)阳离子交换膜为图中的
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4===2PbSO4+2H2O。铅蓄电池放电时正极是______ (填物质化学式)。若电解液体积为2L(反应过程溶液体积变化忽略不计),放电过程中外电路中转移3mol电子,则硫酸浓度由5mol/L下降到________ mol/L。
(2)电子表所用的某种钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应式为:Zn+2OH--2e-=ZnO+H2O、Ag2O+H2O+2e-=2Ag+2OH-,电池的正极是____________ ,负极发生的是____________ 反应(填“氧化”或“还原”)。
(3)中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇(CH3OH)燃料电池的工作原理如图所示。

①该电池工作时,b口通入的物质为________
②该电池工作时,电子的流向为___________ (填“从左到右”或“从右到左”)
(1)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4===2PbSO4+2H2O。铅蓄电池放电时正极是
(2)电子表所用的某种钮扣电池的电极材料为Zn和Ag2O,电解质溶液为KOH,其电极反应式为:Zn+2OH--2e-=ZnO+H2O、Ag2O+H2O+2e-=2Ag+2OH-,电池的正极是
(3)中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇(CH3OH)燃料电池的工作原理如图所示。

①该电池工作时,b口通入的物质为
②该电池工作时,电子的流向为
您最近一年使用:0次



