黄铜矿(主要成分CuFeS2)是提取铜的主要原料
已知:2CuFeS2+4O2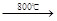 Cu2S+3SO2+2FeO炉渣产物Cu2S在1200℃高温下继续反应: 2Cu2S+3O2 → 2Cu2O+2SO2, 2Cu2O+Cu2S → 6Cu+SO2,假定各步反应都完全,完成下列计算:
Cu2S+3SO2+2FeO炉渣产物Cu2S在1200℃高温下继续反应: 2Cu2S+3O2 → 2Cu2O+2SO2, 2Cu2O+Cu2S → 6Cu+SO2,假定各步反应都完全,完成下列计算:
①由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量 mol
②6 mol CuFeS2和14.25 mol O2反应,理论上可得到 mol铜
已知:2CuFeS2+4O2
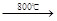 Cu2S+3SO2+2FeO炉渣产物Cu2S在1200℃高温下继续反应: 2Cu2S+3O2 → 2Cu2O+2SO2, 2Cu2O+Cu2S → 6Cu+SO2,假定各步反应都完全,完成下列计算:
Cu2S+3SO2+2FeO炉渣产物Cu2S在1200℃高温下继续反应: 2Cu2S+3O2 → 2Cu2O+2SO2, 2Cu2O+Cu2S → 6Cu+SO2,假定各步反应都完全,完成下列计算:①由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量 mol
②6 mol CuFeS2和14.25 mol O2反应,理论上可得到 mol铜
更新时间:2015-01-21 10:42:11
|
相似题推荐
计算题
|
适中
(0.65)
名校
解题方法
【推荐1】在标准状况下,将224LHCl气体溶于635mL水中,所得盐酸的密度为1.18g·cm-3试计算:
(1)所得盐酸的质量分数和物质的量浓度分别是___________ 、___________ 。
(2)取这种盐酸100 mL,稀释至1.18L,所得稀盐酸的物质的量浓度是___________ 。
(3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐滴加入上述稀释后的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过___________ mL。
(4)将不纯的NaOH样品1g(样品含少量Na2CO3和水),放入50mL2mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL1mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到___________ g固体。
(1)所得盐酸的质量分数和物质的量浓度分别是
(2)取这种盐酸100 mL,稀释至1.18L,所得稀盐酸的物质的量浓度是
(3)在40.0 mL 0.065 mol·L-1Na2CO3溶液中,逐滴加入上述稀释后的稀盐酸,边加边振荡。若使反应不产生CO2气体,加入稀盐酸的体积最多不超过
(4)将不纯的NaOH样品1g(样品含少量Na2CO3和水),放入50mL2mol·L-1的盐酸中,充分反应后,溶液呈酸性,中和多余的酸又用去40 mL1mol·L-1的NaOH溶液。蒸发中和后的溶液,最终得到
您最近半年使用:0次
计算题
|
适中
(0.65)
【推荐2】一定量的Mg、Al的混合物中加入足量盐酸,产生标准状况下的气体5.6升,再在此溶液中加入过量NaOH溶液,最终得到沉淀5.8克,求:
(1)Mg、Al的物质的量各为多少?________
(2)若将此混合物投入足量的NaOH溶液中,求标准状况下产生气体的体积?________ 。
(1)Mg、Al的物质的量各为多少?
(2)若将此混合物投入足量的NaOH溶液中,求标准状况下产生气体的体积?
您最近半年使用:0次
计算题
|
适中
(0.65)
【推荐1】向27.2gCu和Cu2O的混合物中加入某浓度的稀HNO3500mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1L1mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g。
(1)Cu与稀HNO3反应的离子方程式为_____ 。
(2)混合物中Cu与Cu2O的物质的量分别为______ 、______ 。(要求写出计算过程)
(1)Cu与稀HNO3反应的离子方程式为
(2)混合物中Cu与Cu2O的物质的量分别为
您最近半年使用:0次
计算题
|
适中
(0.65)
真题
名校
【推荐2】称取4.00g氧化铜和氧化铁固体混合物,加入50.0mL2.00mol·L-1的硫酸充分溶解,往所得溶液中加入5.60g铁粉,充分反应后,得固体的质量为3.04g。请计算:
(1)加入铁粉充分反应后,溶液中溶质的物质的量_________________ 。
(2)固体混合物中氧化铜的质量_________________ 。
(1)加入铁粉充分反应后,溶液中溶质的物质的量
(2)固体混合物中氧化铜的质量
您最近半年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐3】氧化亚铜 可用于生产船底防污漆,防止海洋生物对船舶设备的污损。现将
可用于生产船底防污漆,防止海洋生物对船舶设备的污损。现将 和Cu的固体混合物20 g放入烧杯中,加入质量分数为24.5%的稀硫酸50 g,恰好完全反应。已知:
和Cu的固体混合物20 g放入烧杯中,加入质量分数为24.5%的稀硫酸50 g,恰好完全反应。已知: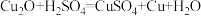 。请计算:
。请计算:
(1)原混合物中 的质量(写出计算过程)
的质量(写出计算过程) _______ 。
(2)在图中画出向20 g 和Cu的固体混合物中逐滴加入24.5%的稀硫酸至过量,固体中铜元素的质量变化曲线图,并标明必要的数据
和Cu的固体混合物中逐滴加入24.5%的稀硫酸至过量,固体中铜元素的质量变化曲线图,并标明必要的数据_______ 。

(3)氧化亚铜可用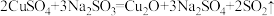 原理制备。
原理制备。
①反应过程中产生 可循环利用,因此应该选用
可循环利用,因此应该选用_______ 溶液来吸收它。
②反应过程中溶液pH将_______ (填“变大”“变小”或“不变”),因此制备过程,要控制溶液的酸碱度,因为如果反应时溶液pH过小,会导致产品下降,原因是_______ 。
 可用于生产船底防污漆,防止海洋生物对船舶设备的污损。现将
可用于生产船底防污漆,防止海洋生物对船舶设备的污损。现将 和Cu的固体混合物20 g放入烧杯中,加入质量分数为24.5%的稀硫酸50 g,恰好完全反应。已知:
和Cu的固体混合物20 g放入烧杯中,加入质量分数为24.5%的稀硫酸50 g,恰好完全反应。已知: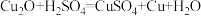 。请计算:
。请计算:(1)原混合物中
 的质量(写出计算过程)
的质量(写出计算过程) (2)在图中画出向20 g
 和Cu的固体混合物中逐滴加入24.5%的稀硫酸至过量,固体中铜元素的质量变化曲线图,并标明必要的数据
和Cu的固体混合物中逐滴加入24.5%的稀硫酸至过量,固体中铜元素的质量变化曲线图,并标明必要的数据
(3)氧化亚铜可用
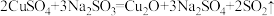 原理制备。
原理制备。①反应过程中产生
 可循环利用,因此应该选用
可循环利用,因此应该选用②反应过程中溶液pH将
您最近半年使用:0次

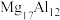 )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为
)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为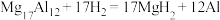 。得到的混合物Y(
。得到的混合物Y( )在一定条件下释放出氢气。在
)在一定条件下释放出氢气。在 溶液中,混合物Y能完全释放出
溶液中,混合物Y能完全释放出 。
。 完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出
完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出

