粗盐中除含有Ca2+、Mg2+、SO42-等可溶性杂质外,还含有泥砂等不溶性杂质。
(1)检验溶液中含有SO42-的方法是_________________ 。
(2)将粗盐溶解过滤除去不溶性杂质后,在滤液中依次滴加过量NaOH溶液、BaCl2溶液和Na2CO3溶液,直至不再产生沉淀。这些操作的目的是_________________ ,滴加Na2CO3溶液时发生反应的化学方程式为________________ 。
(3)用提纯后的NaCl固体配制100mL l.0mol/LNaCl溶液,所用仪器除托盘天平、烧杯、玻璃棒、药匙外,还需要___________ (填仪器名称)。转移溶液时没有洗涤烧杯会造成所配溶液浓度偏______ (填“高”或“低”,下同),定容时仰视刻度线会造成所配溶液浓度偏____________ 。
(1)检验溶液中含有SO42-的方法是
(2)将粗盐溶解过滤除去不溶性杂质后,在滤液中依次滴加过量NaOH溶液、BaCl2溶液和Na2CO3溶液,直至不再产生沉淀。这些操作的目的是
(3)用提纯后的NaCl固体配制100mL l.0mol/LNaCl溶液,所用仪器除托盘天平、烧杯、玻璃棒、药匙外,还需要
更新时间:2016-12-09 07:15:23
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】物质的量是联系宏观和微观的桥梁,请回答下列问题:
(1)0.1 mol OH-含电子的数目为_______ ,OH-的电子式为_______ 。
(2)将NaOH、Na2CO3的固体混合物完全溶解于水,配制成溶液,然后向该溶液中逐滴加入2 mol·L-1的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示,

回答下列问题:
①AB段发生反应的离子方程式为_______ 。
②当加入35mL盐酸时,产生CO2的体积(标准状况)为_______ mL。
③原混合溶液中 NaOH与Na2CO3的物质的量之比为_______ 。
(3)用质量分数为98%的浓硫酸(密度为1.84g·cm-1)配制成1mol·L-1的稀硫酸。现实验室仅需要这种硫酸220mL,试回答下列问题:
①经计算,浓硫酸的浓度为_______ mol·L-1。
②本实验必须用到的仪器有量筒、烧杯、玻璃棒、_______ 、_______ 。
③若出现以下情况,对所配溶液浓度有何影响?(填“偏高”、“偏低”或“无影响”)
I.没有用蒸馏水洗涤烧杯和玻璃棒_______ 。
II.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线_______ 。
(1)0.1 mol OH-含电子的数目为
(2)将NaOH、Na2CO3的固体混合物完全溶解于水,配制成溶液,然后向该溶液中逐滴加入2 mol·L-1的盐酸,所加盐酸的体积与产生CO2的体积(标准状况)关系如图所示,

回答下列问题:
①AB段发生反应的离子方程式为
②当加入35mL盐酸时,产生CO2的体积(标准状况)为
③原混合溶液中 NaOH与Na2CO3的物质的量之比为
(3)用质量分数为98%的浓硫酸(密度为1.84g·cm-1)配制成1mol·L-1的稀硫酸。现实验室仅需要这种硫酸220mL,试回答下列问题:
①经计算,浓硫酸的浓度为
②本实验必须用到的仪器有量筒、烧杯、玻璃棒、
③若出现以下情况,对所配溶液浓度有何影响?(填“偏高”、“偏低”或“无影响”)
I.没有用蒸馏水洗涤烧杯和玻璃棒
II.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】I.导电性实验可以作为研究电解质电离本质及反应机理的有效方法。
(1)在如图所示的装置里,若灯泡发亮,广口瓶内的物质A可以是_______ (填序号)。
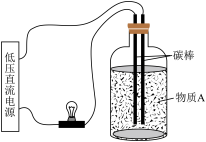
①干燥的氯化钾晶体 ②食盐水 ③稀硫酸 ④酒精 ⑤液态氯化氢
Ⅱ.进行导电性实验的物质需要精确配置。
(2)现需配制480mL物质的量浓度为 的稀硫酸,需要98%密度为
的稀硫酸,需要98%密度为 的浓硫酸
的浓硫酸_______ mL。
(3)配制时,须使用500L容量瓶,该仪器使用的重要的一步是检查是否漏水,请具体描述该操作:_______ 。
(4)配制时,该实验两次用到玻璃棒,其作用分别是_______ 、_______ 。
(5)下列操作造成所配浓度偏高的是_______ (填字母)
A.用量筒量取浓硫酸时,仰视读数
B.未经洗涤烧杯及玻璃棒
C.将量好的浓硫酸倒入小烧杯中稀释,未经冷却立即转移到容量瓶中并定容
D.定容时仰视刻度线
E.容量瓶中原有少量蒸馏水
(1)在如图所示的装置里,若灯泡发亮,广口瓶内的物质A可以是

①干燥的氯化钾晶体 ②食盐水 ③稀硫酸 ④酒精 ⑤液态氯化氢
Ⅱ.进行导电性实验的物质需要精确配置。
(2)现需配制480mL物质的量浓度为
 的稀硫酸,需要98%密度为
的稀硫酸,需要98%密度为 的浓硫酸
的浓硫酸(3)配制时,须使用500L容量瓶,该仪器使用的重要的一步是检查是否漏水,请具体描述该操作:
(4)配制时,该实验两次用到玻璃棒,其作用分别是
(5)下列操作造成所配浓度偏高的是
A.用量筒量取浓硫酸时,仰视读数
B.未经洗涤烧杯及玻璃棒
C.将量好的浓硫酸倒入小烧杯中稀释,未经冷却立即转移到容量瓶中并定容
D.定容时仰视刻度线
E.容量瓶中原有少量蒸馏水
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐3】二水合草酸钴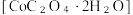 常用于制指示剂、催化剂及有机合成中间体。某同学在实验室按如下步骤制备二水合草酸钴:
常用于制指示剂、催化剂及有机合成中间体。某同学在实验室按如下步骤制备二水合草酸钴:
在一定温度下,将(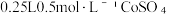 溶液加入
溶液加入 的
的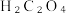 溶液中,保温、搅拌反应0.5h后,静置3h,过滤,固体用冷的蒸馏水洗涤数次。
溶液中,保温、搅拌反应0.5h后,静置3h,过滤,固体用冷的蒸馏水洗涤数次。
已知:H2C2O4为二元弱酸。
请回答下列问题:
(1)用草酸晶体( 配制
配制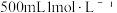 草酸溶液。
草酸溶液。
①需要使用到的玻璃仪器有量筒、玻璃棒、烧杯、_______ ,其中玻璃棒的作用为搅拌和_______ 。
②用托盘天平称取_______ g草酸晶体,下列情况会使配制的溶液浓度偏大的是_______ (填标号)。
a.砝码生锈 b.草酸晶体失去部分结晶水
c.定容时仰视刻度线 d.称量时砝码与药品位置放反了
(2)CoSO4溶液加入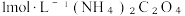 溶液中发生反应生成二水合草酸钴的化学方程式为
溶液中发生反应生成二水合草酸钴的化学方程式为_______ 。
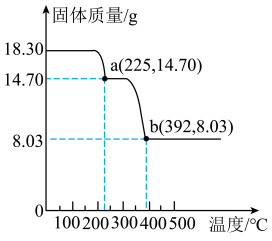
(3)二水合草酸钴受热易分解,在不同的温度下分解产物不同。18.30g二水合草酸钴在空气中的热重曲线如图所示。已知二水合草酸钴在温度较低时易失去结晶水,在温度较高时易分解生成氧化物。250℃时,固体物质为_______ (填化学式);500℃时在空气中灼烧二水合草酸钴使其分解的化学方程式为_______ (提示:500℃时,钴的氧化物可能为CoO、Co2O3或(Co3O4中的一种)。
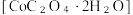 常用于制指示剂、催化剂及有机合成中间体。某同学在实验室按如下步骤制备二水合草酸钴:
常用于制指示剂、催化剂及有机合成中间体。某同学在实验室按如下步骤制备二水合草酸钴:在一定温度下,将(
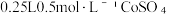 溶液加入
溶液加入 的
的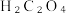 溶液中,保温、搅拌反应0.5h后,静置3h,过滤,固体用冷的蒸馏水洗涤数次。
溶液中,保温、搅拌反应0.5h后,静置3h,过滤,固体用冷的蒸馏水洗涤数次。已知:H2C2O4为二元弱酸。
请回答下列问题:
(1)用草酸晶体(
 配制
配制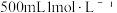 草酸溶液。
草酸溶液。①需要使用到的玻璃仪器有量筒、玻璃棒、烧杯、
②用托盘天平称取
a.砝码生锈 b.草酸晶体失去部分结晶水
c.定容时仰视刻度线 d.称量时砝码与药品位置放反了
(2)CoSO4溶液加入
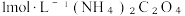 溶液中发生反应生成二水合草酸钴的化学方程式为
溶液中发生反应生成二水合草酸钴的化学方程式为(3)二水合草酸钴受热易分解,在不同的温度下分解产物不同。18.30g二水合草酸钴在空气中的热重曲线如图所示。已知二水合草酸钴在温度较低时易失去结晶水,在温度较高时易分解生成氧化物。250℃时,固体物质为
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐1】用一种试剂除去下列各物质中的杂质(括号内为杂质),并写出反应的离子方程式。
(1)FeSO4(CuSO4):
所需试剂(填化学式)_____________ ,所涉及的离子方程式:______________________ 。
(2)O2(CO2):
所需试剂(填化学式)_____________ ,所涉及的离子方程式:______________________ 。
(1)FeSO4(CuSO4):
所需试剂(填化学式)
(2)O2(CO2):
所需试剂(填化学式)
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】填写下列除杂的试剂与操作:
(1)溴苯(Br2)__________________
(2)苯(苯酚)__________________
(3)甲烷(乙烯)__________________
(4)乙酸乙酯(乙酸、乙醇)______________
(5)乙醇(H2O)__________________
(6)肥皂(甘油)__________________
(1)溴苯(Br2)
(2)苯(苯酚)
(3)甲烷(乙烯)
(4)乙酸乙酯(乙酸、乙醇)
(5)乙醇(H2O)
(6)肥皂(甘油)
您最近半年使用:0次



