在20 L的恒容密闭容器中,加入3 mol SO3(g)和1 mol氧气,在某温度下使其反应,反应至4 min时,氧气的浓度为0.06 mol/L,反应至8 min时达平衡状态。
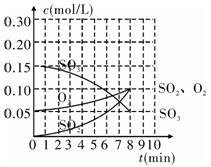
(1)在0~4 min内生成O2的平均速率v(O2)=___ mol/(L·min)。
(2)整个过程中,各物质的浓度与时间的关系如图所示,则该温度下的平衡常数K=______ 。
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于0.05 mol/L的是______ ,此时的平衡常数与(2)中相比________ (填“增大”、“减小”或“不变”)。

(1)在0~4 min内生成O2的平均速率v(O2)=
(2)整个过程中,各物质的浓度与时间的关系如图所示,则该温度下的平衡常数K=
(3)若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于0.05 mol/L的是
| 选项 | A | B | C | D |
| SO3 | 1 mol | 3 mol | 3 mol | 0 mol |
| SO2 | 2 mol | 1.5 mol | 0 mol | 6 mol |
| O2 | 2 mol | 1 mol | 0 mol | 5 mol |
更新时间:2016-12-09 09:58:34
|
【知识点】 化学平衡
相似题推荐
填空题
|
较难
(0.4)
【推荐1】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
将水蒸气通过红热的碳即可产生水煤气。反应为:
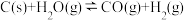
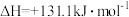
一定温度下,在一个容积固定的密闭容器中,发生上述反应,下列不能判断该反应达到化学平衡状态的是_______ (填字母)。
a.容器中的压强不变
b.1 mol H-H键断裂的同时断裂2 mol H-O键
c.υ正(CO)=υ逆(H2)
d.c (CO) =" c" (H2) e、υ(H2O):υ(CO):υ(H2)=1:1:1
(2) 将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应
CO(g)+H2O(g) ⇌CO2 (g)+H2 (g) ,得到如下三组数据:
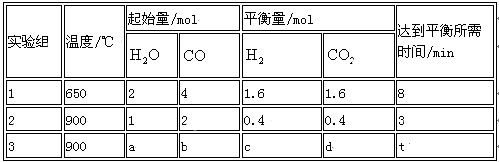
① 实验1中从开始到达平衡时CO表示反应的平均速率为________________ mol/(l·min),CO(g)的转化率为____________ 。
② 实验2中H2O(g)的转化率为___________ ,该反应的逆反应为_______ (填“吸”或“放”)热反应。
③ 若实验3平衡时要达到与实验2中平衡时各物质的质量分数分别相等,且t<3min,则a、b应满足的关系 是______________ (用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2 (g)+3H2 (g) ⇌CH3OH(g)+H2O(g)图(1)表示该反应进行过程中能量(单位为kJ・mol-1。)的变化。
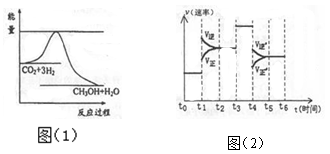
① 在体积为1 L的恒容密闭容器中,充入l molCO2和3molH2,下列措施中能使 c (CH3OH)增大的是_______ (填字母)
a.升高温度
b.充入He (g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入l mol CO2和3 molH2
② 当反应达到平衡时不断改变一个条件(但不改变各组分物质的量和状态)反应速率随时间的变化如图(2): 其中表示平衡混合物中CH3OH含量最高的一段时间是_______ ;t1~t2改变的条件为______________ 若t0~t1平衡常数为K1, t2~t3平衡常数为K2 ,则K1 _______ K2 (填“>”、“=”或“<”)。
将水蒸气通过红热的碳即可产生水煤气。反应为:
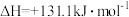
一定温度下,在一个容积固定的密闭容器中,发生上述反应,下列不能判断该反应达到化学平衡状态的是
a.容器中的压强不变
b.1 mol H-H键断裂的同时断裂2 mol H-O键
c.υ正(CO)=υ逆(H2)
d.c (CO) =" c" (H2) e、υ(H2O):υ(CO):υ(H2)=1:1:1
(2) 将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应
CO(g)+H2O(g) ⇌CO2 (g)+H2 (g) ,得到如下三组数据:

① 实验1中从开始到达平衡时CO表示反应的平均速率为
② 实验2中H2O(g)的转化率为
③ 若实验3平衡时要达到与实验2中平衡时各物质的质量分数分别相等,且t<3min,则a、b应满足的关系 是
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2 (g)+3H2 (g) ⇌CH3OH(g)+H2O(g)图(1)表示该反应进行过程中能量(单位为kJ・mol-1。)的变化。

① 在体积为1 L的恒容密闭容器中,充入l molCO2和3molH2,下列措施中能使 c (CH3OH)增大的是
a.升高温度
b.充入He (g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入l mol CO2和3 molH2
② 当反应达到平衡时不断改变一个条件(但不改变各组分物质的量和状态)反应速率随时间的变化如图(2): 其中表示平衡混合物中CH3OH含量最高的一段时间是
您最近半年使用:0次
填空题
|
较难
(0.4)
【推荐2】铜及其化合物在工农业生产及日常生活中应用非常广泛。回答下列问题:
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,制取Cu2O的两种方法如下表所示。
① 方法I中还原剂与氧化剂的物质的量之比为________。
② 方法II发生反应的化学方程式为______________。
(2)氢化亚铜是一种红色同体,可由下列反应制备:
4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
该反应中每转移3 mol电子,生成CuH的物质的量为___________mol。
(3)氯化铜溶液中各种含铜微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与c(C1-)之间的关系如图所示。

① 当c(C1-)=" 9" mol/L时,溶液中3种主要含铜微粒浓度的大小关系为__________。
② 在c(C1-)=" l" mol /L的氯化铜溶液中,加入AgNO3溶液,CuCl+转化为Cu2+的离子方程式为____________。
(4)已知:Cu(OH)2是二元弱碱,25℃时Ksp[Cu(OH)2]=2.0×10-20。则此温度下在铜盐溶液中Cu2+发生水解反应的平衡常数为______________。
(1)纳米级Cu2O由于具有优良的催化性能而受到关注,制取Cu2O的两种方法如下表所示。
| 方法I | 用炭粉在高温条件下还原CuO生成Cu2O和CO2 |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
① 方法I中还原剂与氧化剂的物质的量之比为________。
② 方法II发生反应的化学方程式为______________。
(2)氢化亚铜是一种红色同体,可由下列反应制备:
4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4
该反应中每转移3 mol电子,生成CuH的物质的量为___________mol。
(3)氯化铜溶液中各种含铜微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与c(C1-)之间的关系如图所示。

① 当c(C1-)=" 9" mol/L时,溶液中3种主要含铜微粒浓度的大小关系为__________。
② 在c(C1-)=" l" mol /L的氯化铜溶液中,加入AgNO3溶液,CuCl+转化为Cu2+的离子方程式为____________。
(4)已知:Cu(OH)2是二元弱碱,25℃时Ksp[Cu(OH)2]=2.0×10-20。则此温度下在铜盐溶液中Cu2+发生水解反应的平衡常数为______________。
您最近半年使用:0次
填空题
|
较难
(0.4)
【推荐3】研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。在催化剂作用下,CO可用于合成甲醇:CO(g) + 2H2(g)  CH3OH(g)。
CH3OH(g)。
(1)若在恒温恒压的条件下,向密闭容器中充入4 mol CO和8 mol H2,合成甲醇,平衡时CO的转化率与温度、压强的关系如图所示:

①该反应的正反应属于________ 反应(填吸热或放热)。
②在0.1 MPa、100 ℃的条件下,该反应达到平衡时容器内气体的物质的量为_________ mol。
(2)若在恒温恒容的条件下,向上述平衡体系中充入4 mol CO,8 mol H2,与(1)相比,达到平衡时CO转化率_______ (填增大,不变或减小), 平衡常数K_______ (填增大,不变或减小)。
(3)在上述合成甲醇的反应中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:①CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH = +206.2 kJ·mol-1
②CH4(g) + CO2(g) = 2CO(g) + 2H2(g) ΔH = +247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为:_________________________ 。
 CH3OH(g)。
CH3OH(g)。(1)若在恒温恒压的条件下,向密闭容器中充入4 mol CO和8 mol H2,合成甲醇,平衡时CO的转化率与温度、压强的关系如图所示:

①该反应的正反应属于
②在0.1 MPa、100 ℃的条件下,该反应达到平衡时容器内气体的物质的量为
(2)若在恒温恒容的条件下,向上述平衡体系中充入4 mol CO,8 mol H2,与(1)相比,达到平衡时CO转化率
(3)在上述合成甲醇的反应中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:①CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH = +206.2 kJ·mol-1
②CH4(g) + CO2(g) = 2CO(g) + 2H2(g) ΔH = +247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为:
您最近半年使用:0次



