在3个温度、容积相同的1 L密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得一分钟后反应达到平衡时的有关数据如下[已知N2(g)+3H2(g) 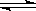 2NH3(g) ΔH=-92.4 kJ·mol-1]:
2NH3(g) ΔH=-92.4 kJ·mol-1]:
(1)由以上数据,甲、乙、丙达平衡时, N2的浓度大小关系为__________________,从反应开始到达到平衡,甲中以H2表示的反应速率是__________。
(2)该温度下,丙中反应2NH3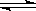 N2+3H2的平衡常数是__________。
N2+3H2的平衡常数是__________。
(3)a+b______92.4(填“<”、“>”或“=”,下同);α1+α3______1。
(4)若要使甲重新达平衡后c(NH3)/c(N2)比值变小,其他条件可采用________。
A.使用催化剂
B.增大氮气浓度
C.升高温度
D.缩小容器体积
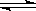 2NH3(g) ΔH=-92.4 kJ·mol-1]:
2NH3(g) ΔH=-92.4 kJ·mol-1]:| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | a1=25% | α2 | α3 |
(1)由以上数据,甲、乙、丙达平衡时, N2的浓度大小关系为__________________,从反应开始到达到平衡,甲中以H2表示的反应速率是__________。
(2)该温度下,丙中反应2NH3
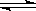 N2+3H2的平衡常数是__________。
N2+3H2的平衡常数是__________。(3)a+b______92.4(填“<”、“>”或“=”,下同);α1+α3______1。
(4)若要使甲重新达平衡后c(NH3)/c(N2)比值变小,其他条件可采用________。
A.使用催化剂
B.增大氮气浓度
C.升高温度
D.缩小容器体积
更新时间:2016-01-12 14:59:15
|
【知识点】 化学平衡
相似题推荐
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】聚乙烯醇生产过程中会产生大量副产物乙酸甲酯,其催化醇解反应可用于制备甲醇和乙酸己酯,该反应的化学方程式为:CH3COOCH3(l)+C6H13OH(l)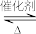 CH3COOC6H13(l)+CH3OH(l)
CH3COOC6H13(l)+CH3OH(l)
已知v正=k正x(CH3COOCH3)·x(C6H13OH),v逆=k逆x(CH3COOC6H13)·x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
(1)反应开始时,己醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。

该醇解反应的ΔH____ 0(填>或<)。348K时,以物质的量分数表示的化学平衡常数Kx=____ (保留2位有效数字)。在曲线①、②、③中,k正-k逆值最大的曲线是____ ;A、B、C、D四点中,v正最大的是___ ,v逆最大的是____ 。
(2)343K时,己醇和乙酸甲酯按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比____ 时,乙酸甲酯转化率最大;与按1:2投料相比,按2:1投料时化学平衡常数Kx___ (填增大、减小或不变)。
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是____ 。
a.参与了醇解反应,但并不改变反应历程 b.使k正和k逆增大相同倍数
c.降低了醇解反应的活化能 d.提高乙酸甲酯的平衡转化率
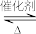 CH3COOC6H13(l)+CH3OH(l)
CH3COOC6H13(l)+CH3OH(l)已知v正=k正x(CH3COOCH3)·x(C6H13OH),v逆=k逆x(CH3COOC6H13)·x(CH3OH),其中v正、v逆为正、逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数。
(1)反应开始时,己醇和乙酸甲酯按物质的量之比1:1投料,测得348K、343K、338K三个温度下乙酸甲酯转化率(α)随时间(t)的变化关系如图所示。

该醇解反应的ΔH
(2)343K时,己醇和乙酸甲酯按物质的量之比1:1、1:2和2:1进行初始投料。则达到平衡后,初始投料比
(3)该醇解反应使用离子交换树脂作催化剂,下列关于该催化剂的说法正确的是
a.参与了醇解反应,但并不改变反应历程 b.使k正和k逆增大相同倍数
c.降低了醇解反应的活化能 d.提高乙酸甲酯的平衡转化率
您最近半年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】工业上一般在密闭容器中采下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
(1)不同温度下的平衡转化率与压强的关系如图所示。
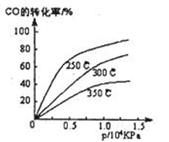
①该反应△H_______ 0(填“>”或“<”),则该反应__________ 自发进行(填“一定能”、“一定不能”、“ 不一定”)
②实际生产条件控制在250℃、1.3×104kPa 左右,选择此压强的理由是_____________ 。
(2)某温度下,将2molCO和6molH2 充入2L 的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.1mol·L-1。
①若此时向体系中再充入0.6molCO 和0.6molCH3OH,则平衡__________ (填“向正反应方向移动”或“向逆反应方向移动”或“不移动”)
②在其他条件不变的情况下,将容器体积压缩到原来的 ,与原平衡相比,下列有关说法正确的是
,与原平衡相比,下列有关说法正确的是_________ (填序号)。
a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH) 增大
③若保持同一温度起始投料为a mol CO、b mol H2、c mol CH3OH,欲使平衡混合物中各组成与原平衡相同,且开始时该反应向逆反应方向进行,c 的取值范围是_____________ 。
 CH3OH(g)
CH3OH(g)(1)不同温度下的平衡转化率与压强的关系如图所示。

①该反应△H
②实际生产条件控制在250℃、1.3×104kPa 左右,选择此压强的理由是
(2)某温度下,将2molCO和6molH2 充入2L 的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.1mol·L-1。
①若此时向体系中再充入0.6molCO 和0.6molCH3OH,则平衡
②在其他条件不变的情况下,将容器体积压缩到原来的
 ,与原平衡相比,下列有关说法正确的是
,与原平衡相比,下列有关说法正确的是a.氢气的浓度减少 b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH) 增大
③若保持同一温度起始投料为a mol CO、b mol H2、c mol CH3OH,欲使平衡混合物中各组成与原平衡相同,且开始时该反应向逆反应方向进行,c 的取值范围是
您最近半年使用:0次
填空题
|
较难
(0.4)
【推荐3】已知:氮气和氢气合成氨反应为:N2(g)+3H2(g) 2NH3(g) ΔH=-92kJ·mol-1
2NH3(g) ΔH=-92kJ·mol-1
请回答下列问题:
(1)取1 mol N2(g)和3 molH2(g)充入一密闭容器中,一定条件下进行反应并达平衡时,测得反应放出的热量_________ 92kJ(填“大于”、“等于”或“小于”), 原因是_____________ ;若升高温度,上述反应中ΔH___________ (填“变大”、“变小”或“不变”)。
(2)已知:分别破坏1molN H键、1mol H
H键、1mol H H键需要吸收的能量为:391 kJ、436 kJ,则破坏1mol N
H键需要吸收的能量为:391 kJ、436 kJ,则破坏1mol N N键需要吸收的能量为
N键需要吸收的能量为_______________ 。
(3)一定条件下,向体积为2L的恒容密闭容器中充入1molNH3(g) 并发生上述反应。半分钟后反应达到平衡,测得v(NH3)=0.40mol/(L•min),则上述合成氨反应的平衡常数为____________ 。
(4)向三个体积均为1L的恒容密闭容器中分别充入1molN2和3molH2,当分别只改变其中一个外界条件时使反应达到平衡,测得氨的体积分数随时间的变化如图所示。
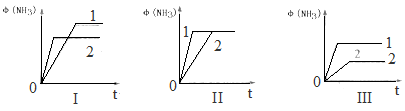
上述图象中,只改变温度的为__________ (填“I”“II”“III”,下同),只改变压强的为_______ ,只改变催化剂的为_________________ 。
(5)若把标准状况下8.96L氨气通入到100g9.8%的硫酸溶液中并完全吸收,所得溶液中离子浓度从大到小的顺序是________________________ 。
(6)常温下,向浓度均为0.1mol/L的MgCl2、FeCl3和AlCl3混合溶液中通入NH3至过量,最先生成沉淀的化学式为____________ ,当pH=_______ 时,开始生成Mg(OH)2沉淀。
(已知:Ksp[Mg(OH)2] =1.0×10-13; Ksp[Fe(OH)3] =1.0×10-40;Ksp[Al(OH)3] =1.0×10-33)
 2NH3(g) ΔH=-92kJ·mol-1
2NH3(g) ΔH=-92kJ·mol-1请回答下列问题:
(1)取1 mol N2(g)和3 molH2(g)充入一密闭容器中,一定条件下进行反应并达平衡时,测得反应放出的热量
(2)已知:分别破坏1molN
 H键、1mol H
H键、1mol H H键需要吸收的能量为:391 kJ、436 kJ,则破坏1mol N
H键需要吸收的能量为:391 kJ、436 kJ,则破坏1mol N N键需要吸收的能量为
N键需要吸收的能量为(3)一定条件下,向体积为2L的恒容密闭容器中充入1molNH3(g) 并发生上述反应。半分钟后反应达到平衡,测得v(NH3)=0.40mol/(L•min),则上述合成氨反应的平衡常数为
(4)向三个体积均为1L的恒容密闭容器中分别充入1molN2和3molH2,当分别只改变其中一个外界条件时使反应达到平衡,测得氨的体积分数随时间的变化如图所示。
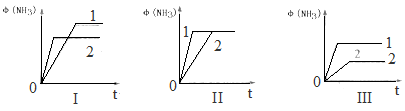
上述图象中,只改变温度的为
(5)若把标准状况下8.96L氨气通入到100g9.8%的硫酸溶液中并完全吸收,所得溶液中离子浓度从大到小的顺序是
(6)常温下,向浓度均为0.1mol/L的MgCl2、FeCl3和AlCl3混合溶液中通入NH3至过量,最先生成沉淀的化学式为
(已知:Ksp[Mg(OH)2] =1.0×10-13; Ksp[Fe(OH)3] =1.0×10-40;Ksp[Al(OH)3] =1.0×10-33)
您最近半年使用:0次



