化学反应都有能量变化,吸热或放热是化学反应中能量变化的主要形式之一。
(1)化学反应中有能量变化的本质原因是反应过程中有_________ 的断裂和形成。
(2)已知拆开1molH-H键、1molCl-Cl键、1molH—Cl键分别需要的能量是436kJ、243kJ、432kJ,则反应H2(g)+ Cl2(g)=2HCl (g) 的△H =___________ 。
(3)已知:CO(g) + 1/2O2(g) = CO2(g) △H = -283.0 kJ/mol
CH3OH(l) + 3/2O2(g) = CO2(g)+2H2O(l) △H = -726.5 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________ 。
(4)已知25℃、101 kPa下,稀的强酸与稀的强碱溶液反应的中和热为 -57.3 kJ/mol。
①表示稀硫酸与稀烧碱溶液中和反应的热化学方程式为________________ ;
②测定中和热实验中所需的玻璃仪器有烧杯、量筒、环形玻璃搅拌棒、_______________ 。
(1)化学反应中有能量变化的本质原因是反应过程中有
(2)已知拆开1molH-H键、1molCl-Cl键、1molH—Cl键分别需要的能量是436kJ、243kJ、432kJ,则反应H2(g)+ Cl2(g)=2HCl (g) 的△H =
(3)已知:CO(g) + 1/2O2(g) = CO2(g) △H = -283.0 kJ/mol
CH3OH(l) + 3/2O2(g) = CO2(g)+2H2O(l) △H = -726.5 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为
(4)已知25℃、101 kPa下,稀的强酸与稀的强碱溶液反应的中和热为 -57.3 kJ/mol。
①表示稀硫酸与稀烧碱溶液中和反应的热化学方程式为
②测定中和热实验中所需的玻璃仪器有烧杯、量筒、环形玻璃搅拌棒、
更新时间:2016-12-09 10:54:51
|
【知识点】 化学反应热的计算
相似题推荐
填空题
|
较难
(0.4)
【推荐1】物质的类别和核心元素的化合价是研究物质性质的两个基本视角。
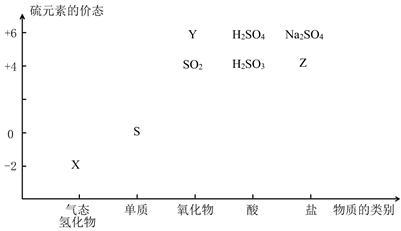
(1)图中X的电子式为________ ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O______ (填强或弱)。用原子结构解释原因:同主族元素最外层电子数相同,从上到下,________ ,得电子能力逐渐减弱。
(2)Na2S2O3是一种用途广泛的钠盐。
①下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是______ (填字母序号)。
a. Na2S+ S b. Z+ S c. Na2SO3 + Y d. NaHS + NaHSO3
②已知反应:Na2S2O3 + H2SO4 == Na2SO4 + S↓+SO2↑+H2O。研究其反应速率时,下列说法正确的是_________ (填写字母序号)。
a.可通过测定一段时间内生成SO2的体积,得出该反应的速率
b.可通过比较出现浑浊的时间,研究浓度、温度等因素对该反应速率的影响
c.可通过Na2S2O3固体与稀硫酸和浓硫酸的反应,研究浓度对该反应速率的影响
(3)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体。
已知:①CO(g)+ 1/2 O2(g)=CO2(g) △H=-283 kJ·mol-1
②S(s)+ O2(g)=SO2(g) △H=-296 kJ·mol-1
①则治理烟道气反应的热化学方程式为_________ 。
②一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是_________ (填写字母序号)。
a.v (CO) ∶v(SO2) = 2∶1
b.平衡常数不变
c.气体密度不变
d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为 ,则SO2的转化率为
,则SO2的转化率为_________ 。

(1)图中X的电子式为
(2)Na2S2O3是一种用途广泛的钠盐。
①下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是
a. Na2S+ S b. Z+ S c. Na2SO3 + Y d. NaHS + NaHSO3
②已知反应:Na2S2O3 + H2SO4 == Na2SO4 + S↓+SO2↑+H2O。研究其反应速率时,下列说法正确的是
a.可通过测定一段时间内生成SO2的体积,得出该反应的速率
b.可通过比较出现浑浊的时间,研究浓度、温度等因素对该反应速率的影响
c.可通过Na2S2O3固体与稀硫酸和浓硫酸的反应,研究浓度对该反应速率的影响
(3)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体。
已知:①CO(g)+ 1/2 O2(g)=CO2(g) △H=-283 kJ·mol-1
②S(s)+ O2(g)=SO2(g) △H=-296 kJ·mol-1
①则治理烟道气反应的热化学方程式为
②一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是
a.v (CO) ∶v(SO2) = 2∶1
b.平衡常数不变
c.气体密度不变
d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为
 ,则SO2的转化率为
,则SO2的转化率为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】甲醇是一种优质燃料,在工业上常用CO和H2合成甲醇,反应方程式为CO(g)+2H2(g) =CH3OH(g)。
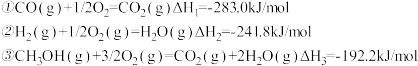
(1)计算CO(g)+2H2(g)=CH3OH(g)的反应热△H4=____________ 。
(2)为了提高燃料的利用率可以将甲醇设计为燃料电池,并用以此为电源进行电解实验,装置如图所示,回答相关问题。
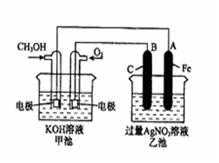
①写出通甲醇一极的电极反应方程式________________ ;写出乙池中B(C)电极的电极反应式________________ ;
②反应过程中,乙池溶液pH的变化为________________ (升 高、降低或不变)
③当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2_________ mL(标准状况下)
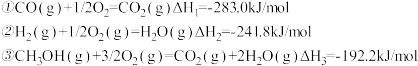

(1)计算CO(g)+2H2(g)=CH3OH(g)的反应热△H4=
(2)为了提高燃料的利用率可以将甲醇设计为燃料电池,并用以此为电源进行电解实验,装置如图所示,回答相关问题。

①写出通甲醇一极的电极反应方程式
②反应过程中,乙池溶液pH的变化为
③当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】空气质量与我们的健康息息相关,目前我国通过监测6项污染物的百分比浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物。
(1)上述3种气体直接排入空气后会引起酸雨的气体有_______________ (填化学式)。
(2)早期人们曾经使用铅室法生产硫酸,其主要反应为:SO2(g)+NO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
①若已知2SO2(g)+O2(g) 2SO3(g) + Q1 2NO(g)+O2(g)
2SO3(g) + Q1 2NO(g)+O2(g)  2NO2(g) + Q2
2NO2(g) + Q2
则SO2(g)+NO2(g) SO3(g)+NO(g)+ Q3 , Q3=
SO3(g)+NO(g)+ Q3 , Q3=_________ kJ·mol-1。
②一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生反应:SO2(g)+NO2(g) SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是
SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是____ (选填序号)。
a.体系压强保持不变 b.混合气体的颜色保持不变
c.NO的物质的量保持不变 d.每生成1 mol SO3的同时消耗1 mol NO2
(3)矿石燃料的燃烧是造成酸雨的主要因素之一 。而甲醇日趋成为重要的有机燃料,通常利用CO和H2 合成甲醇,其反应的化学方程式为CO(g)+ 2H2(g) CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
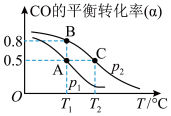
①上述合成甲醇的反应为________ 反应(填“放热”或“吸热”)。
②A、B、C三点的平衡常数KA、KB、KC的大小关系为_____________________ 。
(1)上述3种气体直接排入空气后会引起酸雨的气体有
(2)早期人们曾经使用铅室法生产硫酸,其主要反应为:SO2(g)+NO2(g)
 SO3(g)+NO(g)
SO3(g)+NO(g)①若已知2SO2(g)+O2(g)
 2SO3(g) + Q1 2NO(g)+O2(g)
2SO3(g) + Q1 2NO(g)+O2(g)  2NO2(g) + Q2
2NO2(g) + Q2则SO2(g)+NO2(g)
 SO3(g)+NO(g)+ Q3 , Q3=
SO3(g)+NO(g)+ Q3 , Q3=②一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生反应:SO2(g)+NO2(g)
 SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是
SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是a.体系压强保持不变 b.混合气体的颜色保持不变
c.NO的物质的量保持不变 d.每生成1 mol SO3的同时消耗1 mol NO2
(3)矿石燃料的燃烧是造成酸雨的主要因素之一 。而甲醇日趋成为重要的有机燃料,通常利用CO和H2 合成甲醇,其反应的化学方程式为CO(g)+ 2H2(g)
 CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
①上述合成甲醇的反应为
②A、B、C三点的平衡常数KA、KB、KC的大小关系为
您最近一年使用:0次



