电化学在工业生产中有广泛应用。
(1)右图所示装置中,两玻璃管及烧杯中是滴有酚酞的NaCl饱和溶液,
C(I)、C(II)为多孔石墨电极。

①电解NaCl饱和溶液的化学方程式为______________________________________ 。
②接通S1后,C(I)附近溶液变红,两玻璃管中有气体生成。则电极C(I)是________ (填“阳”或“阴”)极;检验C(II)电极反应所得气体产物的方法和现象是______________________________ 。
③一段时间后(玻璃管中液面未脱离电极),断开S1,则C(I)、C(II)两玻璃管内气体的体积V(I)、V(II)的关系是:V(I)_____ V(II)(填“>”、 “=”或 “<”) 。断开S1接通S2,电流表的指针发生偏转,此时电极C(II)是_____ (填“正”或“负”)极;C(I)的电极反应是:____________________ 。
(2)若用此装置精炼粗铜,断开S2,接通S1,电解液选用CuSO4溶液,当电路中有0.04 mol电子通过时,阴极增重_________ g。
(1)右图所示装置中,两玻璃管及烧杯中是滴有酚酞的NaCl饱和溶液,
C(I)、C(II)为多孔石墨电极。

①电解NaCl饱和溶液的化学方程式为
②接通S1后,C(I)附近溶液变红,两玻璃管中有气体生成。则电极C(I)是
③一段时间后(玻璃管中液面未脱离电极),断开S1,则C(I)、C(II)两玻璃管内气体的体积V(I)、V(II)的关系是:V(I)
(2)若用此装置精炼粗铜,断开S2,接通S1,电解液选用CuSO4溶液,当电路中有0.04 mol电子通过时,阴极增重
9-10高二下·北京·期末 查看更多[1]
(已下线)2010年北京五中高二下学期期末考试化学试题
更新时间:2010-09-14 16:12:25
|
相似题推荐
填空题
|
较难
(0.4)
名校
【推荐1】氨在国民经济中占有重要地位。
I.合成氨工业中,初始时氮气、氢气的体积比为1:3时,每反应1mol N2,放出92.2kJ热量。如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,平衡混合物中氨的体积分数。

①由图可知:p1、p2、p3的大小关系为________ ,理由是_____________________________
②A、B点生成氨气的速率大小关系为_____________ ,C点,N2的转化率为_____ 。
③下列关于合成氨的说法正确的是_________ (填序号)。
A.断开1个N≡N键的同时有6个N—H键形成,反应一定达到平衡状态
B.混合气体的平均相对分子质量不再改变状态,反应一定达到平衡状态
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
D.增大n(N2):n(H2)的比值,有利用提离H2的转化率
II.最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其电池反应为4NH3+3O2==2N2+6H2O,写出负极的电极反应式:__________________
I.合成氨工业中,初始时氮气、氢气的体积比为1:3时,每反应1mol N2,放出92.2kJ热量。如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,平衡混合物中氨的体积分数。

①由图可知:p1、p2、p3的大小关系为
②A、B点生成氨气的速率大小关系为
③下列关于合成氨的说法正确的是
A.断开1个N≡N键的同时有6个N—H键形成,反应一定达到平衡状态
B.混合气体的平均相对分子质量不再改变状态,反应一定达到平衡状态
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
D.增大n(N2):n(H2)的比值,有利用提离H2的转化率
II.最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其电池反应为4NH3+3O2==2N2+6H2O,写出负极的电极反应式:
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g) CH3OH(g) ΔH;下表所列数据是该反应在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH;下表所列数据是该反应在不同温度下的化学平衡常数(K)。
①根据表中数据可判断ΔH______ 0 (填“>”、“=”或“<”)。
②在300℃时,将2 mol CO、3 mol H2和2 mol CH3OH充入容积为1L的密闭容器中,此时反应将_____ (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
(2)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为:________ ,随着反应的不断进行溶液的pH___ (填“增大”“减小”或“不变”)。
(3)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为:_________________ ;如果电解一段时间后NaCl溶液的体积为1L,溶液的pH为12(25℃下测定),则理论上消耗氧气的体积为_______ mL(标况下)。
(1)工业上合成甲醇的反应原理为:CO(g)+2H2(g)
 CH3OH(g) ΔH;下表所列数据是该反应在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH;下表所列数据是该反应在不同温度下的化学平衡常数(K)。 | 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①根据表中数据可判断ΔH
②在300℃时,将2 mol CO、3 mol H2和2 mol CH3OH充入容积为1L的密闭容器中,此时反应将
(2)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为:
(3)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为:
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】水煤气不仅是合成氨的原料气也是合成烃及其化工产品的原料。
(1)直接水煤气燃料电池中,通CO、H2的极为电池的______ 极(选填:“正”,“负”)。
(2)水煤气变换反应:CO(g) + H2O(g) CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有
CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有_____ (不定项选择)。
a.升高温度 b.加入催化剂 c.增大压强 d.降低浓度
(3)由水煤气可以合成甲醇(CH3OH)。已知0.5 mol CH3OH(l)完全燃烧生成二氧化碳气体和液态水时放出热量为363.2 kJ,写出CH3OH(l)燃烧的热化学方程式_____________ 。
(1)直接水煤气燃料电池中,通CO、H2的极为电池的
(2)水煤气变换反应:CO(g) + H2O(g)
 CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有
CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有a.升高温度 b.加入催化剂 c.增大压强 d.降低浓度
(3)由水煤气可以合成甲醇(CH3OH)。已知0.5 mol CH3OH(l)完全燃烧生成二氧化碳气体和液态水时放出热量为363.2 kJ,写出CH3OH(l)燃烧的热化学方程式
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来处理含 废水,如下图所示;电解过程中溶液发生反应:
废水,如下图所示;电解过程中溶液发生反应: +6Fe2++14H+=2Cr3++6Fe3++7H2O,工作一段时间后,乙池中
+6Fe2++14H+=2Cr3++6Fe3++7H2O,工作一段时间后,乙池中 减少0.1mol。
减少0.1mol。

(1)工作时,甲池内的NO3-向石墨_______ 极移动(填“I”或“II”);在相同条件下,消耗的O2和NO2的体积比为_______ 。
(2)甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用。则石墨I是电池的_______ 极;石墨I附近发生的电极反应式为_______ 。
(3)丙池中阳极的电极反应式为_______ ,阳极产生气体的体积为_______ L(标况下),若阴极生成气体为6.72L(标况下),则可以加入_______ 复原(填字母序号)。
A.0.3molCu(OH)2 B.0.15molCu2(OH)2CO3 C.0.3molCuO D.0.3molCuCO3
 废水,如下图所示;电解过程中溶液发生反应:
废水,如下图所示;电解过程中溶液发生反应: +6Fe2++14H+=2Cr3++6Fe3++7H2O,工作一段时间后,乙池中
+6Fe2++14H+=2Cr3++6Fe3++7H2O,工作一段时间后,乙池中 减少0.1mol。
减少0.1mol。
(1)工作时,甲池内的NO3-向石墨
(2)甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用。则石墨I是电池的
(3)丙池中阳极的电极反应式为
A.0.3molCu(OH)2 B.0.15molCu2(OH)2CO3 C.0.3molCuO D.0.3molCuCO3
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】党的二十大报告提出,加强基础研究,突出原创,鼓励自由探索。一氧化氮-空气质子交换膜燃料电池将化学能转化为电能,实现了制硝酸、发电环保三位一体的结合。如图所示,某同学设计用该电池探究将雾霾中的SO2、NO转化为(NH4)2SO4的原理和粗铜的精炼原理。

(1)燃料电池放电过程中负极的电极反应式___________ 。
(2)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,CuSO4溶液的浓度将___________ (填“增大”、“减小”或“不变”)。
(3)乙装置中物质A是___________ (填化学式);阴极的电极反应式是___________ 。
(4)若在标准状况下,甲装置有11.2LO2参加反应,则乙装置中转化SO2和NO的物质的量共有___________ mol;丙装置中阴极析出铜的质量为___________ g。

(1)燃料电池放电过程中负极的电极反应式
(2)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,CuSO4溶液的浓度将
(3)乙装置中物质A是
(4)若在标准状况下,甲装置有11.2LO2参加反应,则乙装置中转化SO2和NO的物质的量共有
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
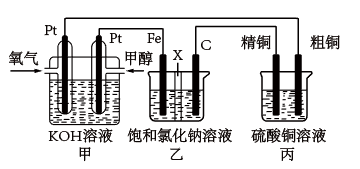
【推荐3】如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理, 其中乙装置中 X 为阳离子交换膜。
根据要求回答相关问题:
(1)写出负极的电极反应式_____
(2)写出石墨电极的电极反应式_____________
(3)反应一段时间后,乙装置中生成氢氧化钠主要在_________ (填“铁极”或“石墨极”)区。
(4)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为_________ ,反应一段时间,硫酸铜溶液浓度将_____ (填“增大”“减小”或“不变”)。
(5)若在标准状况下,有 2.24 L 氧气参加反应,则乙装置中铁电极上生成的气体的分子数目为_____ ;丙装置中阴极析出铜的质量为_____ 。

根据要求回答相关问题:
(1)写出负极的电极反应式
(2)写出石墨电极的电极反应式
(3)反应一段时间后,乙装置中生成氢氧化钠主要在
(4)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为
(5)若在标准状况下,有 2.24 L 氧气参加反应,则乙装置中铁电极上生成的气体的分子数目为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】 是一种高效、安全消毒剂。目前已开发出多种电解法制取
是一种高效、安全消毒剂。目前已开发出多种电解法制取 气体的新工艺,方法一:如图乙,电解精制饱和食盐水制取
气体的新工艺,方法一:如图乙,电解精制饱和食盐水制取 ;方法二:如图丙,电极上通入
;方法二:如图丙,电极上通入 
 酸性溶液中电解
酸性溶液中电解 制取
制取 。某浓差电池的示意图如图丁,该电池既能提供电能,又能产生产生多种化学品。
。某浓差电池的示意图如图丁,该电池既能提供电能,又能产生产生多种化学品。
(1)图甲中,操作Ⅰ、Ⅱ为_______ ,试剂 Ⅱ为_______ (填化学式)
(2)图乙中,电解精制饱和食盐水产生 的电极反应式为
的电极反应式为________ ;电解一段时间,若有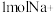 通过离子交换膜,在电极A上产生的气体体积(标准状况)为
通过离子交换膜,在电极A上产生的气体体积(标准状况)为______ L。
(3)图丙中,阴极电极反应式为_______ ;电解一段时间后,阴极区(溶液体积变化忽略不计 溶液的 pH
溶液的 pH______ (填“变大”、“变小”、“不变”)
(4)若以图丁所示电池作图乙的电源,则 a端与______ 相连(填 “e”或 “f”),图乙中阳极的另一产物可不断补充到图丁的正极区,该物质是_______ (填化学式)
(5)工业生产中,还可以用酸性 溶液还原
溶液还原 制得
制得 ,则每生成0.2mol
,则每生成0.2mol ,转移电子的数目为
,转移电子的数目为___________ 。
 是一种高效、安全消毒剂。目前已开发出多种电解法制取
是一种高效、安全消毒剂。目前已开发出多种电解法制取 气体的新工艺,方法一:如图乙,电解精制饱和食盐水制取
气体的新工艺,方法一:如图乙,电解精制饱和食盐水制取 ;方法二:如图丙,电极上通入
;方法二:如图丙,电极上通入 
 酸性溶液中电解
酸性溶液中电解 制取
制取 。某浓差电池的示意图如图丁,该电池既能提供电能,又能产生产生多种化学品。
。某浓差电池的示意图如图丁,该电池既能提供电能,又能产生产生多种化学品。
(1)图甲中,操作Ⅰ、Ⅱ为
(2)图乙中,电解精制饱和食盐水产生
 的电极反应式为
的电极反应式为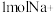 通过离子交换膜,在电极A上产生的气体体积(标准状况)为
通过离子交换膜,在电极A上产生的气体体积(标准状况)为(3)图丙中,阴极电极反应式为
 溶液的 pH
溶液的 pH(4)若以图丁所示电池作图乙的电源,则 a端与
(5)工业生产中,还可以用酸性
 溶液还原
溶液还原 制得
制得 ,则每生成0.2mol
,则每生成0.2mol ,转移电子的数目为
,转移电子的数目为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】电化学知识给人类的生活和工业生产带来极大的方便。回答下列问题:
(1)碱性锌锰电池的总反应式为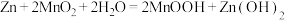 。负极材料为
。负极材料为___________ ,该电池正极反应式为___________ 。___________ 。
(3)用如图装置电解硫酸钾溶液,可获得H2、O2、硫酸和氢氧化钾溶液。X电极上发生的电极反应为___________ 。氢氧化钾溶液从___________ 口导出(填“A”或“D”),M、N交换膜中属于阳离子交换膜的是___________ (填“M”或“N”)。
(4)如图所示,若电解10min时,测得银电极的质量减少5.40g。试回答下列问题:___________ (填“正”或“负”)极。
②通电10min时,B中共收集到392mL(标准状况)气体,溶液体积为200mL(电解前后溶液的体积变化忽略不计),则通电前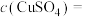
___________ mol/L,如果电解后要使该电解液复原,可以加入物质的化学式为___________ 。
(1)碱性锌锰电池的总反应式为
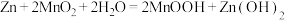 。负极材料为
。负极材料为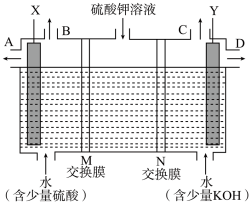
(3)用如图装置电解硫酸钾溶液,可获得H2、O2、硫酸和氢氧化钾溶液。X电极上发生的电极反应为
(4)如图所示,若电解10min时,测得银电极的质量减少5.40g。试回答下列问题:
②通电10min时,B中共收集到392mL(标准状况)气体,溶液体积为200mL(电解前后溶液的体积变化忽略不计),则通电前
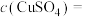
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
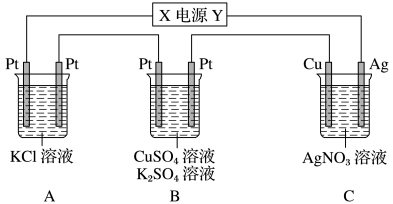
【推荐3】(1)根据右图回答①②:

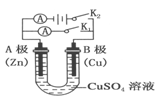
①断开 K2,闭合 K1。B 极的电极反应式为__________ 。
②断开 K1,闭合 K2。B 极的电极反应式为__________ 。
(2)根据右图回答③④:
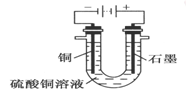
③将较纯净的CuSO4溶液放入如图2 所示的装置中进行电解电解反应的离子方程式为___________________ 。
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积________ L。
(3)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的 NO),装置如图所示:

阴极区的电极反应式为_________ 。
(4)银锌碱性电池的电解质溶液为 KOH 溶液,电池放电时正极的 Ag2O2 (Ag 为+2价) 转化为Ag ,负极的Zn转化为K2Zn(OH)4,写出该电池总反应方程式______ 。


①断开 K2,闭合 K1。B 极的电极反应式为
②断开 K1,闭合 K2。B 极的电极反应式为
(2)根据右图回答③④:

③将较纯净的CuSO4溶液放入如图2 所示的装置中进行电解电解反应的离子方程式为
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积
(3)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的 NO),装置如图所示:

阴极区的电极反应式为
(4)银锌碱性电池的电解质溶液为 KOH 溶液,电池放电时正极的 Ag2O2 (Ag 为+2价) 转化为Ag ,负极的Zn转化为K2Zn(OH)4,写出该电池总反应方程式
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】根据电化学知识回答下列问题。
Ⅰ、某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。

(1)X极与电源的_____ (填正或负)极相连,氢气从____ (选填A、 B、C或D)口导出。
(2)离子交换膜只允许一类离子通过,则M为________ (填阴离子或阳离子,下同)交换膜,N为________ 交换膜。
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池正极的电极反应式为___________________
Ⅱ、铅蓄电池是常见的二次电池,其放电反应和充电反应表示如下:Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(l)
2PbSO4(s)+2H2O(l)
写出它放电时正极的电极反应式______________________________________ ;
充电时阴极的电极反应式______________________________________________ 。
Ⅰ、某小组同学设想用如图装置电解硫酸钾溶液来制取氧气、氢气、硫酸和氢氧化钾。

(1)X极与电源的
(2)离子交换膜只允许一类离子通过,则M为
(3)若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池(石墨为电极),则电池正极的电极反应式为
Ⅱ、铅蓄电池是常见的二次电池,其放电反应和充电反应表示如下:Pb(s)+PbO2(s)+2H2SO4(aq)
 2PbSO4(s)+2H2O(l)
2PbSO4(s)+2H2O(l)写出它放电时正极的电极反应式
充电时阴极的电极反应式
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】利用银镜反应给玻璃镀上一层银是化学镀的一种,某化学兴趣小组设计的给ABS工程塑料零件先化学镀,后电镀的工艺流程如下,回答下列问题:

(1)塑料零件不能直接进行电镀的原因是____________________ ,Na2CO3溶液可用于除去塑料零件表面的油污,理由是____________________ (用离子方程式表示)。
(2)粗化是利用粗化液与塑料表面的高分子化合物反应,使塑料表面粗糙不平;粗化液的主要成分CrO3(铬酐),由重铬酸钠与浓硫酸加热熔融反应、再分离除去硫酸氢钠制得,写出该反应的化学方程式____________________ 。
(3)经粗化的塑料表面浸渍过敏化剂氯化亚锡溶液,表面吸附一层易于氧化的Sn2+离子。用氯化亚锡晶体(SnCl2·2H2O)配制氯化亚锡溶液时,还需要的试剂有____________________ 。
(4)活化是将经过敏化处理的塑料与硝酸银溶液反应,在塑料表面吸附一层具有催化活性的金属微粒,写出生成有催化活性的金属微粒的离子方程式____________________ 。
(5)将经活化处理的塑料置于含有Cu(OH)2、HCHO、NaOH的化学镀铜液中一段时间,可以在塑料表面镀上一层厚度为0.05-0.2μm的金属导电薄层,同时生成HCOONa和H2,若两种还原产物的物质的量相等,写出该反应的化学方程式____________________ 。
(6)塑料经化学镀的镀层厚度不能满足产品的防腐、耐磨等方面的要求,必须采用电镀镀到所需的厚度,电镀时,有金属导电薄层的塑料作电镀池的_____ 极,维持电流强度为1.5A,电镀5分钟,理论上塑料表面析出铜__________ g。(已知F=96500C·mol-1)

(1)塑料零件不能直接进行电镀的原因是
(2)粗化是利用粗化液与塑料表面的高分子化合物反应,使塑料表面粗糙不平;粗化液的主要成分CrO3(铬酐),由重铬酸钠与浓硫酸加热熔融反应、再分离除去硫酸氢钠制得,写出该反应的化学方程式
(3)经粗化的塑料表面浸渍过敏化剂氯化亚锡溶液,表面吸附一层易于氧化的Sn2+离子。用氯化亚锡晶体(SnCl2·2H2O)配制氯化亚锡溶液时,还需要的试剂有
(4)活化是将经过敏化处理的塑料与硝酸银溶液反应,在塑料表面吸附一层具有催化活性的金属微粒,写出生成有催化活性的金属微粒的离子方程式
(5)将经活化处理的塑料置于含有Cu(OH)2、HCHO、NaOH的化学镀铜液中一段时间,可以在塑料表面镀上一层厚度为0.05-0.2μm的金属导电薄层,同时生成HCOONa和H2,若两种还原产物的物质的量相等,写出该反应的化学方程式
(6)塑料经化学镀的镀层厚度不能满足产品的防腐、耐磨等方面的要求,必须采用电镀镀到所需的厚度,电镀时,有金属导电薄层的塑料作电镀池的
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】如图,E为沾有Na2SO4溶液的滤纸,并加入几滴酚酞。A,B分别为Pt片,压在滤纸两端,R、S为电池的电极。M、N是用多微孔的Ni制成的电极材料,它在碱性溶液中可以视为惰性电极。G为电流计,K为开关。C、D和电解池中都充满浓KOH溶液。若在滤纸中央点上一滴紫色的KMnO4溶液,打开K,接通电源一段时间后,C、D中有气体产生。

(1)R为________ (填“正”或“负”)极。
(2)A极附近溶液的现象是____________ ,B极附近发生的电极反应式为_______________ 。
(3)滤纸上的紫色点向________ (填“A”或“B”)方移动。
(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,C中的电极为____ 极,电极反应式为_______________ 。
(5)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。右图是通过人工光合作用制备HCOOH的原理示意图,催化剂a附近酸性,催化剂b表面的反应是______________ 。

(1)R为
(2)A极附近溶液的现象是
(3)滤纸上的紫色点向
(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,经过一段时间,C、D中气体逐渐减少,C中的电极为
(5)人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。右图是通过人工光合作用制备HCOOH的原理示意图,催化剂a附近酸性,催化剂b表面的反应是
您最近一年使用:0次



