为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:

部分含钒物质在水中的溶解性如下:
(1)图中所示滤液中含钒的主要成分为_________ (写化学式)。
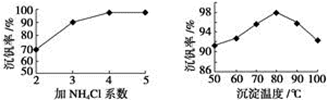
(2)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式___________________ ;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为_________ 和__________ 。
(3)用硫酸酸化的H2C2O4溶液和(VO2)2SO4溶液反应,以测定反应②后溶液中含钒量,完成反应的离子方程式为:________ (4)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:VO2+ + V2+ + 2H+  VO2+ + H2O + V3+,电池放电时正极的电极反应式为
VO2+ + H2O + V3+,电池放电时正极的电极反应式为_____________ 。

部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(2)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式

(3)用硫酸酸化的H2C2O4溶液和(VO2)2SO4溶液反应,以测定反应②后溶液中含钒量,完成反应的离子方程式为:
 VO2+ + H2O + V3+,电池放电时正极的电极反应式为
VO2+ + H2O + V3+,电池放电时正极的电极反应式为
更新时间:2016-12-09 16:45:06
|
【知识点】 原电池
相似题推荐
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐1】某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。已知:
(1)探究BaCO3和BaSO4之间的转化,实验操作如下:
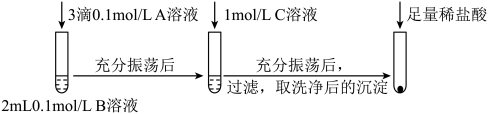
①实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后,____ 。
②实验Ⅱ中加入稀盐酸后发生反应的离子方程式是______ 。
③实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:______
(2)探究AgCl和AgI之间的转化
实验Ⅲ:

实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
①实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是____ (填序号)。
a AgNO3溶液 b NaCl溶液 c KI溶液
②实验Ⅳ的步骤ⅰ中,B中石墨上的电极反应式是_______ 。
③结合信息,解释实验Ⅳ中b<a的原因:_______ 。
④实验Ⅳ的现象能说明AgI转化为AgCl,理由是____ 。
| 物质 | BaSO4 | BaCO3 | AgI | AgCl |
| 溶解度/g (20 ℃) | 2.4×10-4 | 1.4×10-3 | 3.0×10-7 | 1.5×10-4 |

| 试剂A | 试剂B | 试剂C | 加入盐酸后的现象 | |
| 实验Ⅰ | BaCl2 | Na2CO3 | Na2SO4 | …… |
| 实验Ⅱ | Na2SO4 | Na2CO3 | 有少量气泡产生,沉淀部分溶解 |
②实验Ⅱ中加入稀盐酸后发生反应的离子方程式是
③实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:
(2)探究AgCl和AgI之间的转化
实验Ⅲ:

实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
| 装置 | 步骤 | 电压表 读数 |
 | ⅰ.如图连接装置并加入试剂,闭合K | a |
| ⅱ.向B中滴入AgNO3(aq),至沉淀完全 | b | |
| ⅲ.再向B中投入一定量NaCl(s) | c | |
| ⅳ.重复i,再向B中加入与ⅲ等量NaCl(s) | a |
①实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是
a AgNO3溶液 b NaCl溶液 c KI溶液
②实验Ⅳ的步骤ⅰ中,B中石墨上的电极反应式是
③结合信息,解释实验Ⅳ中b<a的原因:
④实验Ⅳ的现象能说明AgI转化为AgCl,理由是
您最近一年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐2】某小组研究化学反应中的能量变化,进行了如下实验。
(1)实验 I:将Zn片和Cu片分别插入盛有50mL 2 mol/L稀硫酸的烧杯中。
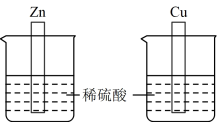
观察到Zn片表面产生气泡,溶液温度由T1℃升到T2℃;Cu片表面无明显变化。
①Zn片与稀硫酸反应的离子方程式为_________ 。
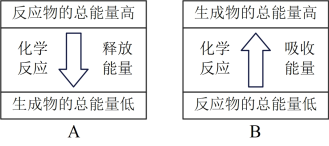
②Zn片与稀硫酸反应的能量变化关系符合如图_________ (填“A”或“B”)。
(2)实验Ⅱ:用导线将电流表、小灯泡与Zn片、Cu片相连接,插入盛有50mL 2 mol∙L−1稀硫酸的烧杯中(如图所示)。

①观察到电流表指针发生偏转,Cu片表面产生气泡,溶液温度由T1℃升到T3℃。
②结合电子的移动方向,解释Cu片表面产生气泡的原因_________ 。
(3)实验I和Ⅱ产生等量气体时,测得T2>T3。结合能量的转化形式,分析两溶液温度变化幅度不同 的原因 _________ 。
(4)根据实验Ⅱ,判断下列说法不正确 的是_________ 。
①在锌电极上也可观察到气泡产生
②电子可由锌电极经溶液流向铜电极
③溶液中的SO 向铜电极移动
向铜电极移动
(5)将Zn片和Cu片换成Fe片和石墨棒,重复实验Ⅱ,判断电流表指针是否发生偏转。若不偏转,说明理由;若偏转,写出Fe片表面发生的电极反应式。理由或电极反应式是_________ 。
(1)实验 I:将Zn片和Cu片分别插入盛有50mL 2 mol/L稀硫酸的烧杯中。

观察到Zn片表面产生气泡,溶液温度由T1℃升到T2℃;Cu片表面无明显变化。
①Zn片与稀硫酸反应的离子方程式为
②Zn片与稀硫酸反应的能量变化关系符合如图

(2)实验Ⅱ:用导线将电流表、小灯泡与Zn片、Cu片相连接,插入盛有50mL 2 mol∙L−1稀硫酸的烧杯中(如图所示)。

①观察到电流表指针发生偏转,Cu片表面产生气泡,溶液温度由T1℃升到T3℃。
②结合电子的移动方向,解释Cu片表面产生气泡的原因
(3)实验I和Ⅱ产生等量气体时,测得T2>T3。结合能量的转化形式,分析两溶液温度变化幅度
(4)根据实验Ⅱ,判断下列说法
①在锌电极上也可观察到气泡产生
②电子可由锌电极经溶液流向铜电极
③溶液中的SO
 向铜电极移动
向铜电极移动(5)将Zn片和Cu片换成Fe片和石墨棒,重复实验Ⅱ,判断电流表指针是否发生偏转。若不偏转,说明理由;若偏转,写出Fe片表面发生的电极反应式。理由或电极反应式是
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
解题方法
【推荐3】某化学兴趣小组的同学设计了如图所示的装置,完成下列问题:

(1)反应过程中,___________ 棒质量减少。
(2)正极的电极反应为___________ 。
(3)反应过程中,当一电极质量增加2g,另一电极减轻的质量___________ (填“大于”“小于”或“等于”)2g。
(4)盐桥的作用是向甲、乙两烧杯中提供 和Cl-,使两烧杯溶液中保持电中性。
和Cl-,使两烧杯溶液中保持电中性。
①反应过程中Cl-将进入___________ (填“甲”或“乙”)烧杯。
②当外电路中转移0.2mol电子时,正极溶液中离子浓度最大的离子是___________ 。

(1)反应过程中,
(2)正极的电极反应为
(3)反应过程中,当一电极质量增加2g,另一电极减轻的质量
(4)盐桥的作用是向甲、乙两烧杯中提供
 和Cl-,使两烧杯溶液中保持电中性。
和Cl-,使两烧杯溶液中保持电中性。①反应过程中Cl-将进入
②当外电路中转移0.2mol电子时,正极溶液中离子浓度最大的离子是
您最近一年使用:0次



