(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵的结晶水合物)是重要的化工原料和化学试剂,在空气中长期放置会被氧化而变质。某课题小组为了探究莫尔盐的分解产物,开展了如下实验:

已知:五氧化二磷是酸性干燥剂,假设干燥管中试剂均足量。
(1)甲同学设计如下实验检验(NH4)2Fe(SO4)2·6H2O分解的部分产物。装置A的气密性的检查方法是__________ 。
①B装置的作用是______________ 。
②M干燥管中所放的药品是________________ 。
(2)检验(NH4)2Fe(SO4)2·6H2O是否变质的试剂是_______ (填化学式);检验是否完全变质的实验方法是___________________ 。
(3)实验室常用(NH4)2Fe(SO4)2·6H2O标准溶液测定过二硫酸铵[(NH4)2S2O8]的纯度(过二硫酸铵的相对分子量为238,滴定反应的离子方程式为:S2O +2Fe2+ =2Fe3++2SO
+2Fe2+ =2Fe3++2SO )。取w g过二硫酸铵样品溶于蒸馏水配制成250 mL 溶液。准确量取20.00 mL配制的溶液于锥形瓶中,用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,重复进行三次平行实验,测得有关数据如表所示:
)。取w g过二硫酸铵样品溶于蒸馏水配制成250 mL 溶液。准确量取20.00 mL配制的溶液于锥形瓶中,用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,重复进行三次平行实验,测得有关数据如表所示:
①完成上述实验需要准确量取20.00 mL过二硫酸铵溶液,所用仪器的名称是______________ 。
②根据上述数据计算,样品的纯度为______________ (用含w、c的代数式表示)。

已知:五氧化二磷是酸性干燥剂,假设干燥管中试剂均足量。
(1)甲同学设计如下实验检验(NH4)2Fe(SO4)2·6H2O分解的部分产物。装置A的气密性的检查方法是
①B装置的作用是
②M干燥管中所放的药品是
(2)检验(NH4)2Fe(SO4)2·6H2O是否变质的试剂是
(3)实验室常用(NH4)2Fe(SO4)2·6H2O标准溶液测定过二硫酸铵[(NH4)2S2O8]的纯度(过二硫酸铵的相对分子量为238,滴定反应的离子方程式为:S2O
 +2Fe2+ =2Fe3++2SO
+2Fe2+ =2Fe3++2SO )。取w g过二硫酸铵样品溶于蒸馏水配制成250 mL 溶液。准确量取20.00 mL配制的溶液于锥形瓶中,用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,重复进行三次平行实验,测得有关数据如表所示:
)。取w g过二硫酸铵样品溶于蒸馏水配制成250 mL 溶液。准确量取20.00 mL配制的溶液于锥形瓶中,用c mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点,重复进行三次平行实验,测得有关数据如表所示:| 实验序号 | 起始读数/mL | 终点读数/mL |
| Ⅰ | 2.50 | 22.58 |
| Ⅱ | 1.00 | 23.12 |
| Ⅲ | 0.00 | 19.92 |
②根据上述数据计算,样品的纯度为
更新时间:2016-12-09 17:12:29
|
【知识点】 探究性实验
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】目前人们已经发现了120多种含铁硫簇(如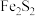 、
、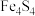 、
、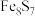 等)的酶和蛋白质。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验(加持装置略):
等)的酶和蛋白质。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验(加持装置略):

回答下列问题:
实验一:测定硫的质量
①连接实验装置并检查装置的气密性。
②在A中放入0.4g铁硫簇的样品(含有不溶于水和盐酸的杂质),在B中加入品红溶液,在C中加入30mL0.1 的酸性
的酸性 溶液。
溶液。
③通入空气并加热,发现固体逐渐转变为红棕色。
④待固体完全转化后,取C中的 溶液3mL,用0.1
溶液3mL,用0.1 的碘化钾溶液进行滴定,消耗碘化钾溶液体积5mL
的碘化钾溶液进行滴定,消耗碘化钾溶液体积5mL
(1)连接装置的接口顺序为b接f,e接___________ ;
(2)装置B中品红溶液的作用是___________ 。有同学提出,撤去B装置,对此实验没有影响,你的看法是___________ (选填“合理”或“不合理”),理由是___________ 。
(3)用KI溶液滴定 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为___________ 。
实验二:测定铁的质量
取实验I中A的硬质玻璃管中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经灼烧得0.32g固体。
(4)综合实验一、实验二,计算这种铁硫簇结构的化学式___________ 。
(5)写出A装置发生化学反应方程式___________ 。
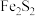 、
、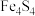 、
、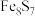 等)的酶和蛋白质。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验(加持装置略):
等)的酶和蛋白质。某化学兴趣小组在研究某铁硫簇结构的组成时,设计了下列实验(加持装置略):
回答下列问题:
实验一:测定硫的质量
①连接实验装置并检查装置的气密性。
②在A中放入0.4g铁硫簇的样品(含有不溶于水和盐酸的杂质),在B中加入品红溶液,在C中加入30mL0.1
 的酸性
的酸性 溶液。
溶液。③通入空气并加热,发现固体逐渐转变为红棕色。
④待固体完全转化后,取C中的
 溶液3mL,用0.1
溶液3mL,用0.1 的碘化钾溶液进行滴定,消耗碘化钾溶液体积5mL
的碘化钾溶液进行滴定,消耗碘化钾溶液体积5mL(1)连接装置的接口顺序为b接f,e接
(2)装置B中品红溶液的作用是
(3)用KI溶液滴定
 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为实验二:测定铁的质量
取实验I中A的硬质玻璃管中的残留固体加入稀盐酸中,充分搅拌后过滤,在滤液中加入足量的NaOH溶液,过滤后取滤渣,经灼烧得0.32g固体。
(4)综合实验一、实验二,计算这种铁硫簇结构的化学式
(5)写出A装置发生化学反应方程式
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】 是一种高性能磁性材料。实验室以
是一种高性能磁性材料。实验室以 为原料制备
为原料制备 的流程如下:
的流程如下:
第一步:将向 浊液中通入
浊液中通入 ,发生反应
,发生反应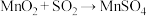 ;
;
第二步:向 溶液中加入
溶液中加入 ,有
,有 气体逸出,同时获得
气体逸出,同时获得 粗产品。
粗产品。
已知部分含锰化合物的溶解性如下:
完成下列填空:
(1)①第一步的反应装置如下图所示:
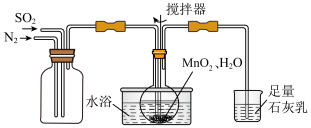
②石灰乳的作用是___________ 。
③反应过程中,为使 尽可能转化完全,在通入
尽可能转化完全,在通入 与
与 比例一定,不改变
比例一定,不改变 与
与 用量的条件下,可以采取的合理措施有
用量的条件下,可以采取的合理措施有___________ (任写一种)。
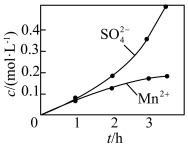
(2)若实验中将 换成空气,测得反应液中
换成空气,测得反应液中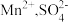 的浓度随反应时间t变化如图。导致溶液中
的浓度随反应时间t变化如图。导致溶液中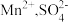 浓度变化产生明显差异的原因可能是:
浓度变化产生明显差异的原因可能是:___________ 。
实验室可以用无色的酸性 溶液来检验,原理如下所示:
溶液来检验,原理如下所示: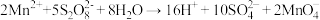
已知 的结构如图所示:
的结构如图所示: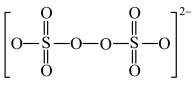
(4)标明上述反应的电子转移方向与数目___________ 。确认溶液中是否含 的操作与现象是:
的操作与现象是:___________ 。
(5)利用重量法探究 的热分解,数据如下表所示(残留固体均为锰的氧化物):
的热分解,数据如下表所示(残留固体均为锰的氧化物):
①第二组实验中残留固体的化学式为___________ 。
②结合两组实验数据,推测 在空气中加热至
在空气中加热至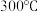 时发生反应的化学方程式:
时发生反应的化学方程式:________ 。
 是一种高性能磁性材料。实验室以
是一种高性能磁性材料。实验室以 为原料制备
为原料制备 的流程如下:
的流程如下:第一步:将向
 浊液中通入
浊液中通入 ,发生反应
,发生反应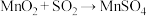 ;
;第二步:向
 溶液中加入
溶液中加入 ,有
,有 气体逸出,同时获得
气体逸出,同时获得 粗产品。
粗产品。已知部分含锰化合物的溶解性如下:
| 含锰化合物 |  |  |  |  |
| 溶解性 | 不溶 | 不溶 | 可溶 | 不溶 |
(1)①第一步的反应装置如下图所示:

②石灰乳的作用是
③反应过程中,为使
 尽可能转化完全,在通入
尽可能转化完全,在通入 与
与 比例一定,不改变
比例一定,不改变 与
与 用量的条件下,可以采取的合理措施有
用量的条件下,可以采取的合理措施有(2)若实验中将
 换成空气,测得反应液中
换成空气,测得反应液中 的浓度随反应时间t变化如图。导致溶液中
的浓度随反应时间t变化如图。导致溶液中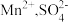 浓度变化产生明显差异的原因可能是:
浓度变化产生明显差异的原因可能是:
实验室可以用无色的酸性
 溶液来检验,原理如下所示:
溶液来检验,原理如下所示: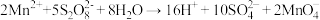
已知
 的结构如图所示:
的结构如图所示:
(4)标明上述反应的电子转移方向与数目
 的操作与现象是:
的操作与现象是:(5)利用重量法探究
 的热分解,数据如下表所示(残留固体均为锰的氧化物):
的热分解,数据如下表所示(残留固体均为锰的氧化物):| 实验 | 固体质量g | |
| 加热前 | 加热至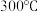 后 后 | |
| 第一组(空气氛围) | 3.450 | 2.610 |
| 第二组(氢气氛围) | 3.450 | 2.130 |
②结合两组实验数据,推测
 在空气中加热至
在空气中加热至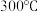 时发生反应的化学方程式:
时发生反应的化学方程式:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】某研究小组模拟工业湿法制备新型绿色消毒剂高铁酸钾,按如下流程开展实验。
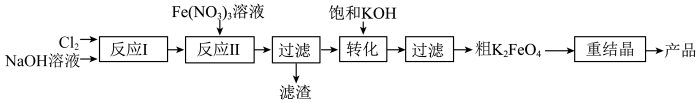
用如图装置可以完成上述反应Ⅰ和反应Ⅱ。

信息:① 易溶于水,微溶于
易溶于水,微溶于 溶液,难溶于乙醇;具有强氧化性,在酸性或中性溶液口快速产生
溶液,难溶于乙醇;具有强氧化性,在酸性或中性溶液口快速产生 ;在
;在 碱性溶液中较稳定。②
碱性溶液中较稳定。② 易挥发,且在溶液中有反应
易挥发,且在溶液中有反应 。
。
③部分物质在水中的溶解度见下表:
(1)仪器 的名称是
的名称是_________ ,反应Ⅰ中为了减少因反应过热而产生 ,可以采取的操作是
,可以采取的操作是______ 。
(2)下列说法正确的是________。
(3)写出反应Ⅱ中主要反应的离子方程式:_______ 。
(4)测定产品的纯度( 的相对分子质量为
的相对分子质量为 )
)
称取 左右碘化钾于碘量瓶中,加入
左右碘化钾于碘量瓶中,加入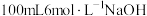 溶液和
溶液和 左右的固体氟化钠,待溶解完毕;准确称取
左右的固体氟化钠,待溶解完毕;准确称取 样品于碘量瓶中,待样品充分溶解后,加硫酸酸化至反应完全;淀粉作指示剂,用
样品于碘量瓶中,待样品充分溶解后,加硫酸酸化至反应完全;淀粉作指示剂,用 标准溶液进行滴定,消耗标准液体积为
标准溶液进行滴定,消耗标准液体积为 。
。
已知: ,
, (方程式未配平)
(方程式未配平)
①本次实验测得 纯度为
纯度为_______ ,然后重复上述过程,平行测试3次。
②实验过程中往往需要加入过量且比理论计算所需量过量2~3倍左右的 ,理由是
,理由是_______ 。

用如图装置可以完成上述反应Ⅰ和反应Ⅱ。

信息:①
 易溶于水,微溶于
易溶于水,微溶于 溶液,难溶于乙醇;具有强氧化性,在酸性或中性溶液口快速产生
溶液,难溶于乙醇;具有强氧化性,在酸性或中性溶液口快速产生 ;在
;在 碱性溶液中较稳定。②
碱性溶液中较稳定。② 易挥发,且在溶液中有反应
易挥发,且在溶液中有反应 。
。③部分物质在水中的溶解度见下表:
| 物质 | 溶解度/g | |||
 |  |  |  | |
 | 35.8 | 36.0 | 36.3 | 38.4 |
 | 80.0 | 88.0 | 96.0 | 148.0 |
(1)仪器
 的名称是
的名称是 ,可以采取的操作是
,可以采取的操作是(2)下列说法正确的是________。
| A.反应Ⅱ中为了加快反应速率,可进行搅拌与加热 |
| B.反应Ⅱ结束后应通一段时间氮气,然后再拆下装置进行后续实验 |
C.加入饱和 溶液发生的是复分解反应 溶液发生的是复分解反应 |
D.若用 溶液代替 溶液代替 溶液作铁源, 溶液作铁源, 的产率和纯度都会降低 的产率和纯度都会降低 |
(3)写出反应Ⅱ中主要反应的离子方程式:
(4)测定产品的纯度(
 的相对分子质量为
的相对分子质量为 )
)称取
 左右碘化钾于碘量瓶中,加入
左右碘化钾于碘量瓶中,加入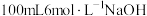 溶液和
溶液和 左右的固体氟化钠,待溶解完毕;准确称取
左右的固体氟化钠,待溶解完毕;准确称取 样品于碘量瓶中,待样品充分溶解后,加硫酸酸化至反应完全;淀粉作指示剂,用
样品于碘量瓶中,待样品充分溶解后,加硫酸酸化至反应完全;淀粉作指示剂,用 标准溶液进行滴定,消耗标准液体积为
标准溶液进行滴定,消耗标准液体积为 。
。已知:
 ,
, (方程式未配平)
(方程式未配平)①本次实验测得
 纯度为
纯度为②实验过程中往往需要加入过量且比理论计算所需量过量2~3倍左右的
 ,理由是
,理由是
您最近一年使用:0次



