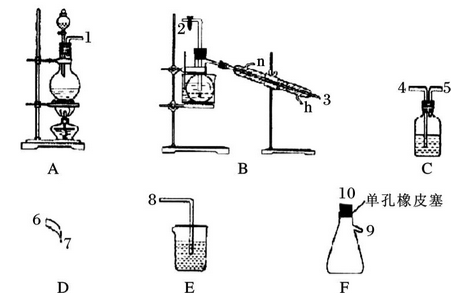
氯气用于自来水的杀菌消毒,但在消毒时会产生一些负面影响,因此人们开始研究一些新型自来水消毒剂。某学习小组查阅资料发现NCl3可作为杀菌消毒剂,该小组利用下图所示的装置制备NCl3,并探究NCl3的漂白性。
NCl3的相关性质如下:
回答下列问题:
(1) 根据实验目的,接口连接的顺序为
1→_______ →_______ →2→3 →6→7→__________ →___________ →____________ 。
(2)C装置作用是_______________ 。
(3)B装置中发生反应的化学方程式为_______________ ,当B装置蒸馏烧瓶中出现较多油状液体后,关闭接口2处的活塞,控制水浴加热的温度为______________ 。
(4)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,写出有关化学反应方程式并解释实验现象:______________________ 。

NCl3的相关性质如下:
| 物理性质 | 制备原理 | 化学性质 |
| 黄色油状液体,熔点为-40℃,沸点为71℃,不溶于冷水,易溶于有机溶剂,密度为1.65 g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中能与水反应 |
(1) 根据实验目的,接口连接的顺序为
1→
(2)C装置作用是
(3)B装置中发生反应的化学方程式为
(4)当F装置的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50-60℃热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,试纸先变蓝后褪色,写出有关化学反应方程式并解释实验现象:
更新时间:2016-12-09 17:20:46
|
【知识点】 化学实验基础
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】常温下,在474.8g水中溶解25.2g草酸晶体(H2C2O4·2H2O,相对分子质量为126),得到一份草酸浓溶液,该溶液密度为2.0g/cm3。
(1)以上过程得到的草酸浓溶液的物质的量浓度为___ mol/L。
(2)现需用上述浓溶液配制0.1mol/L的草酸溶液450mL。
①实验中用到的玻璃仪器有胶头滴管、烧杯、量筒、___ 。
②应量取浓溶液的体积为___ mL。
③下列情况中,会导致配制的0.1mol/L的草酸溶液浓度偏高的有___ (填字母)。
A.配制浓溶液所使用的草酸晶体失去部分结晶水
B.使用“左码右物”的方法称量草酸晶体
C.容量瓶未经干燥就使用
D.量取浓溶液时仰视刻度线
(3)H2C2O4·2H2O受热易分解,分解产物均为氧化物,其中一种产物能使澄清石灰水变浑浊,请写出H2C2O4·2H2O受热分解的化学方程式___ 。
(4)用移液管量取10.00mL酸性K2Cr2O7溶液,恰好与20.00mL0.1mol/L的草酸溶液反应,还原产物为Cr3+,氧化产物为CO2。在此实验中,草酸体现___ 性;此酸性K2Cr2O7溶液的物质的量浓度为___ mol/L(保留小数点后2位)。
(1)以上过程得到的草酸浓溶液的物质的量浓度为
(2)现需用上述浓溶液配制0.1mol/L的草酸溶液450mL。
①实验中用到的玻璃仪器有胶头滴管、烧杯、量筒、
②应量取浓溶液的体积为
③下列情况中,会导致配制的0.1mol/L的草酸溶液浓度偏高的有
A.配制浓溶液所使用的草酸晶体失去部分结晶水
B.使用“左码右物”的方法称量草酸晶体
C.容量瓶未经干燥就使用
D.量取浓溶液时仰视刻度线
(3)H2C2O4·2H2O受热易分解,分解产物均为氧化物,其中一种产物能使澄清石灰水变浑浊,请写出H2C2O4·2H2O受热分解的化学方程式
(4)用移液管量取10.00mL酸性K2Cr2O7溶液,恰好与20.00mL0.1mol/L的草酸溶液反应,还原产物为Cr3+,氧化产物为CO2。在此实验中,草酸体现
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】以燃煤烟气(含SO2、O2等)和软锰矿粉(主要成分为MnO2,含少量Fe、Al的氧化物杂质)为原料可制备高纯度锰的氧化物。
(1)向一定量软锰矿浊液中匀速通入燃煤烟气,反应装置如图1所示,溶液中H2SO4和MnSO4的浓度随吸收时间的变化如图2所示。


①MnO2和SO2反应的化学方程式为___________ ;采用水浴降温的目的是___________ 。
②在吸收反应的过程中,H2SO4的生成速率逐渐加快,其主要原因是___________ 。
(2)向吸收液中滴加NaOH溶液,调节pH除杂,已知溶液中c(Mn2+)=0.2mol/L,若要使溶液中c(Fe2+)、c(Al3+)降低到10-6mol/L,需要控制pH范围为___________ 。{已知:室温下Ksp[Al(OH)3]=10-33、Ksp[Fe(OH)3]=3×10-39、Ksp[Mn(OH)2]=2×10-13}
(3)向除杂后的溶液中加入NH4HCO3溶液,反应生成MnCO3沉淀,___________ 得到碳酸锰。
(4)将MnCO3边通O2边加热,在750K~850K时,得到稳定的氧化物产品甲,此时残留固体的质量为原样品质量的75.7%,在900K~1000K时,得到稳定的氧化物产品乙,此时残留固体的质量为原样品质量的68.7%,甲的化学式为___________ ,乙的化学式为___________ 。
(1)向一定量软锰矿浊液中匀速通入燃煤烟气,反应装置如图1所示,溶液中H2SO4和MnSO4的浓度随吸收时间的变化如图2所示。


①MnO2和SO2反应的化学方程式为
②在吸收反应的过程中,H2SO4的生成速率逐渐加快,其主要原因是
(2)向吸收液中滴加NaOH溶液,调节pH除杂,已知溶液中c(Mn2+)=0.2mol/L,若要使溶液中c(Fe2+)、c(Al3+)降低到10-6mol/L,需要控制pH范围为
(3)向除杂后的溶液中加入NH4HCO3溶液,反应生成MnCO3沉淀,
(4)将MnCO3边通O2边加热,在750K~850K时,得到稳定的氧化物产品甲,此时残留固体的质量为原样品质量的75.7%,在900K~1000K时,得到稳定的氧化物产品乙,此时残留固体的质量为原样品质量的68.7%,甲的化学式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】某中学趣味化学实验小组的同学想通过“ 被浓
被浓 氧化”的实验,验证
氧化”的实验,验证 的还原性.
的还原性.
实验一:验证 的还原性
的还原性
(1)红棕色气体是____________ 。(写化学式)
(2)实验现象与预期不符,继续进行实验。
取深棕色溶液于试管中,滴加KSCN溶液,溶液变为红色,该现象说明___________________ 。
实验二:探究溶液变为深棕色的原因
【资料与猜想】
查阅资料后猜想,可能是生成的 或NO与溶液中的
或NO与溶液中的 或
或 反应,而使溶液变为深棕色。
反应,而使溶液变为深棕色。
【实验与探究】
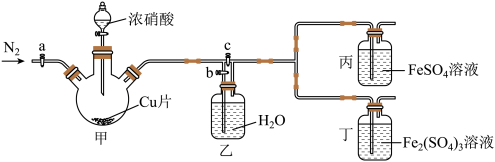
用如图所示装置进行实验(气密性已检验,尾气处理已略去)
ⅱ.向甲中加入适量浓 ,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
ⅲ.关闭b、打开c,更换丙、丁中的溶液(试剂不变);
ⅳ.继续向甲中加入浓 ,一段时间后观察到了与ⅱ相同的实验现象。
,一段时间后观察到了与ⅱ相同的实验现象。
(3)通入 的目的是
的目的是________________________ 。
(4)铜与浓硝酸反应的离子方程式是__________________________ 。
(5)装置乙的作用是_____________________ 。
(6)实验结论:溶液的深棕色可能是因为 。
【反思与改进】
实验三:验证 的还原性
的还原性
(7)该小组同学依据实验二的结论改进了实验一,观察到了预期现象,其实验操作是向盛有____________ 的试管中滴入几滴____________ ,振荡。
 被浓
被浓 氧化”的实验,验证
氧化”的实验,验证 的还原性.
的还原性.实验一:验证
 的还原性
的还原性实验操作 | 预期现象 | 实验现象 |
向盛有2mL  溶液的试管中,滴入几滴浓硝酸,振荡。 溶液的试管中,滴入几滴浓硝酸,振荡。 | 试管中产生红棕色气体,溶液变为黄色。 | 试管中产生红棕色气体,溶液变为深棕色。 |
(1)红棕色气体是
(2)实验现象与预期不符,继续进行实验。
取深棕色溶液于试管中,滴加KSCN溶液,溶液变为红色,该现象说明
实验二:探究溶液变为深棕色的原因
【资料与猜想】
查阅资料后猜想,可能是生成的
 或NO与溶液中的
或NO与溶液中的 或
或 反应,而使溶液变为深棕色。
反应,而使溶液变为深棕色。【实验与探究】
用如图所示装置进行实验(气密性已检验,尾气处理已略去)
ⅱ.向甲中加入适量浓
 ,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;ⅲ.关闭b、打开c,更换丙、丁中的溶液(试剂不变);
ⅳ.继续向甲中加入浓
 ,一段时间后观察到了与ⅱ相同的实验现象。
,一段时间后观察到了与ⅱ相同的实验现象。(3)通入
 的目的是
的目的是(4)铜与浓硝酸反应的离子方程式是
(5)装置乙的作用是
(6)实验结论:溶液的深棕色可能是因为 。
A. 与NO发生了反应 与NO发生了反应 | B. 与 与 发生了反应 发生了反应 |
C. 与NO发生了反应 与NO发生了反应 | D. 与 与 发生了反应 发生了反应 |
【反思与改进】
实验三:验证
 的还原性
的还原性(7)该小组同学依据实验二的结论改进了实验一,观察到了预期现象,其实验操作是向盛有
您最近一年使用:0次



