煤化工中常需研究不同温度下平衡常数、投料比等问题。
已知:CO(g)+H2O(g) H2(g)+CO2(g)平衡常数K随温度的变化如下表:
H2(g)+CO2(g)平衡常数K随温度的变化如下表:
回答下列问题
(1)该反应的平衡常数表达式K= ,△H 0(填“<”、“>”、“=”)
(2)已知在一定温度下,C(s)+CO2(g) 2CO(g)平衡常数K1
2CO(g)平衡常数K1
C(s)+H2O(g) H2(g)+CO(g)平衡常数K2,
H2(g)+CO(g)平衡常数K2,
则K、K1、K2,之间的关系是 。
(3)800℃时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时 间后反应达到平衡,此时CO的转化率为 ;若保持其他条件不变,向平衡体系中再通入0.10molCO和0.40mol CO2,此时v正 v逆(填“>”、“=”或“<”).
已知:CO(g)+H2O(g)
 H2(g)+CO2(g)平衡常数K随温度的变化如下表:
H2(g)+CO2(g)平衡常数K随温度的变化如下表:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
回答下列问题
(1)该反应的平衡常数表达式K= ,△H 0(填“<”、“>”、“=”)
(2)已知在一定温度下,C(s)+CO2(g)
 2CO(g)平衡常数K1
2CO(g)平衡常数K1C(s)+H2O(g)
 H2(g)+CO(g)平衡常数K2,
H2(g)+CO(g)平衡常数K2,则K、K1、K2,之间的关系是 。
(3)800℃时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时 间后反应达到平衡,此时CO的转化率为 ;若保持其他条件不变,向平衡体系中再通入0.10molCO和0.40mol CO2,此时v正 v逆(填“>”、“=”或“<”).
12-13高二下·江西抚州·期末 查看更多[4]
河北省邯郸市2016-2017学年高二上学期期中考试化学试题2016-2017学年河北省邯郸市成安一中、永年二中高二上期中化学卷2015-2016学年浙江余姚中学高一普通班下期中化学试卷(已下线)2012-2013学年江西省抚州市高二下学期期末考试化学试卷
更新时间:2016-12-09 09:30:56
|
【知识点】 化学平衡
相似题推荐
填空题
|
较难
(0.4)
【推荐1】农业对化肥的需求是合成氨工业发展的持久推动力。
(1)氮原子最外电子层上有________ 种能量不同的电子,其原子核外存在________ 对自旋相反的电子。
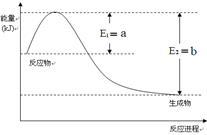
(2)一定温度、压强下,氮气和氢气反应生成1mol氨气的过程中能量变化示意图如右,请写出该反应的热化学反应方程式:_____________ 。(Q的数值用含字母a、b的代数式表示)
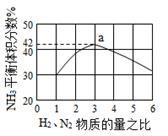
下图表示500℃、60.0MPa条件下,原料气H2和N2的投料比与平衡时NH3体积分数的关系。
(3)工业上合成氨的温度一般控制在500℃,原因是____________________ 。
根据图中a点数据计算N2的平衡体积分数为__________ 。
(4)硫化铵晶体与晶体硅相比较,____________ 的熔点较高,原因是___________ 。
(5)写出等物质的量浓度等体积的硫酸氢钠与硫化铵溶液反应的离子方程________________ 。
(1)氮原子最外电子层上有
(2)一定温度、压强下,氮气和氢气反应生成1mol氨气的过程中能量变化示意图如右,请写出该反应的热化学反应方程式:
下图表示500℃、60.0MPa条件下,原料气H2和N2的投料比与平衡时NH3体积分数的关系。


(3)工业上合成氨的温度一般控制在500℃,原因是
根据图中a点数据计算N2的平衡体积分数为
(4)硫化铵晶体与晶体硅相比较,
(5)写出等物质的量浓度等体积的硫酸氢钠与硫化铵溶液反应的离子方程
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】煤的气化和液化可能实现煤的综合利用,提高煤的利用价值。煤的间接液化是指以煤为原料,先气化(主要以水作气化剂)制成合成气,然后再通过一系列作用将合成气转化成烃类燃料、醇类燃料和化学品的过程。
(1)CH3OH、H2的燃烧热分别为:△H=-725.5kJ•mol-1,△H=-285.8kJ•mol-1,写出工业上以CO2、H2合成CH3OH的热化学方程式:___________________ 。
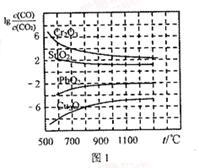
(2)金属氧化物可被CO还原生成金属单质和二氧化碳。下图是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时 与温度(t)的关系曲线图1,700℃时,其中最难被还原的金属氧化物是
与温度(t)的关系曲线图1,700℃时,其中最难被还原的金属氧化物是_____ (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式为最简单整数比,该反应的平衡常数(K)数值等于___________ 。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其化学反应的热化学方程式为:CH3OH(g)+CO(g)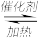 HCOOCH3(g)△H=-29.1kJ•mol-1.科研人员对该反应进行了研究.部分研究结果如图所示:
HCOOCH3(g)△H=-29.1kJ•mol-1.科研人员对该反应进行了研究.部分研究结果如图所示:
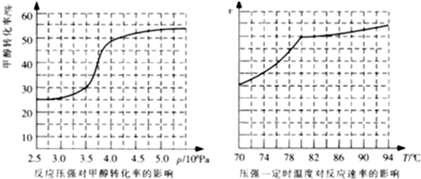
①从反应压强对甲醇转化率的影响“效率“看,工业制取甲酸甲酯应选择的压强是__________ ;
②实际工业生产中采用的温度是80℃,其理由是______________________ 。
(1)CH3OH、H2的燃烧热分别为:△H=-725.5kJ•mol-1,△H=-285.8kJ•mol-1,写出工业上以CO2、H2合成CH3OH的热化学方程式:
(2)金属氧化物可被CO还原生成金属单质和二氧化碳。下图是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时
 与温度(t)的关系曲线图1,700℃时,其中最难被还原的金属氧化物是
与温度(t)的关系曲线图1,700℃时,其中最难被还原的金属氧化物是(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其化学反应的热化学方程式为:CH3OH(g)+CO(g)
 HCOOCH3(g)△H=-29.1kJ•mol-1.科研人员对该反应进行了研究.部分研究结果如图所示:
HCOOCH3(g)△H=-29.1kJ•mol-1.科研人员对该反应进行了研究.部分研究结果如图所示:

①从反应压强对甲醇转化率的影响“效率“看,工业制取甲酸甲酯应选择的压强是
②实际工业生产中采用的温度是80℃,其理由是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】在373k时,把11.5gN2O4气体通入体积为500mL的真空密闭容器中,立即出现红棕色的NO2气体,反应原理为N2O4 2NO2。当反应进行到2s时,NO2含量为0.01mol,反应进到60s时达到平衡,此时容器内混合气体密度是氢气密度的28.75倍。试通过计算填空:
2NO2。当反应进行到2s时,NO2含量为0.01mol,反应进到60s时达到平衡,此时容器内混合气体密度是氢气密度的28.75倍。试通过计算填空:
(1)开始2s内,以N2O4表示的反应速率为___ mol·L-1·s-1。
(2)达到平衡时,体系的压强是开始时的____ 倍。
(3)平衡时还有_______ mol N2O4。
(4)平衡后若压缩容器体积,则再达到平衡后NO2的浓度将_______ (填“增大”、“减少”或“不变”)。
 2NO2。当反应进行到2s时,NO2含量为0.01mol,反应进到60s时达到平衡,此时容器内混合气体密度是氢气密度的28.75倍。试通过计算填空:
2NO2。当反应进行到2s时,NO2含量为0.01mol,反应进到60s时达到平衡,此时容器内混合气体密度是氢气密度的28.75倍。试通过计算填空:(1)开始2s内,以N2O4表示的反应速率为
(2)达到平衡时,体系的压强是开始时的
(3)平衡时还有
(4)平衡后若压缩容器体积,则再达到平衡后NO2的浓度将
您最近一年使用:0次



