氨在工农业生产中应用广泛。
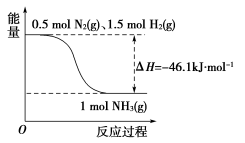
(1)根据图写出合成氨的热化学方程式是_____________________________________ 。
(2)将1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量________ (填“大于”、“等于”或“小于”)92.2 kJ,原因是______________________________ ;若加入催化剂,ΔH________ (填“变大”、“不变”或“变小”)。
(3)已知分别破坏1 mol N N键、1 mol H—H键时需要吸收的能量为946 kJ、436 kJ,则破坏1 mol NH键需要吸收的能量为
N键、1 mol H—H键时需要吸收的能量为946 kJ、436 kJ,则破坏1 mol NH键需要吸收的能量为________ kJ。
(4)N2H4可视为NH3分子中的H被—NH2取代的产物。发射卫星时以N2H4(g)为燃料、NO2为氧化剂,二者反应生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1
则1 mol N2H4与NO2完全反应的热化学方程式为_____________________________ 。
(1)根据图写出合成氨的热化学方程式是

(2)将1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量
(3)已知分别破坏1 mol N
 N键、1 mol H—H键时需要吸收的能量为946 kJ、436 kJ,则破坏1 mol NH键需要吸收的能量为
N键、1 mol H—H键时需要吸收的能量为946 kJ、436 kJ,则破坏1 mol NH键需要吸收的能量为(4)N2H4可视为NH3分子中的H被—NH2取代的产物。发射卫星时以N2H4(g)为燃料、NO2为氧化剂,二者反应生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1
则1 mol N2H4与NO2完全反应的热化学方程式为
16-17高二上·海南·期中 查看更多[5]
(已下线)2019高考备考二轮复习精品资料-专题8 化学反应中与能量变化(押题专练)四川省成都市龙泉驿区第一中学2019届高三上学期入学考试化学试题(已下线)二轮复习 专题8 化学反应中与能量变化 押题专练山东省济南市历城区第二中学2017-2018学年高二10月月考化学试题2016-2017学年海南省海南中学高二上期中理化学试卷
更新时间:2016-12-28 15:58:35
|
【知识点】 化学反应热的计算
相似题推荐
【推荐1】硫和氮是生物必须的营养元素,含硫和氮的化合物在自然界中广泛存在。
(1)火山喷发产生H2S在大气中发生如下反应:
①2H2S(g)+O2(g)=2S(g)+2H2O(l) △H=akJ•mol-1
②S(g)+O2(g)=SO2(g) △H=bkJ•mol-1
写出H2S(g)燃烧的热化学方程式_____ 。
(2)工业上可用NaClO碱性溶液吸收SO2。为了提高吸收效率,常用Ni2O3作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如图所示。Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是______ 。

(3)氮的氧化物脱除可以利用电化学原理处理,利用如图所示装置可同时吸收SO2和NO。
已知:H2S2O4是一种弱酸。

①阴极的电极反应式为_____ 。
②若无能量损失,相同条件下,SO2和NO的体积比为_____ 时,两种气体都能被完全处理。
(4)已知2NO(g)+O2(g) 2NO2(g)的反应历程分两步。
2NO2(g)的反应历程分两步。
第一步:2NO(g)+ N2O2(g)(快反应)
N2O2(g)(快反应)
第二步:N2O2(g)+O2(g) 2NO2(g)(慢反应)
2NO2(g)(慢反应)
用O2表示的速率方程为v(O2)=k1c2(NO)•c(O2);用NO2表示的速率方程为v(NO2)=k2c2(NO)•c(O2),k1与k2分别表示速率常数,则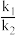 =
=_____ 。(填数值)
(5)太阳能光电催化—化学耦合分解H2S的装置如图所示。

①该太阳能光电催化—化学耦合分解H2S的过程可描述为______ 。
②从能源利用和资源综合利用角度分析该方法优点是______ 。
(1)火山喷发产生H2S在大气中发生如下反应:
①2H2S(g)+O2(g)=2S(g)+2H2O(l) △H=akJ•mol-1
②S(g)+O2(g)=SO2(g) △H=bkJ•mol-1
写出H2S(g)燃烧的热化学方程式
(2)工业上可用NaClO碱性溶液吸收SO2。为了提高吸收效率,常用Ni2O3作为催化剂。反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如图所示。Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是

(3)氮的氧化物脱除可以利用电化学原理处理,利用如图所示装置可同时吸收SO2和NO。
已知:H2S2O4是一种弱酸。

①阴极的电极反应式为
②若无能量损失,相同条件下,SO2和NO的体积比为
(4)已知2NO(g)+O2(g)
 2NO2(g)的反应历程分两步。
2NO2(g)的反应历程分两步。第一步:2NO(g)+
 N2O2(g)(快反应)
N2O2(g)(快反应)第二步:N2O2(g)+O2(g)
 2NO2(g)(慢反应)
2NO2(g)(慢反应)用O2表示的速率方程为v(O2)=k1c2(NO)•c(O2);用NO2表示的速率方程为v(NO2)=k2c2(NO)•c(O2),k1与k2分别表示速率常数,则
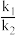 =
=(5)太阳能光电催化—化学耦合分解H2S的装置如图所示。

①该太阳能光电催化—化学耦合分解H2S的过程可描述为
②从能源利用和资源综合利用角度分析该方法优点是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】苯乙烯作为一种重要的基础有机化工原料,广泛用于合成塑料和橡胶。工业常采用乙苯脱氢的方法制备苯乙烯,其原理如下:
反应Ⅰ: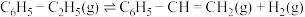

(1)近期有科技工作者结合是实验与计算机模拟结果,研究了乙苯在催化剂表面脱氢制苯乙烯的反应,其历程如下图所示(吸附在催化剂表面的物种用 标注):
标注):
___________  (计算结果保留整数)。
(计算结果保留整数)。
②依据上述反应历程,推测乙苯脱氢反应产生的副产物可能是___________ (填结构简式)
(2)在 下,乙苯直接脱氢反应的
下,乙苯直接脱氢反应的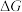 和
和 随温度的变化如图所示。
随温度的变化如图所示。___________ (选填“能”或“不能”)自发。
② 随温度的变化曲线为
随温度的变化曲线为___________ (选填“a”或“b”)。
(3)在某温度、 下,向反应器中充入
下,向反应器中充入 气态乙苯和
气态乙苯和 发生反应Ⅰ,其平衡转化率为
发生反应Ⅰ,其平衡转化率为 ,则乙苯脱氢反应的压强平衡常数
,则乙苯脱氢反应的压强平衡常数
___________ (计算时忽略副反应)。
(4)工业上还可以利用 氧化乙苯制乙烯,其原理为:反应Ⅱ:
氧化乙苯制乙烯,其原理为:反应Ⅱ: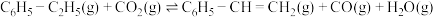
 ,在相同反应条件下,工业上可采用
,在相同反应条件下,工业上可采用 替代水蒸气进行乙苯脱氢反应,已知
替代水蒸气进行乙苯脱氢反应,已知 ;则
;则 代替水蒸气参与反应的优点有
代替水蒸气参与反应的优点有___________ 。
A.降低反应的能耗 B.乙苯转化率更高
C.提高了反应速率 D.提高了产物选择性
(5)苯乙烯被酸性高锰酸钾溶液充分氧化后的产物是___________ 和___________ (填名称)。
反应Ⅰ:
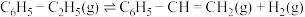

(1)近期有科技工作者结合是实验与计算机模拟结果,研究了乙苯在催化剂表面脱氢制苯乙烯的反应,其历程如下图所示(吸附在催化剂表面的物种用
 标注):
标注):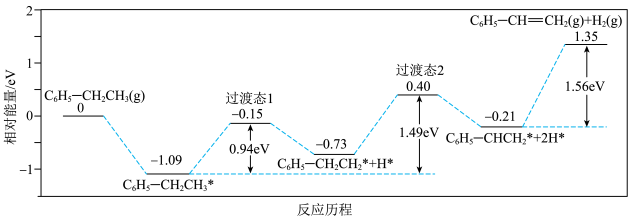

 (计算结果保留整数)。
(计算结果保留整数)。②依据上述反应历程,推测乙苯脱氢反应产生的副产物可能是
(2)在
 下,乙苯直接脱氢反应的
下,乙苯直接脱氢反应的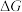 和
和 随温度的变化如图所示。
随温度的变化如图所示。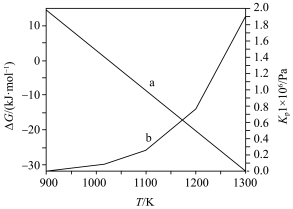
②
 随温度的变化曲线为
随温度的变化曲线为(3)在某温度、
 下,向反应器中充入
下,向反应器中充入 气态乙苯和
气态乙苯和 发生反应Ⅰ,其平衡转化率为
发生反应Ⅰ,其平衡转化率为 ,则乙苯脱氢反应的压强平衡常数
,则乙苯脱氢反应的压强平衡常数
(4)工业上还可以利用
 氧化乙苯制乙烯,其原理为:反应Ⅱ:
氧化乙苯制乙烯,其原理为:反应Ⅱ: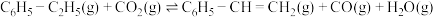
 ,在相同反应条件下,工业上可采用
,在相同反应条件下,工业上可采用 替代水蒸气进行乙苯脱氢反应,已知
替代水蒸气进行乙苯脱氢反应,已知 ;则
;则 代替水蒸气参与反应的优点有
代替水蒸气参与反应的优点有A.降低反应的能耗 B.乙苯转化率更高
C.提高了反应速率 D.提高了产物选择性
(5)苯乙烯被酸性高锰酸钾溶液充分氧化后的产物是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大。试回答下列问题:
(1)已知:高炉炼铁过程中会发生如下反应:
①FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH1
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3
则反应Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)的ΔH的表达式为_______________________________ (用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下表:
1600 ℃时固体物质的主要成分为_____________ (填化学式);若该温度下,测得固体混合物中m(Fe)∶m(O)=35∶4,则FeO被CO还原为Fe的百分率为______________ (设其他固体杂质中不含Fe、O元素)。
(3)铁的某些化合物可用作CO与H2反应的催化剂。已知某种铁的化合物可用来催化反应:CO(g) + 3H2(g) CH4(g) + H2O(g) ΔH <0 。
CH4(g) + H2O(g) ΔH <0 。
在T ℃、a MPa时,将2 mol CO和6 mol H2充入某容积可变的密闭容器中,实验测得CO的物质的量在反应体系中所占百分比x(CO)如下表:
① T ℃ a MPa时,此反应的平衡常数K =____________ (保留1位小数)。达到平衡时CO的转化率为___________ 。

②上图表示该反应CO的平衡转化率与温度、压强的关系。
图中温度T1、T2、T3由低到高的顺序是________________ 。图中显示其它条件固定时,增加压强会导致平衡向___________ (填“左”或“右”)移动。
(1)已知:高炉炼铁过程中会发生如下反应:
①FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH1
②3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2
③Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3
则反应Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)的ΔH的表达式为
(2)上述反应在高炉中大致分为三个阶段,各阶段主要成分与温度的关系如下表:
| 温度/℃ | 250 | 600 | 1000 | 2000 |
| 主要成分 | Fe2O3 | Fe3O4 | FeO | Fe |
1600 ℃时固体物质的主要成分为
(3)铁的某些化合物可用作CO与H2反应的催化剂。已知某种铁的化合物可用来催化反应:CO(g) + 3H2(g)
 CH4(g) + H2O(g) ΔH <0 。
CH4(g) + H2O(g) ΔH <0 。在T ℃、a MPa时,将2 mol CO和6 mol H2充入某容积可变的密闭容器中,实验测得CO的物质的量在反应体系中所占百分比x(CO)如下表:
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| x(CO) | 0.25 | 0.23 | 0.21 | 0.20 | 0.10 | 0.10 |
① T ℃ a MPa时,此反应的平衡常数K =

②上图表示该反应CO的平衡转化率与温度、压强的关系。
图中温度T1、T2、T3由低到高的顺序是
您最近一年使用:0次



