I.氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。
(1)已知:2NO(g) = N2(g)+O2(g) △H=﹣180.5kJ•mol-¹
C(s)+O2(g)=CO2(g) △H=﹣393.5 kJ•mol-¹
2C(s)+O 2(g)=2CO(g) △H=﹣221kJ•mol-¹
若某反应的平衡常数表达式为: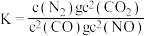 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式________________ 。
(2)N2O5在一定条件下可发生分解:2N2O5(g)=4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
①2.00min~5.00 min内,NO2的平均反应速率为___________ ;已知气体的物质的量与体系压强成正比,若反应开始时体系压强为P0,第4.00 min时体系压强为P1,则P1∶P0=__________ ;
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是________________ 。
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2υ正(NO2)=υ逆(N2O5) d.气体的密度保持不变
II.双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2只为还原产物),其电解的化学方程式为:3H2O+3O2 O3+3H2O2。则阳极的电极反应式为
O3+3H2O2。则阳极的电极反应式为_________________ ,阴极的电极反应式为___________________ 。
(1)已知:2NO(g) = N2(g)+O2(g) △H=﹣180.5kJ•mol-¹
C(s)+O2(g)=CO2(g) △H=﹣393.5 kJ•mol-¹
2C(s)+O 2(g)=2CO(g) △H=﹣221kJ•mol-¹
若某反应的平衡常数表达式为:
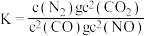 ,请写出此反应的热化学方程式
,请写出此反应的热化学方程式(2)N2O5在一定条件下可发生分解:2N2O5(g)=4NO2(g)+O2(g)。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
| t/min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
| c(N2O5)/(mol•L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①2.00min~5.00 min内,NO2的平均反应速率为
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是
a.容器中压强不再变化 b.NO2和O2的体积比保持不变
c.2υ正(NO2)=υ逆(N2O5) d.气体的密度保持不变
II.双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2只为还原产物),其电解的化学方程式为:3H2O+3O2
 O3+3H2O2。则阳极的电极反应式为
O3+3H2O2。则阳极的电极反应式为
更新时间:2017-02-17 15:00:36
|
【知识点】 化学平衡
相似题推荐
填空题
|
较易
(0.85)
【推荐1】在2L密闭容器内,800℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
(1)上述反应在第5s时NO的转化率是___________ 。用O2表示从0~2s内该反应的平均速率V(O2)=__________ 。
(2)下图中表示NO2的变化的曲线是__________ 。

(3)能使该反应的反应速率增大的是__________ 。
A.及时分离出NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂
(4)能说明该反应已达到平衡状态的是___________ 。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内质量保持不变;
 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.006 | 0.006 | 0.006 |
(1)上述反应在第5s时NO的转化率是
(2)下图中表示NO2的变化的曲线是

(3)能使该反应的反应速率增大的是
A.及时分离出NO2气体 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂
(4)能说明该反应已达到平衡状态的是
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内质量保持不变;
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】CS2是一种重要的化工原料。工业上可以利用固体硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,发生反应2S2(g)+CH4(g)⇌CS2(g)+2H2S(g),回答下列问题:
(1)某温度下,若S8完全分解成气态S2.在恒温密闭容器中,S2与CH4物质的量比为2:1时开始反应。
①当CS2的体积分数为10%时,CH4的转化率为___________ 。
②当以下数值不变时,能说明该反应达到平衡的是___________ (填序号)。
a.气体密度 b.气体总压 c.CH4与S2体积比 d.CS2的体积分数
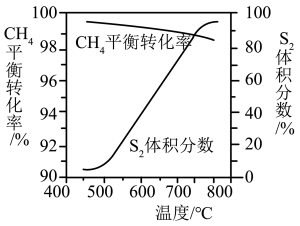
(2)一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。据图分析,生成CS2的反应为___________ (填“放热”或“吸热”)反应。工业上通常采用在600~650℃的条件下进行此反应,不采用低于600℃的原因是___________ 。
(3)已知常温常压下,64gS8完全分解为S2气体吸收的热量为akJ,S2气体的燃烧热为 ,写出表示S8燃烧热的热化学方程式:
,写出表示S8燃烧热的热化学方程式:___________ 。
(1)某温度下,若S8完全分解成气态S2.在恒温密闭容器中,S2与CH4物质的量比为2:1时开始反应。
①当CS2的体积分数为10%时,CH4的转化率为
②当以下数值不变时,能说明该反应达到平衡的是
a.气体密度 b.气体总压 c.CH4与S2体积比 d.CS2的体积分数
(2)一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。据图分析,生成CS2的反应为

(3)已知常温常压下,64gS8完全分解为S2气体吸收的热量为akJ,S2气体的燃烧热为
 ,写出表示S8燃烧热的热化学方程式:
,写出表示S8燃烧热的热化学方程式:
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐3】二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s) + 2NO(g) N2(g) + CO2(g) ΔH,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g) + CO2(g) ΔH,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率
v(N2)= mol·L-1·min-1;计算该反应的平衡常数K= 。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是 (填字母代号)。
A.加入合适的催化剂
B.适当缩小容器的体积
C.通入一定量的NO
D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率 (填“升高”或“降低”),ΔH 0(填“>”或“<”).
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式 。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s) + 2NO(g)
 N2(g) + CO2(g) ΔH,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g) + CO2(g) ΔH,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:| 时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.96 | 0.96 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
| CO2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率
v(N2)= mol·L-1·min-1;计算该反应的平衡常数K= 。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是 (填字母代号)。
A.加入合适的催化剂
B.适当缩小容器的体积
C.通入一定量的NO
D.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率 (填“升高”或“降低”),ΔH 0(填“>”或“<”).
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-12CH3OH(g)
 CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式 。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:
您最近一年使用:0次



