根据要求回答下列问题:
(1)机动车尾气已成为城市大气的主要污染源,机动车尾气中的主要有害物质为氮的氧化物。目前科技工作者正在探索用甲烷等燃料气体将氮氧化物还原为N2和H2O,涉及的反应有:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+2NO2(g)===CO2(g)+2H2O(g)+N2(g) ΔH2=-867 kJ·mol-1
写出CH4还原NO生成N2的热化学方程式:______________________________ 。
(2)一定条件下,不同量的CO2与不同量的NaOH充分反应放出的热量如下表所示:
写出该条件下,CO2与NaOH反应生成NaHCO3的热化学方程式:
______________________________________________ 。
(3)我国煤炭资源相对石油和天然气资源丰富,煤的综合利用主要是指煤的气化和液化。煤的主要成分为碳氢化合物,用CH代表煤的“分子式”。已知:
煤炭在氧气氛围中气化 2CH(s)+O2(g)===2CO(g)+H2(g) ΔH1
气化后的气体合成甲醇 CO(g)+2H2(g)===CH3OH(g) ΔH2
甲醇制备丙烯的反应 3CH3OH(g)===C3H6(g)+3H2O(g) ΔH3
写出在一定条件下,煤炭在氧气氛围中反应直接生成丙烯、水蒸气和CO的热化学方程式:
______________________________________ 。
(1)机动车尾气已成为城市大气的主要污染源,机动车尾气中的主要有害物质为氮的氧化物。目前科技工作者正在探索用甲烷等燃料气体将氮氧化物还原为N2和H2O,涉及的反应有:
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
CH4(g)+2NO2(g)===CO2(g)+2H2O(g)+N2(g) ΔH2=-867 kJ·mol-1
写出CH4还原NO生成N2的热化学方程式:
(2)一定条件下,不同量的CO2与不同量的NaOH充分反应放出的热量如下表所示:
| CO2的量 | NaOH的量 | 放出的热量 |
| 22.0 g | 750 mL 1.0 mol·L-1 | x kJ |
| 1.0 mol | 2.0 L 1.0 mol·L-1 | y kJ |
写出该条件下,CO2与NaOH反应生成NaHCO3的热化学方程式:
(3)我国煤炭资源相对石油和天然气资源丰富,煤的综合利用主要是指煤的气化和液化。煤的主要成分为碳氢化合物,用CH代表煤的“分子式”。已知:
煤炭在氧气氛围中气化 2CH(s)+O2(g)===2CO(g)+H2(g) ΔH1
气化后的气体合成甲醇 CO(g)+2H2(g)===CH3OH(g) ΔH2
甲醇制备丙烯的反应 3CH3OH(g)===C3H6(g)+3H2O(g) ΔH3
写出在一定条件下,煤炭在氧气氛围中反应直接生成丙烯、水蒸气和CO的热化学方程式:
更新时间:2017-06-24 19:02:23
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】回答下列问题。
(1)已知: 、
、 燃烧热分别为
燃烧热分别为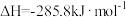 、
、 ,
,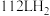 和
和 的混合气体(标准状况下)完全燃烧生成
的混合气体(标准状况下)完全燃烧生成 和液态水时放出
和液态水时放出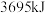 的热量,则混合气体中
的热量,则混合气体中 和
和 的物质的量之比是
的物质的量之比是___________ 。(整数比)
(2)某些共价键的键能数据如下表(单位: ):
):
把 分解为气态原子时,需要
分解为气态原子时,需要___________ (填“吸收”或“放出”)243kJ能量。由表中所列化学键形成的单质分子中,最稳定的是___________ ;
(3)发射火箭时用气态肼 作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知
作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知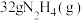 完全发生上述反应放出
完全发生上述反应放出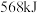 的热量,热化学方程式是:
的热量,热化学方程式是:___________ 。
(1)已知:
 、
、 燃烧热分别为
燃烧热分别为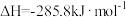 、
、 ,
,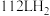 和
和 的混合气体(标准状况下)完全燃烧生成
的混合气体(标准状况下)完全燃烧生成 和液态水时放出
和液态水时放出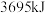 的热量,则混合气体中
的热量,则混合气体中 和
和 的物质的量之比是
的物质的量之比是(2)某些共价键的键能数据如下表(单位:
 ):
):| 共价键 |  |  |  |  |  |  |  |  |  |
| 键能 | 436 | 243 | 194 | 432 | 299 | 153 | 946 | 463 | 391 |
 分解为气态原子时,需要
分解为气态原子时,需要(3)发射火箭时用气态肼
 作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知
作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知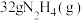 完全发生上述反应放出
完全发生上述反应放出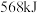 的热量,热化学方程式是:
的热量,热化学方程式是:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】(1)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.8kJ的热量(相当于25℃、101kPa下测得的热量).
①反应的热化学方程式为________________________________ .
②又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是________________ kJ.
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是_________________________________________________ .
(2)已知热化学方程式:①Fe2O3(s)+3CO(g)==2Fe(s)+3CO2(g)ΔH=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)==2Fe3O4(s)+CO2(g) ΔH=-47 kJ·mol-1
③Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) ΔH=19 kJ·mol-1
写出FeO(s)被CO还原生成Fe和CO2的热化学方程式:__________________________________________________________ 。
(3)已知反应2HI(g)=H2(g) + I2(g)的△H=+11kJ·mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________ kJ。
①反应的热化学方程式为
②又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
(2)已知热化学方程式:①Fe2O3(s)+3CO(g)==2Fe(s)+3CO2(g)ΔH=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)==2Fe3O4(s)+CO2(g) ΔH=-47 kJ·mol-1
③Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) ΔH=19 kJ·mol-1
写出FeO(s)被CO还原生成Fe和CO2的热化学方程式:
(3)已知反应2HI(g)=H2(g) + I2(g)的△H=+11kJ·mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】联合国气候变化大会于2009年12月7~18日在哥本哈根召开。中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%。
(1)有效“减碳”的手段之一是节能。下列制氢方法最符合这一做法的是_____ (填序号)。
A.电解水制氢:2H2O 2H2↑+ O2↑
2H2↑+ O2↑
B.高温使水分解制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O 2H2↑+O2↑
2H2↑+O2↑
D.天然气制氢:CH4+H2O CO+3H2
CO+3H2
(2)用CO2和氢气合成CH3OCH3(甲 醚 )是解决能源危机的研究方向之一。
已知:CO(g)+2H2(g)= CH3OH(g) △H = Q1kJ·mol-1
2CH3OH(g)= CH3OCH3(g)+H2O(g) △H = Q2kJ·mol-1
CO(g)+H2O(g)= CO2(g)+H2(g) △H = Q3kJ·mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为:_________________________ 。
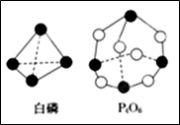
(3)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能:E(P-P)=198 kJ·mol-1、E(P-O)=360 kJ·mol-1、E(O=O)=498 kJ·mol-1, 则反应P4(白磷)燃烧生成P4O6的热化学方程式为:__________________________________ 。
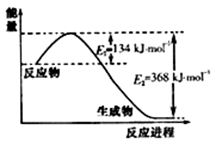
(4)如图是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,请写出NO2和CO反应的热化学方程式:___________________________ 。
(1)有效“减碳”的手段之一是节能。下列制氢方法最符合这一做法的是
A.电解水制氢:2H2O
 2H2↑+ O2↑
2H2↑+ O2↑B.高温使水分解制氢:2H2O
 2H2↑+O2↑
2H2↑+O2↑ C.太阳光催化分解水制氢:2H2O
 2H2↑+O2↑
2H2↑+O2↑D.天然气制氢:CH4+H2O
 CO+3H2
CO+3H2 (2)用CO2和氢气合成CH3OCH3(甲 醚 )是解决能源危机的研究方向之一。
已知:CO(g)+2H2(g)= CH3OH(g) △H = Q1kJ·mol-1
2CH3OH(g)= CH3OCH3(g)+H2O(g) △H = Q2kJ·mol-1
CO(g)+H2O(g)= CO2(g)+H2(g) △H = Q3kJ·mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为:
(3)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能:E(P-P)=198 kJ·mol-1、E(P-O)=360 kJ·mol-1、E(O=O)=498 kJ·mol-1, 则反应P4(白磷)燃烧生成P4O6的热化学方程式为:

(4)如图是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,请写出NO2和CO反应的热化学方程式:

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】完成下列问题
(1)已知CH3OH(l)的摩尔燃烧焓ΔH=-726.5 kJ·mol-1,CH3OH(l)+ O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a___________ (填“>”“<”或“=”)726.5。
(2)将Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145.0 kJ热量,写出该反应的热化学方程式:___________ 。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176.0 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为___________ 。
(4)CO2与H2在某催化剂的作用下反应如图所示:
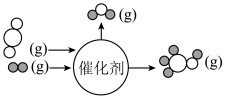
写出该反应的热化学方程式:___________ 。
(5)CO2催化加氢制CH3OH的一种反应历程如图所示(吸附在催化剂表面的物质用*标注,如CO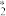 表示CO2吸附在催化剂表面)。
表示CO2吸附在催化剂表面)。
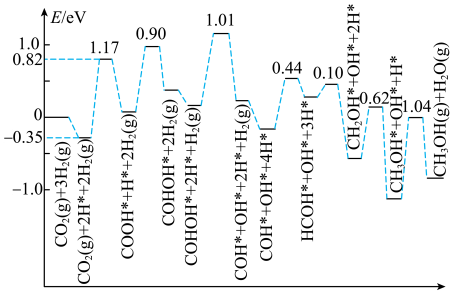
该反应历程中决速步反应的化学方程式为___________ 。
(1)已知CH3OH(l)的摩尔燃烧焓ΔH=-726.5 kJ·mol-1,CH3OH(l)+
 O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a
O2(g)=CO2(g)+2H2(g) ΔH=-a kJ·mol-1,则a(2)将Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145.0 kJ热量,写出该反应的热化学方程式:
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料:4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1 176.0 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为
(4)CO2与H2在某催化剂的作用下反应如图所示:

| 化学键 |  |  |  |  |  |
| 键能/(kJ·mol-1) | 436 | 326 | 803 | 464 | 414 |
(5)CO2催化加氢制CH3OH的一种反应历程如图所示(吸附在催化剂表面的物质用*标注,如CO
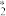 表示CO2吸附在催化剂表面)。
表示CO2吸附在催化剂表面)。
该反应历程中决速步反应的化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】氮和碳的氧化物分别是造成大气污染、温室效应的主要物质。
请回答下列问题:
(1) 的反应历程由两步基元反应组成,相关信息如下(E为活化能):
的反应历程由两步基元反应组成,相关信息如下(E为活化能):
第一步: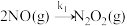
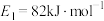
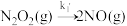
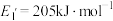
第二步: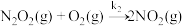

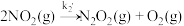

则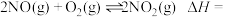
__________  。
。
(2)相关物质的燃烧热、化学键的键能如表所示:
① 转化为
转化为 的反应
的反应 的
的
__________  。
。
② 转化为合成气的反应
转化为合成气的反应 的
的
__________  。
。
请回答下列问题:
(1)
 的反应历程由两步基元反应组成,相关信息如下(E为活化能):
的反应历程由两步基元反应组成,相关信息如下(E为活化能):第一步:
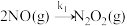
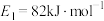
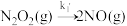
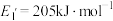
第二步:
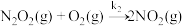

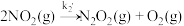

则
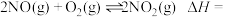
 。
。(2)相关物质的燃烧热、化学键的键能如表所示:
物质 |
|
|
| ||||||
燃烧热/( | 285.8 | 283.0 | 890.3 | ||||||
化学键 |
|
|
|
|
|
|
| ||
| 436 | 745 | 1076 | 463 | 413 | 946 | 391 | ||
①
 转化为
转化为 的反应
的反应 的
的
 。
。②
 转化为合成气的反应
转化为合成气的反应 的
的
 。
。
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】根据所学知识回答问题:
(1)写出下列反应的热化学方程式:
①NH3(气态)在高温高压催化剂下分解生成1mol N2(气态)与H2(气态),吸收92.2kJ的热量___________ 。
②1mol H2(气态)与适量O2(气态)起反应,生成H2O(液态)能放出285.8kJ的热量___________ 。
(2)工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0 MPa)和催化剂作用下进行的,反应器中发生了下列反应:
CO(g)+2H2(g) CH3OH(g)ΔH1=-90.7 kJ·mol-1①
CH3OH(g)ΔH1=-90.7 kJ·mol-1①
2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1②
CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1②
CO(g)+H2O(g) CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1③
CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1③
反应器中的总反应可表示为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),计算该反应的ΔH=
CH3OCH3(g)+CO2(g),计算该反应的ΔH=___________ 。
(3)一定温度下,反应H2+Cl2═2HCl中的某一基元反应H2+Cl·→HCl+H·,其能量变化如图所示。 表示反应物分子中旧化学键没有完全断裂、新化学键没有完全形成的过渡态。
表示反应物分子中旧化学键没有完全断裂、新化学键没有完全形成的过渡态。
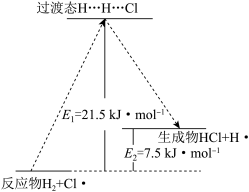
该基元反应的活化能为___________ kJ•mol-1,△H为___________ kJ•mol-1。
(1)写出下列反应的热化学方程式:
①NH3(气态)在高温高压催化剂下分解生成1mol N2(气态)与H2(气态),吸收92.2kJ的热量
②1mol H2(气态)与适量O2(气态)起反应,生成H2O(液态)能放出285.8kJ的热量
(2)工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0 MPa)和催化剂作用下进行的,反应器中发生了下列反应:
CO(g)+2H2(g)
 CH3OH(g)ΔH1=-90.7 kJ·mol-1①
CH3OH(g)ΔH1=-90.7 kJ·mol-1①2CH3OH(g)
 CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1②
CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ·mol-1②CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1③
CO2(g)+H2(g) ΔH3=-41.2 kJ·mol-1③反应器中的总反应可表示为3CO(g)+3H2(g)
 CH3OCH3(g)+CO2(g),计算该反应的ΔH=
CH3OCH3(g)+CO2(g),计算该反应的ΔH=(3)一定温度下,反应H2+Cl2═2HCl中的某一基元反应H2+Cl·→HCl+H·,其能量变化如图所示。
 表示反应物分子中旧化学键没有完全断裂、新化学键没有完全形成的过渡态。
表示反应物分子中旧化学键没有完全断裂、新化学键没有完全形成的过渡态。
该基元反应的活化能为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】在等压下化学反应所吸收或放出的热量,称为化学反应的焓变。回答下列问题:
(1)25℃、101kPa时,1g氨气完全燃烧放出18.6kJ的热量,则 △H=
△H=_______ kJ∙mol-1。
(2)2SO2(g)+ O2(g)⇌2SO3(g)反应过程的能量变化如图所示。
①E的大小对该反应的反应热_______ (填“有”或“无”)影响。
②SO2氧化为SO3的热化学方程式为_______ 。
(3)已知: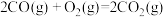 △H=-566 kJ∙mol-1 ①
△H=-566 kJ∙mol-1 ①
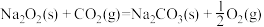 △H=-226 kJ∙mol-1②
△H=-226 kJ∙mol-1②
则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为_______ 。
(4)常压下,某铝热反应的温度与能量变化如图所示: △H=
△H=_______ kJ∙mol-1。
②101.3kPa、25℃时,该铝热反应的热化学方程式为_______ 。
(1)25℃、101kPa时,1g氨气完全燃烧放出18.6kJ的热量,则
 △H=
△H=(2)2SO2(g)+ O2(g)⇌2SO3(g)反应过程的能量变化如图所示。
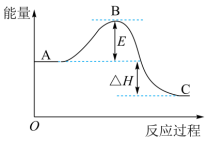
①E的大小对该反应的反应热
②SO2氧化为SO3的热化学方程式为
(3)已知:
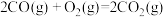 △H=-566 kJ∙mol-1 ①
△H=-566 kJ∙mol-1 ①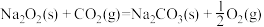 △H=-226 kJ∙mol-1②
△H=-226 kJ∙mol-1②则CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数目为
(4)常压下,某铝热反应的温度与能量变化如图所示:
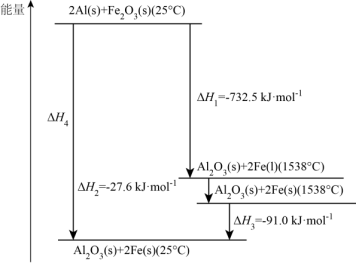
 △H=
△H=②101.3kPa、25℃时,该铝热反应的热化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
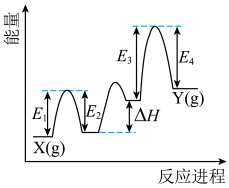
【推荐2】Cr2O3催化丙烷脱氢过程中,部分反应历程如图,X(g)→Y(g)过程的焓变为___________ (列式表示)。

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256KJ的热量。
(1)反应的热化学方程式为______ 。
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是______ KJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是______ 。
(4)已知N2(g) + 2O2(g) = 2NO2(g) ΔH=+67.7kJ/mol
N2H4(g) + O2(g) = N2(g) + 2H2O(g) ΔH=-534kJ/mol
则肼与NO2完全反应生成氮气和液态水的热化学方程式______ 。
(1)反应的热化学方程式为
(2)又已知H2O(l)=H2O(g);ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
(4)已知N2(g) + 2O2(g) = 2NO2(g) ΔH=+67.7kJ/mol
N2H4(g) + O2(g) = N2(g) + 2H2O(g) ΔH=-534kJ/mol
则肼与NO2完全反应生成氮气和液态水的热化学方程式
您最近一年使用:0次












