某同学用下面实验装置设计实验制备SO2并进行相关探究活动。
(1)装置A中反应的化学方程式为________________________ 。
(2)甲同学认为利用上述装置也可证明亚硫酸酸性强于次氯酸,请写出正确的装置连接顺序:A→_________ →_________ →C→F。
(3)乙同学从上面装置中选择合适的装置验证亚硫酸与碳酸的酸性强弱,其中用到C、D装置。则C装置的作用是________________________ ,通过______________________ 现象即可证明亚硫酸酸性强于碳酸。
(4)丙同学将A中产生的足量的SO2通入下图装置G中,G中有白色沉淀生成。该沉淀的化学式为_________ 。
推测产生沉淀的原因可能是(不考虑空气的影响)
原因一:SO2在酸性条件下被NO3―氧化;
原因二:SO2被Fe3+氧化;
原因三:__________________ 。
若是原因二,需证明Fe3+的还原产物,其实验操作及现象是________________________ 。
(5)实验中发现Na2SO3可能部分变质,现需测定Na2SO3的纯度,称15.0 g Na2SO3样品,配成250 mL溶液,取25.00 mL溶液,用0.20 mol·L―1酸性KMnO4溶液进行滴定,达到滴定终点时消耗KMnO4溶液20.00 mL。达到滴定终点时锥形瓶中溶液颜色变化是______________ ,样品中Na2SO3质量分数是_____________ 。
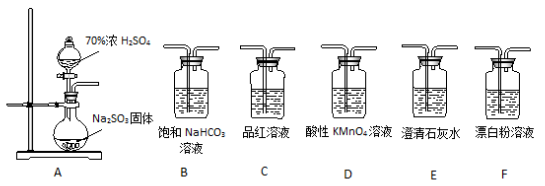
(1)装置A中反应的化学方程式为
(2)甲同学认为利用上述装置也可证明亚硫酸酸性强于次氯酸,请写出正确的装置连接顺序:A→
(3)乙同学从上面装置中选择合适的装置验证亚硫酸与碳酸的酸性强弱,其中用到C、D装置。则C装置的作用是
(4)丙同学将A中产生的足量的SO2通入下图装置G中,G中有白色沉淀生成。该沉淀的化学式为
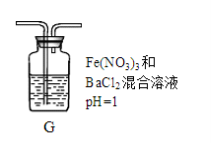
推测产生沉淀的原因可能是(不考虑空气的影响)
原因一:SO2在酸性条件下被NO3―氧化;
原因二:SO2被Fe3+氧化;
原因三:
若是原因二,需证明Fe3+的还原产物,其实验操作及现象是
(5)实验中发现Na2SO3可能部分变质,现需测定Na2SO3的纯度,称15.0 g Na2SO3样品,配成250 mL溶液,取25.00 mL溶液,用0.20 mol·L―1酸性KMnO4溶液进行滴定,达到滴定终点时消耗KMnO4溶液20.00 mL。达到滴定终点时锥形瓶中溶液颜色变化是
更新时间:2017-07-04 21:10:50
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】实验室用工业铬酸钠(Na2CrO4)为原料制备氯化铬晶体(CrCl3•6H2O)的主要步骤如下:

Ⅰ.将1mol工业铬酸钠、1mol甲醇、400mL水依次加入三颈烧瓶中。
Ⅱ.升温至120℃时,打开仪器a活塞缓慢滴加足量盐酸,保持温度在100℃反应3h,反应生成CO2。
Ⅲ.待反应液冷却后,用NaOH(aq)调节pH,得到Cr(OH)3沉淀。
Ⅳ.将过滤后所得固体完全溶解于过量的盐酸中,蒸发浓缩、冷却结晶、过滤、多次洗涤沉淀,低温干燥,得到CrCl3•6H2O。
(1)仪器a的名称是______ ;仪器b的冷凝水从______ 进水(选填“A:上口”或“B:下口”)。
(2)写出步骤Ⅱ的离子方程式:______ 。
(3)已知常温下Ksp[Cr(OH)3]≈1×10-32,步骤Ⅲ中,为使Cr3+沉淀完全,调节溶液pH的最小值是_____ (保留两位有效数字)。
测定产品中CrCl3•6H2O(M=266.5g•mol-1)纯度。称取产品0.2665g,加水溶解并定容于250mL容量瓶中,移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸腾后加入稍过量的Na2O2,充分加热煮沸,适当稀释,加稀酸酸化,使Cr3+完全转化为Cr2O ,再加入足量KI,加塞,摇匀,于暗处静置5min后,加入指示剂,用0.0100mol•L-1Na2S2O3(aq)滴定至终点,平行测定三次,平均消耗Na2S2O3(aq)21.00mL。
,再加入足量KI,加塞,摇匀,于暗处静置5min后,加入指示剂,用0.0100mol•L-1Na2S2O3(aq)滴定至终点,平行测定三次,平均消耗Na2S2O3(aq)21.00mL。
已知:Cr2O +6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2=Na2S4O6+2NaI。
+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2=Na2S4O6+2NaI。
(4)加入稍过量的Na2O2后,充分加热煮沸的目的是______ 。若缺少此操作测定结果会_____ (选填“A:偏大”或“B:偏小”)。加稀酸酸化,使用的是______ (选填“A:硫酸”或“B:盐酸”)。滴定使用的指示剂是______ 。
(5)产品中CrCl3•6H2O的质量分数为_____ (保留两位有效数字)。
(6)CrCl3•6H2O有三种结构,分别呈紫罗兰色、暗绿色和亮绿色。在三种化合物中,Cr3+的配位数均为6,等物质的量的三种化合物分别与足量AgNO3(aq)充分反应,生成的AgCl沉淀的物质的量之比为3:2:1,则呈亮绿色的配合物内界离子的化学式为______ 。
(7)CrCl3、CrF3的熔点分别是83℃和1100℃,两者熔点差异大的原因是______ 。
已知:
I2(Cr)>I2(Mn)的原因是______ 。

Ⅰ.将1mol工业铬酸钠、1mol甲醇、400mL水依次加入三颈烧瓶中。
Ⅱ.升温至120℃时,打开仪器a活塞缓慢滴加足量盐酸,保持温度在100℃反应3h,反应生成CO2。
Ⅲ.待反应液冷却后,用NaOH(aq)调节pH,得到Cr(OH)3沉淀。
Ⅳ.将过滤后所得固体完全溶解于过量的盐酸中,蒸发浓缩、冷却结晶、过滤、多次洗涤沉淀,低温干燥,得到CrCl3•6H2O。
(1)仪器a的名称是
(2)写出步骤Ⅱ的离子方程式:
(3)已知常温下Ksp[Cr(OH)3]≈1×10-32,步骤Ⅲ中,为使Cr3+沉淀完全,调节溶液pH的最小值是
测定产品中CrCl3•6H2O(M=266.5g•mol-1)纯度。称取产品0.2665g,加水溶解并定容于250mL容量瓶中,移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸腾后加入稍过量的Na2O2,充分加热煮沸,适当稀释,加稀酸酸化,使Cr3+完全转化为Cr2O
 ,再加入足量KI,加塞,摇匀,于暗处静置5min后,加入指示剂,用0.0100mol•L-1Na2S2O3(aq)滴定至终点,平行测定三次,平均消耗Na2S2O3(aq)21.00mL。
,再加入足量KI,加塞,摇匀,于暗处静置5min后,加入指示剂,用0.0100mol•L-1Na2S2O3(aq)滴定至终点,平行测定三次,平均消耗Na2S2O3(aq)21.00mL。已知:Cr2O
 +6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2=Na2S4O6+2NaI。
+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2=Na2S4O6+2NaI。(4)加入稍过量的Na2O2后,充分加热煮沸的目的是
(5)产品中CrCl3•6H2O的质量分数为
(6)CrCl3•6H2O有三种结构,分别呈紫罗兰色、暗绿色和亮绿色。在三种化合物中,Cr3+的配位数均为6,等物质的量的三种化合物分别与足量AgNO3(aq)充分反应,生成的AgCl沉淀的物质的量之比为3:2:1,则呈亮绿色的配合物内界离子的化学式为
(7)CrCl3、CrF3的熔点分别是83℃和1100℃,两者熔点差异大的原因是
已知:
| 元素 | 第二电离能I2/kJ•mol-1 |
| Cr | 1590.6 |
| Mn | 1509.0 |
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】五水合硫代硫酸钠( )俗称海波,为无色结晶或白色颗粒,在工业上有广泛的用途。某兴趣小组在实验室制备
)俗称海波,为无色结晶或白色颗粒,在工业上有广泛的用途。某兴趣小组在实验室制备 ,并用制得的硫代硫酸钠溶液测定废水中氰化钠的含量,回答下列问题:
,并用制得的硫代硫酸钠溶液测定废水中氰化钠的含量,回答下列问题:
Ⅰ.制备 。
。

(1)a装置中发生反应的化学方程式为________ 。
(2)b装置的作用是____ 。
(3)c装置反应的方程式为: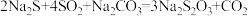 ,氧化产物与还原产物的物质的量之比为
,氧化产物与还原产物的物质的量之比为_____ ,若反应消耗的 体积为8.96L(STP),则该反应转移的电子数为
体积为8.96L(STP),则该反应转移的电子数为____ 。
(4)C中溶液经_____ 、过滤、洗涤、干燥,得到 。
。
(5)实验结束后,为避免拆除时装置中的气体逸出污染空气,可在e处连接盛NaOH溶液的容器,再______ (观察装置,填具体操作)。
Ⅱ.测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
实验如下:取15.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用 的标准
的标准 溶液滴定,消耗
溶液滴定,消耗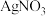 溶液的体积为1.50mL。
溶液的体积为1.50mL。
已知:a.废水中氰化钠的最高排放标准为 。
。
b.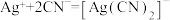 ,
,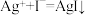 ,AgI呈黄色,且
,AgI呈黄色,且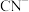 优先与
优先与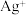 反应。
反应。
(6)请计算处理后的废水中NaCN的浓度为________ mg/L (保留两位小数),处理后的废水___________ (填“是”或“否”)能达到排放标准。
 )俗称海波,为无色结晶或白色颗粒,在工业上有广泛的用途。某兴趣小组在实验室制备
)俗称海波,为无色结晶或白色颗粒,在工业上有广泛的用途。某兴趣小组在实验室制备 ,并用制得的硫代硫酸钠溶液测定废水中氰化钠的含量,回答下列问题:
,并用制得的硫代硫酸钠溶液测定废水中氰化钠的含量,回答下列问题:Ⅰ.制备
 。
。
(1)a装置中发生反应的化学方程式为
(2)b装置的作用是
(3)c装置反应的方程式为:
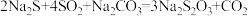 ,氧化产物与还原产物的物质的量之比为
,氧化产物与还原产物的物质的量之比为 体积为8.96L(STP),则该反应转移的电子数为
体积为8.96L(STP),则该反应转移的电子数为(4)C中溶液经
 。
。(5)实验结束后,为避免拆除时装置中的气体逸出污染空气,可在e处连接盛NaOH溶液的容器,再
Ⅱ.测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
实验如下:取15.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用
 的标准
的标准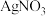 溶液滴定,消耗
溶液滴定,消耗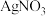 溶液的体积为1.50mL。
溶液的体积为1.50mL。已知:a.废水中氰化钠的最高排放标准为
 。
。b.
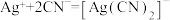 ,
,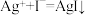 ,AgI呈黄色,且
,AgI呈黄色,且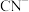 优先与
优先与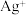 反应。
反应。(6)请计算处理后的废水中NaCN的浓度为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
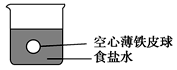
【推荐3】小华在实验室进行以下实验:将四个完全相同的空心薄铁皮球分别放入四个盛有密度为ρ(g/cm3)的食盐水的烧杯中,铁球所处的位置如图所示。然后,他将水、密度均为ρ(g/cm3)的三种溶液(CuSO4、AgNO3、稀硫酸)分别加入上述四个烧杯中。回答下列问题:
(1)加入水时,看到的现象是____________________________________________ 。
(2)加入稀硫酸时看到的现象是(假定整个反应过程中铁皮球壁完整)_____________________ ,发生反应的离子方程式是____________________________________________ 。
(3)加入CuSO4溶液时看到的现象是___________________________ ,发生反应的离子方程式是____________ 。
(4)加入AgNO3溶液时看到的现象是____________ ,发生反应的离子方程式是____________________ 。

(1)加入水时,看到的现象是
(2)加入稀硫酸时看到的现象是(假定整个反应过程中铁皮球壁完整)
(3)加入CuSO4溶液时看到的现象是
(4)加入AgNO3溶液时看到的现象是
您最近一年使用:0次



