四氧化三铁(Fe3O4)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具.水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH- ═Fe3O4↓+S4O62-+2H2O.请回答下列问题.
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是__________ .
(2)反应的化学方程式中x=______ .
(3)每生成1 mol Fe3O4,反应转移的电子为____ mol,被Fe2+还原的O2的物质的量为_____ mol.
(1)水热法制备Fe3O4纳米颗粒的反应中,还原剂是
(2)反应的化学方程式中x=
(3)每生成1 mol Fe3O4,反应转移的电子为
17-18高三上·湖南衡阳·阶段练习 查看更多[9]
(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)第09讲 氧化还原反应的计算及方程式的配平(精讲)——2021年高考化学一轮复习讲练测专题1.3 氧化还原反应(疑难突破)——巅峰冲刺2020年高考化学二轮专项提升【全国百强校】甘肃省兰州市第一中学2018-2019学年高一上学期12月月考化学试题湖南省醴陵市第一中学2017-2018学年高一上学期第二次月考(12月)化学试题湖南省衡阳县第一中学2018届高三上学期第二次月考化学试题
更新时间:2017-10-26 12:50:21
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】写出下列反应的离子方程式。
(1)FeBr2溶液与Cl2反应
①Cl2少量:___________ ;
②n(FeBr2)∶n(Cl2)=1∶1:___________ ;
③Cl2过量:___________ 。
类似该反应的还有FeI2溶液与Cl2的反应。
(2)NH4HCO3溶液与NaOH溶液反应
①NaOH少量:___________ ;
②NaOH足量:___________ 。
类似该反应的还有NH4HSO4溶液或NH4Al(SO4)2溶液与NaOH溶液的反应。
(1)FeBr2溶液与Cl2反应
①Cl2少量:
②n(FeBr2)∶n(Cl2)=1∶1:
③Cl2过量:
类似该反应的还有FeI2溶液与Cl2的反应。
(2)NH4HCO3溶液与NaOH溶液反应
①NaOH少量:
②NaOH足量:
类似该反应的还有NH4HSO4溶液或NH4Al(SO4)2溶液与NaOH溶液的反应。
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】(1)根据反应8NH3+3Cl2 6NH4Cl+N2,回答下列问题:
6NH4Cl+N2,回答下列问题:
①该反应中氧化剂是______________ ,氧化产物是___________________ 。
②该反应中被氧化的物质与被还原的物质物质的量之比为________________ 。
(2)某一反应体系中存在下列6种物质:NO、FeSO4、Fe(NO3)3、HNO3、Fe2(SO4)3和H2O。已知存在下列转化关系:HNO3→NO,请完成下列各题:
①该反应的氧化剂是__________ ,还原剂是___________ 。
②该反应中1 mol氧化剂____________ (填“得到”或“失去”)____________ mol电子。
③当有0.1 mol HNO3被还原,此时生成标准状况下NO的体积是__________ L。
④请把各物质填在下面空格处,需配平:______ +□______ □______+□______+□______+□
□______+□______+□______+□
 6NH4Cl+N2,回答下列问题:
6NH4Cl+N2,回答下列问题:①该反应中氧化剂是
②该反应中被氧化的物质与被还原的物质物质的量之比为
(2)某一反应体系中存在下列6种物质:NO、FeSO4、Fe(NO3)3、HNO3、Fe2(SO4)3和H2O。已知存在下列转化关系:HNO3→NO,请完成下列各题:
①该反应的氧化剂是
②该反应中1 mol氧化剂
③当有0.1 mol HNO3被还原,此时生成标准状况下NO的体积是
④请把各物质填在下面空格处,需配平:
 □______+□______+□______+□
□______+□______+□______+□
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐3】硫酸是工业生产中一种重要的化工产品,我国工业生产硫酸的主要方法是接触法,主要原料为黄铁矿,请回答下列问题:
(1)已知煅烧黄铁矿的化学方程式为 4FeS2+ 11O2 2Fe2O3+ 8SO2
2Fe2O3+ 8SO2
该反应中氧化剂和氧化产物之比为______________ ;标准状态下得到4.48升SO2 时,一共转移了________ mol e-。
(2)已知温度、压强对SO2平衡转化率的影响如下表所示:根据上表回答,SO2转化到SO3的最佳反应条件是_________ 。
(3)在一定条件下,1mol SO2完全转化成SO3气体时放出热量为Q1 kJ,写出该反应的热化学方程式:____________________________________ 。若在该条件下将2 mol SO2放入一定容积的密闭容器中,一段时间后测得反应放出热量为Q2 kJ,则此时SO2的转化率为____________ (用含Q1、Q2代数式表示)。
(4)市售浓硫酸的密度是1.84 g/cm3、质量分数为98 % ,若用H2SO4·XH2O来表示这种浓硫酸,则X为_________ 。
(1)已知煅烧黄铁矿的化学方程式为 4FeS2+ 11O2
 2Fe2O3+ 8SO2
2Fe2O3+ 8SO2该反应中氧化剂和氧化产物之比为
(2)已知温度、压强对SO2平衡转化率的影响如下表所示:根据上表回答,SO2转化到SO3的最佳反应条件是
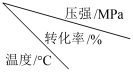 | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
| A.400-500℃ 0.1 MPa | B.400℃ 10 MPa |
| C.500℃ 10 MPa | D.400-500℃ 1 MPa |
(3)在一定条件下,1mol SO2完全转化成SO3气体时放出热量为Q1 kJ,写出该反应的热化学方程式:
(4)市售浓硫酸的密度是1.84 g/cm3、质量分数为98 % ,若用H2SO4·XH2O来表示这种浓硫酸,则X为
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具。铁及其化合物的价类二维图的部分信息如图,回答下列问题:

(1)向 溶液中滴加氢氧化钠至过量,可观察到的现象为
溶液中滴加氢氧化钠至过量,可观察到的现象为___________ ;写出反应⑦的化学方程式:___________ 。
(2) 属于
属于___________ (填“碱性”“酸性”或“两性”)氧化物,写出 与稀硫酸反应的离子方程式:
与稀硫酸反应的离子方程式:___________ 。
(3)电子工业中常用 的
的 溶液腐蚀敷在绝缘板上的铜箔(转化为
溶液腐蚀敷在绝缘板上的铜箔(转化为 )来制造印刷电路板。写出
)来制造印刷电路板。写出 溶液与铜发生反应的化学方程式:
溶液与铜发生反应的化学方程式:___________ ;若向 和
和 的混合溶液中加入一定量铁粉,最终有固体剩余,则下列有关说法中正确的是
的混合溶液中加入一定量铁粉,最终有固体剩余,则下列有关说法中正确的是___________ (填标号)。
A.固体中一定有铜 B.固体中一定有铁
C.溶液中一定有 D.溶液中一定有
D.溶液中一定有
(4)高铁酸盐(如 )是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用化学方程式表示为
)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用化学方程式表示为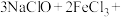
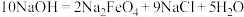 。请用双线桥法表示该反应电子转移的方向和数目:
。请用双线桥法表示该反应电子转移的方向和数目:_______ ,若反应过程中转移了 电子,则生成的氧化产物的物质的量为
电子,则生成的氧化产物的物质的量为_______  。
。

(1)向
 溶液中滴加氢氧化钠至过量,可观察到的现象为
溶液中滴加氢氧化钠至过量,可观察到的现象为(2)
 属于
属于 与稀硫酸反应的离子方程式:
与稀硫酸反应的离子方程式:(3)电子工业中常用
 的
的 溶液腐蚀敷在绝缘板上的铜箔(转化为
溶液腐蚀敷在绝缘板上的铜箔(转化为 )来制造印刷电路板。写出
)来制造印刷电路板。写出 溶液与铜发生反应的化学方程式:
溶液与铜发生反应的化学方程式: 和
和 的混合溶液中加入一定量铁粉,最终有固体剩余,则下列有关说法中正确的是
的混合溶液中加入一定量铁粉,最终有固体剩余,则下列有关说法中正确的是A.固体中一定有铜 B.固体中一定有铁
C.溶液中一定有
 D.溶液中一定有
D.溶液中一定有
(4)高铁酸盐(如
 )是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用化学方程式表示为
)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可用化学方程式表示为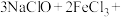
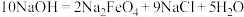 。请用双线桥法表示该反应电子转移的方向和数目:
。请用双线桥法表示该反应电子转移的方向和数目: 电子,则生成的氧化产物的物质的量为
电子,则生成的氧化产物的物质的量为 。
。
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐2】请按要求填空。
(1)写出磁性氧化铁的化学式:___________ 。
(2)碘水与 溶液混合,生成了
溶液混合,生成了 ,写出反应的离子方程式:
,写出反应的离子方程式:___________ 。
(3)溴水与 溶液反应有淡黄色AgBr沉淀生成,写出反应的离子方程式:
溶液反应有淡黄色AgBr沉淀生成,写出反应的离子方程式:________ 。
(4)已知在一定温度下,溴与NaOH溶液反应,产物中NaBrO与 的物质的量之比为3:1,写出反应的化学方程式:
的物质的量之比为3:1,写出反应的化学方程式:___________ 。
(1)写出磁性氧化铁的化学式:
(2)碘水与
 溶液混合,生成了
溶液混合,生成了 ,写出反应的离子方程式:
,写出反应的离子方程式:(3)溴水与
 溶液反应有淡黄色AgBr沉淀生成,写出反应的离子方程式:
溶液反应有淡黄色AgBr沉淀生成,写出反应的离子方程式:(4)已知在一定温度下,溴与NaOH溶液反应,产物中NaBrO与
 的物质的量之比为3:1,写出反应的化学方程式:
的物质的量之比为3:1,写出反应的化学方程式:
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】近期央视播放了一套“大型文博探索节目”《国家宝藏》深受观众喜爱,其中由故宫博物院展出的《千里江山图卷》更是气象磅礴,吞吐山河,该卷长11.91米,颜色绚丽,由石绿,雌黄,赭石,砗磲,朱砂等颜料绘制而成,了解颜料的主要问题,回答以下问题:
(1)赭石,暗棕红色矿石,主要成分是氧化铁,遇盐酸可溶解, 工业炼铁常用含有氧化铁的赤铁矿为原料,在此过程中,炼铁的主要设备是________ ,炼铁的原料包括________ (填字母);
A.焦炭 B.铁矿石 C.烧碱 D.热空气
(2)用CO还原赤铁矿的主要原理是________ (用化学方程式表示)
(3)下列矿石主要成分为FeS2的是________ 。(填字母)
A.赤铁矿 B.磁铁矿 C.黄铁矿
(1)赭石,暗棕红色矿石,主要成分是氧化铁,遇盐酸可溶解, 工业炼铁常用含有氧化铁的赤铁矿为原料,在此过程中,炼铁的主要设备是
A.焦炭 B.铁矿石 C.烧碱 D.热空气
(2)用CO还原赤铁矿的主要原理是
(3)下列矿石主要成分为FeS2的是
A.赤铁矿 B.磁铁矿 C.黄铁矿
您最近半年使用:0次



