常温下向10mL0.1mol/L氨水中缓缓加蒸馏水稀释到1L后,下列说法不正确 的是
| A.电离程度增大,导电能力减弱 | B.c(OH- )/c(NH3 ·H2O)增大 |
| C.溶液中OH- 数目减小 | D.Kb (NH3 ·H2O)不变 |
更新时间:2017-11-29 12:48:17
|
【知识点】 浓度对电离平衡的影响解读
相似题推荐
单选题
|
适中
(0.65)
【推荐1】醋酸的电离方程式为CH3COOH(aq)⇌H+(aq)+CH3COO-(aq) ΔH>0,25℃时,0.1mol/L醋酸溶液Ka=1.75×10-5(Ka表示酸的电离常数)。下列说法正确的是
| A.升高温度,c(H+)增大,Ka变大 |
| B.该溶液中加少量CH3COONa固体,平衡正向移动 |
| C.该温度下0.01mol/L醋酸溶液Ka<1.75×10-5 |
| D.向该溶液中滴加几滴浓盐酸,平衡逆向移动,c(H+)减小 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
| A.氨水的电离程度 | B.c(NH3·H2O)/c(OH-) |
| C.c(H+)和c(OH-)的乘积 | D.OH-的物质的量 |
您最近一年使用:0次

 。25℃时,
。25℃时, 醋酸溶液中存在下述关系:
醋酸溶液中存在下述关系: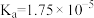 ,是该温度下醋酸的电离平衡常数
,是该温度下醋酸的电离平衡常数 。下列说法正确的是
。下列说法正确的是 减小
减小 固体,平衡正向移动
固体,平衡正向移动 醋酸溶液
醋酸溶液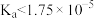
 增大,
增大, 变大
变大

