(1)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:
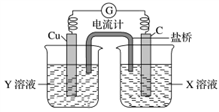
①写出电极反应式:正极__________________________ ;负极_________________________ 。
②图中X溶液是_______________ ,Y溶液是__________________ 。
③原电池工作时,盐桥中的________ (填“阳”或“阴”)离子向X溶液方向移动。
(2)如图是一个化学过程的示意图。
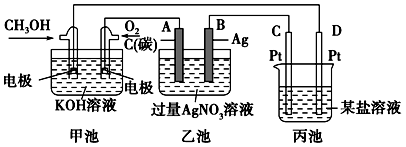
①甲池中OH-移向__________ 极(填“CH3OH”或“O2”)。
②写出通入CH3OH的电极的电极反应式_______________ 。
③乙池中总反应的离子方程式___________________ 。
④当乙池中B(A g)极的质量增加5.40g,若此时乙池中溶液的体积为500ml,则溶液的pH是___________ ;此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是______________ (填序号)。
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3

①写出电极反应式:正极
②图中X溶液是
③原电池工作时,盐桥中的
(2)如图是一个化学过程的示意图。

①甲池中OH-移向
②写出通入CH3OH的电极的电极反应式
③乙池中总反应的离子方程式
④当乙池中B(A g)极的质量增加5.40g,若此时乙池中溶液的体积为500ml,则溶液的pH是
A.MgSO4 B.CuSO4 C.NaCl D.AgNO3
更新时间:2018-01-27 13:56:23
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】(1)已知肼(N2H4)是一种清洁高效的火箭燃料,可以利用氨气和NaClO反应制备,请写出相应的化学方程式:________ 。
(2)0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。该反应的热化学方程式:________ 。
(3)燃料电池是一种高效低污染的新型电池,肼(N2H4)-空气燃料电池是一种碱性燃料电池,其工作原理如图所示:
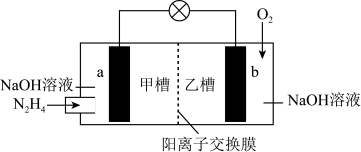
①电池中通入电池中通入N2H4的一极是________ (填“正”或“负”)极。写出该电极的反应:_______ 。
②电池工作时,正极附近的pH________ (填“增大”或者“不变”或者“减小”)。
③当消耗1molO2时,有________ mol Na+由甲槽向乙槽迁移。
(4)在酸性水溶液中,利用肼(N2H4)-空气燃料电池电解CO2可以生成甲酸,写出生成甲酸的电极反应式_________ 。
(2)0.25molN2H4(g)完全燃烧生成氮气和气态水时,放出133.5kJ热量。该反应的热化学方程式:
(3)燃料电池是一种高效低污染的新型电池,肼(N2H4)-空气燃料电池是一种碱性燃料电池,其工作原理如图所示:

①电池中通入电池中通入N2H4的一极是
②电池工作时,正极附近的pH
③当消耗1molO2时,有
(4)在酸性水溶液中,利用肼(N2H4)-空气燃料电池电解CO2可以生成甲酸,写出生成甲酸的电极反应式
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】Ⅰ.甲醇是一种重要的化工原料,具有开发和应用的广阔前景。如图所示,其中甲池的总反应式为: ,完成下列问题:
,完成下列问题:

(1)甲池燃料电池的负极反应式为___________ 。
(2)甲池中消耗112mL(标准状况) ,此时乙池中溶液的体积为400mL,该溶液
,此时乙池中溶液的体积为400mL,该溶液
___________ 。
(3)若以该甲醇燃料电池为电源,用石墨做电极电解200mL含有如下离子的溶液。
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),电路中转移的电子的物质的量是___________ mol。
Ⅱ.高铁酸钠( )是一种高效多功能水处理剂,在强碱性条件下稳定,易被
)是一种高效多功能水处理剂,在强碱性条件下稳定,易被 还原。以铁合金、
还原。以铁合金、 为电极,电解
为电极,电解 溶液制取
溶液制取 的装置如图所示。
的装置如图所示。
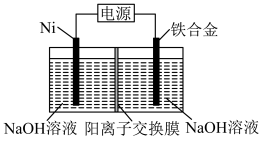
(4)①电解后,左右两侧溶液的pH值大小关系为pH(左)___________ pH(右)(填“>”“<”或“=”)。
②如果用铅蓄电池作为该电解池的电源,则铁合金应与铅蓄电池的___________ (填“Pb”或“PbO2”)相连。阳离子交换膜每通过1mol ,铅蓄电池的负极将增重
,铅蓄电池的负极将增重___________ g。
Ⅲ.二氧化氯是一种安全稳定、高效低毒的消毒剂,工业上有多种制备方法。一种方法是:惰性电极电解氯化铵和盐酸,原理如图。

(5)图2中“气体X”是___________ (写化学式)。
(6)c的电极反应式为___________ 。
 ,完成下列问题:
,完成下列问题:
(1)甲池燃料电池的负极反应式为
(2)甲池中消耗112mL(标准状况)
 ,此时乙池中溶液的体积为400mL,该溶液
,此时乙池中溶液的体积为400mL,该溶液
(3)若以该甲醇燃料电池为电源,用石墨做电极电解200mL含有如下离子的溶液。
| 离子 |  |  |  |  |
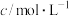 | 0.25 | 1 | 1 | 0.25 |
Ⅱ.高铁酸钠(
 )是一种高效多功能水处理剂,在强碱性条件下稳定,易被
)是一种高效多功能水处理剂,在强碱性条件下稳定,易被 还原。以铁合金、
还原。以铁合金、 为电极,电解
为电极,电解 溶液制取
溶液制取 的装置如图所示。
的装置如图所示。
(4)①电解后,左右两侧溶液的pH值大小关系为pH(左)
②如果用铅蓄电池作为该电解池的电源,则铁合金应与铅蓄电池的
 ,铅蓄电池的负极将增重
,铅蓄电池的负极将增重Ⅲ.二氧化氯是一种安全稳定、高效低毒的消毒剂,工业上有多种制备方法。一种方法是:惰性电极电解氯化铵和盐酸,原理如图。

(5)图2中“气体X”是
(6)c的电极反应式为
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】原电池是化学对人类的一项重大贡献。
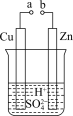
(1)某兴趣小组为研究电池原理,设计如图A装置。
①a和b不连接时,烧杯中发生反应的离子方程式是___________________ 。
②a和b用导线连接,Cu极为原电池________ (填“正”或“负”)极,该电极反应式是____________________________ 。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.4 mol电子,则理论上Zn片质量减轻________ g。
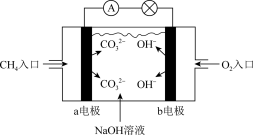
(2)如图B是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极是________ (填“a”或“b”)电极,该极的电极反应式为________________ 。
②电池工作一段时间后电解质溶液的pH________ (填“增大”“减小”或“不变”)。
(1)某兴趣小组为研究电池原理,设计如图A装置。
 |  |
| A | B |
②a和b用导线连接,Cu极为原电池
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.4 mol电子,则理论上Zn片质量减轻
(2)如图B是甲烷燃料电池原理示意图,回答下列问题:
①电池的负极是
②电池工作一段时间后电解质溶液的pH
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】对金属制品进行抗腐蚀处理,可减缓金属的腐蚀,延长其使用寿命。
(1)以下为铝材表面处理的一种方法:
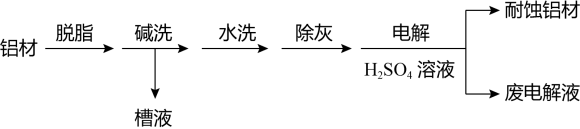
①碱洗的目的是除去铝表面的自然氧化膜(Al2O3),有关反应的离子方程式为_________________ 。碱洗时常有气泡冒出,该气体是_________ (填化学式)。
②电解时,处理好的铝材应与电源的________ 极相连,铝材表面形成氧化膜的电极反应式为_______ 。
(2)钢铁容易生锈的主要原因是钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在酸性环境下,其正极反应式为_________ ;在酸性很弱或中性条件下,其发生_______ (填“析氢腐蚀”或“吸氧腐蚀”)。
(3)下列装置中铁片腐蚀由快到慢的顺序是____________ (用序号表示)。
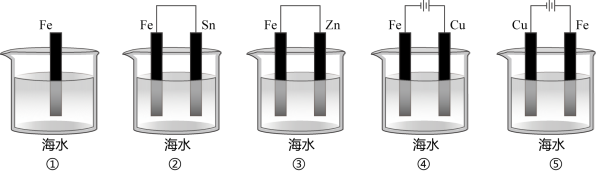
(4)利用如图装置,可以模拟铁的电化学防护。
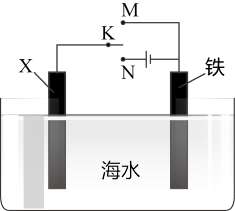
若X为碳棒,开关K置于N处,该电化学防护法称为______ ;若X为锌棒,开关K置于M处,_____ (填“能”或“不能”)达到防止铁腐蚀的目的。
(1)以下为铝材表面处理的一种方法:

①碱洗的目的是除去铝表面的自然氧化膜(Al2O3),有关反应的离子方程式为
②电解时,处理好的铝材应与电源的
(2)钢铁容易生锈的主要原因是钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在酸性环境下,其正极反应式为
(3)下列装置中铁片腐蚀由快到慢的顺序是

(4)利用如图装置,可以模拟铁的电化学防护。

若X为碳棒,开关K置于N处,该电化学防护法称为
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】如下图所示,某研究性学习小组利用上述燃烧原理设计一个肼(N2H4)─空气燃料电池(如图甲)并探究某些工业原理,其中乙装置中X为阳离子交换膜(即只允许阳离子通过)。
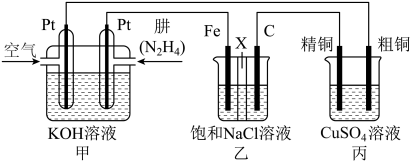
根据要求回答相关问题:
(1)甲装置中通入____ 气体的一极为正极,其电极反应式为:__________ 。
(2)乙装置中石墨电极为_____ 极(填“阳”或“阴”,其电极反应式为_____ ;可以用_____ 检验该反应产物,电解一段时间后,乙池中的溶液呈_________ 性。
(3)图中用丙装置模拟工业中的_________ 原理,如果电解后丙装置精铜质量增加3.2g,则理论上甲装置中肼消耗质量为_________ g。
(4)如果将丙中的粗铜电极换为Pt电极,则丙中总化学方程式为________ 。

根据要求回答相关问题:
(1)甲装置中通入
(2)乙装置中石墨电极为
(3)图中用丙装置模拟工业中的
(4)如果将丙中的粗铜电极换为Pt电极,则丙中总化学方程式为
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】如图所示,A、B、C三个装置中的烧杯分别盛有足量的CuCl2溶液。
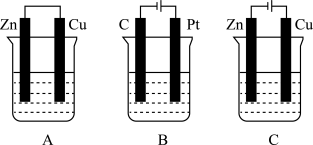
(1)A、B、C三个装置中属于原电池的是________ (填标号)。
(2)A池中Zn极发生______ 反应(填“氧化”或“还原”);Cu是________ 极,该极的电极反应式为______________________ 。
(3)B池中Pt是____ 极,该极的电极反应为________ , B池中总反应的化学方程式为________________________________ ,溶液中阴离子向________ (C、Pt)极移动。
(4)C池中Cu极的电极反应为________________ ,反应过程中,溶液浓度________ (填“变大”“变小”或“不变”)。

(1)A、B、C三个装置中属于原电池的是
(2)A池中Zn极发生
(3)B池中Pt是
(4)C池中Cu极的电极反应为
您最近半年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】按照要求回答下列问题:
(1)通过电解废旧锂电池中的LiMn2O4可获得难溶性的Li2CO3和MnO2,电解示意图如图(其中滤布的作用是阻挡固体颗粒,但离子可自由通过,电解过程中溶液的体积变化忽略不计)。
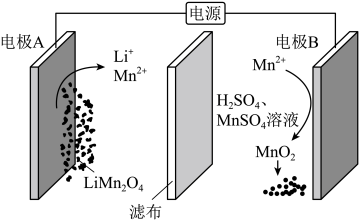
①电极B发生的电极反应式为______ 。
②电解一段时间后溶液中Mn2+浓度______ (填“增大”“减小”或“不变”)。
(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料均为石墨)。

①图中A口产生的气体为______ ,B口流出的物质是______ 。
②b电极表面发生的电极反应式为______ 。
(3)Co是磁性合金的重要材料,也是维生素的重要组成元素。工业上可用如图装置制取单质Co并获得副产品盐酸(A、B均为离子交换膜)。

①A为______ (填“阳”或“阴”)离子交换膜。
②该电解池的总反应离子方程式为______ 。
③若产品室中阴极质量增加11.8g,则产品室增加的HCl的物质的量为______ 。
(1)通过电解废旧锂电池中的LiMn2O4可获得难溶性的Li2CO3和MnO2,电解示意图如图(其中滤布的作用是阻挡固体颗粒,但离子可自由通过,电解过程中溶液的体积变化忽略不计)。

①电极B发生的电极反应式为
②电解一段时间后溶液中Mn2+浓度
(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料均为石墨)。

①图中A口产生的气体为
②b电极表面发生的电极反应式为
(3)Co是磁性合金的重要材料,也是维生素的重要组成元素。工业上可用如图装置制取单质Co并获得副产品盐酸(A、B均为离子交换膜)。

①A为
②该电解池的总反应离子方程式为
③若产品室中阴极质量增加11.8g,则产品室增加的HCl的物质的量为
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
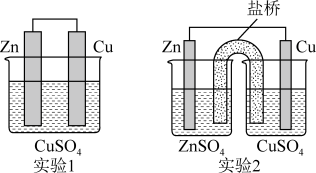
【推荐2】成都外国语学校化学兴趣小组探究了原电池、电解池的相关工作原理。
(1)小组同学进行了如下两个实验,其中电池工作效率更高的应是实验_______ 。实验2中,盐桥(含KCl饱和溶液的琼胶)中K+流向_______ (选填“ZnSO4”或“CuSO4”)溶液,如果Zn的消耗速率为1×10-3mol·s-1,则K+的迁移速率为_______ mol·s-1。
(2)小组同学分析研究甲醇和氧气以强碱(用NaOH表示)做电解质溶液的新型电池。甲醇在_______ 极反应;电极反应式为_______ 。
(3)小组同学设计了如下装置,用电解法把Na2CrO4转化为Na2Cr2O7。
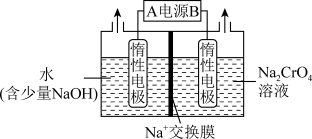
电解过程中,Na+的移动方向为_______ (填“左至右”或“右至左”)。Na2Cr2O7在阳极区产生的原理为_______ 。
(1)小组同学进行了如下两个实验,其中电池工作效率更高的应是实验

(2)小组同学分析研究甲醇和氧气以强碱(用NaOH表示)做电解质溶液的新型电池。甲醇在
(3)小组同学设计了如下装置,用电解法把Na2CrO4转化为Na2Cr2O7。

电解过程中,Na+的移动方向为
您最近半年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐3】结合所学知识,按要求回答问题。
(1)按要求写出电极反应式
①碱性锌锰电池的总反应为Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,写出正极反应式___________ 。
②将2FeCl3+2KI=I2+2FeCl2+2KCl设计成双液电池:正极烧杯中盛放的溶液为___________ ,电池负极的电极反应式为___________ 。
(2)如图是以石墨为电极,电解MgCl2溶液的装置:
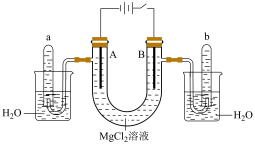
①电解时,A电极发生的电极反应为___________ 。
②检验b管中气体的方法是___________ 。
(3)某同学设计了如下图所示装置,用氢氧燃料电池作为电源探究粗铜精炼原理,根据要求回答问题:
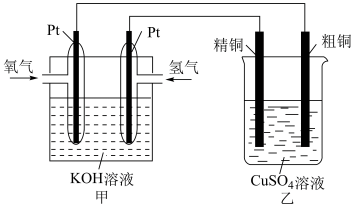
①甲装置中通入氧气的电极为___________ (填“正极”或“负极”),氧气发生的电极反应式___________ 。
②如果粗铜中含有铁、银等杂质,粗铜电极发生的电极反应式有___________ 。乙装置中反应一段时间后,CuSO4溶液的浓度___________ (填“增大”、“减小”或“不变”)。
③已知NA为阿伏加德罗常数的值。若在标准状况下,甲装置有2.24L氧气参加反应,则乙装置中阴极析出铜的质量理论上为___________ g。
(1)按要求写出电极反应式
①碱性锌锰电池的总反应为Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,写出正极反应式
②将2FeCl3+2KI=I2+2FeCl2+2KCl设计成双液电池:正极烧杯中盛放的溶液为
(2)如图是以石墨为电极,电解MgCl2溶液的装置:

①电解时,A电极发生的电极反应为
②检验b管中气体的方法是
(3)某同学设计了如下图所示装置,用氢氧燃料电池作为电源探究粗铜精炼原理,根据要求回答问题:

①甲装置中通入氧气的电极为
②如果粗铜中含有铁、银等杂质,粗铜电极发生的电极反应式有
③已知NA为阿伏加德罗常数的值。若在标准状况下,甲装置有2.24L氧气参加反应,则乙装置中阴极析出铜的质量理论上为
您最近半年使用:0次



