(1)某学生用0.1500 mol/L NaOH溶液测定某未知浓度的盐酸溶液,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸25.00 mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用序号字母填写):____ → → F → → → → D。
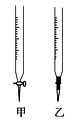
(2)操作F中应该选择图中滴定管_____ (填标号)。
(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察_____ 。
(4)滴定结果如表所示:
计算该盐酸的物质的量浓度为_____ (精确至0.0001)。
(5)下列操作会导致测定结果偏高的是_____ 。
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(6)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0﹣4 mol/L的KMnO4溶液。
Ⅰ、写出用KMn04滴定H2C2O4的离子方程式_____________________ 。
Ⅱ、判断滴定终点的方法是________________________ 。
Ⅲ、计算:血液中含钙离子的浓度为_____ mol/L。
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸25.00 mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用序号字母填写):
(2)操作F中应该选择图中滴定管

(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察
(4)滴定结果如表所示:
| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 0.60 | 20.60 |
| 3 | 25.00 | 0.20 | 20.19 |
(5)下列操作会导致测定结果偏高的是
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(6)氧化还原滴定实验与酸碱中和滴定类似(用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之)。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成 CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0﹣4 mol/L的KMnO4溶液。
Ⅰ、写出用KMn04滴定H2C2O4的离子方程式
Ⅱ、判断滴定终点的方法是
Ⅲ、计算:血液中含钙离子的浓度为
更新时间:2018-01-27 13:56:23
|
【知识点】 酸碱中和滴定的综合考查解读
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】高铁酸钾(K2FeO4)是一种新型绿色、高效的水处理剂,对病毒的去除率可达99.95%。
已知K2FeO4在低于常温的碱性环境中稳定,酸性条件下,其氧化性强于KMnO4、Cl2等。某化学兴趣小组设计制备K2FeO4并测定其纯度的实验步骤如下:
I.制备KClO:在搅拌和冰水浴条件下,将Cl2通入浓KOH溶液,同时补加一定量KOH,产生了大量白色沉淀,抽滤后得到滤液。
II.制备高铁酸钾(装置如图):
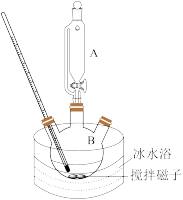
碱性条件下,向如图装置中加入上述滤液与Fe(NO3)3饱和溶液,反应一段时间,得到紫黑色溶液和大量白色沉淀,抽滤分离,用冰盐浴进一步冷却滤液得到K2FeO4粗品。
III.测定高铁酸钾样品的纯度:取0.300g上述步骤制备的K2FeO4样品于锥形瓶,在强碱性溶液中,用过量CrO 与FeO
与FeO 反应生成CrO
反应生成CrO 和Fe(OH)3。稀硫酸酸化后加入指示剂,以0.150mol•L-1摩尔盐标准溶液滴定Cr(VI)至Cr3+,每次实验平均消耗标准溶液20.00mL。回答下列问题:
和Fe(OH)3。稀硫酸酸化后加入指示剂,以0.150mol•L-1摩尔盐标准溶液滴定Cr(VI)至Cr3+,每次实验平均消耗标准溶液20.00mL。回答下列问题:
(1)写出实验II中生成FeO 的离子方程式
的离子方程式_______ 。
(2)仪器A的名称是_______ ;步骤II中,为了避免副产物K3FeO4的产生,Fe(NO3)3饱和溶液应放在仪器_______ 中(填“A”或“B”)。
(3)有关步骤II抽滤分离操作的说法中不正确的是_______ 。
A.本实验中应用玻璃纤维代替滤纸或用玻璃砂漏斗代替布氏漏斗
B.为减少产品的析出损失,可以用热水洗涤白色沉淀,并将洗涤液合并入滤液
C.当吸滤瓶中的液面接近支管口时,应拔掉吸滤瓶上的橡皮管,从支管口倒出滤液
D.洗涤沉淀时,应关闭水龙头,使洗涤剂缓慢通过沉淀物
(4)实验时共需0.150mol•L-1摩尔盐标准溶液约80mL,在横线上补齐配制该溶液的正确操作[提供试剂:(NH4)2Fe(SO4)2•6H2O,Mr=392]:检漏→蒸馏水洗涤→_______ →转移溶液并洗涤烧杯和玻璃棒,将洗涤液转移入容量瓶中→用煮沸过的蒸馏水定容→摇匀→装瓶。
(5)根据步骤III的测定数据,计算高铁酸钾样品的纯度为_______ 。
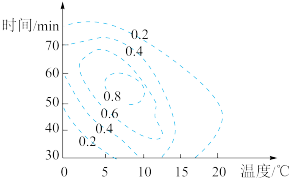
(6)根据K2FeO4理论合成产率与合成条件的曲面投影图(如图,虚线上的数据表示K2FeO4的理论合成产率),步骤II中控制的条件应是:温度_______ (填序号,下同);反应时间_______ 。
a.0.0~5.0℃ b.5.0~10.0℃ c.10.0~15.0℃ d.40~50min e.50~60min f.60~70min
已知K2FeO4在低于常温的碱性环境中稳定,酸性条件下,其氧化性强于KMnO4、Cl2等。某化学兴趣小组设计制备K2FeO4并测定其纯度的实验步骤如下:
I.制备KClO:在搅拌和冰水浴条件下,将Cl2通入浓KOH溶液,同时补加一定量KOH,产生了大量白色沉淀,抽滤后得到滤液。
II.制备高铁酸钾(装置如图):

碱性条件下,向如图装置中加入上述滤液与Fe(NO3)3饱和溶液,反应一段时间,得到紫黑色溶液和大量白色沉淀,抽滤分离,用冰盐浴进一步冷却滤液得到K2FeO4粗品。
III.测定高铁酸钾样品的纯度:取0.300g上述步骤制备的K2FeO4样品于锥形瓶,在强碱性溶液中,用过量CrO
 与FeO
与FeO 反应生成CrO
反应生成CrO 和Fe(OH)3。稀硫酸酸化后加入指示剂,以0.150mol•L-1摩尔盐标准溶液滴定Cr(VI)至Cr3+,每次实验平均消耗标准溶液20.00mL。回答下列问题:
和Fe(OH)3。稀硫酸酸化后加入指示剂,以0.150mol•L-1摩尔盐标准溶液滴定Cr(VI)至Cr3+,每次实验平均消耗标准溶液20.00mL。回答下列问题:(1)写出实验II中生成FeO
 的离子方程式
的离子方程式(2)仪器A的名称是
(3)有关步骤II抽滤分离操作的说法中不正确的是
A.本实验中应用玻璃纤维代替滤纸或用玻璃砂漏斗代替布氏漏斗
B.为减少产品的析出损失,可以用热水洗涤白色沉淀,并将洗涤液合并入滤液
C.当吸滤瓶中的液面接近支管口时,应拔掉吸滤瓶上的橡皮管,从支管口倒出滤液
D.洗涤沉淀时,应关闭水龙头,使洗涤剂缓慢通过沉淀物
(4)实验时共需0.150mol•L-1摩尔盐标准溶液约80mL,在横线上补齐配制该溶液的正确操作[提供试剂:(NH4)2Fe(SO4)2•6H2O,Mr=392]:检漏→蒸馏水洗涤→
(5)根据步骤III的测定数据,计算高铁酸钾样品的纯度为
(6)根据K2FeO4理论合成产率与合成条件的曲面投影图(如图,虚线上的数据表示K2FeO4的理论合成产率),步骤II中控制的条件应是:温度
a.0.0~5.0℃ b.5.0~10.0℃ c.10.0~15.0℃ d.40~50min e.50~60min f.60~70min

您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】某化学实验小组想要了解市场上所售食用白醋 主要是醋酸的水溶液
主要是醋酸的水溶液 的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
(1)反应生成的CH3COONa溶液显_________ 性,用离子方程式解释原因:____________ ,则实验中应选用上表中的__________ 作指示剂。
(2)用标准的NaOH溶液滴定待测的白醋时,如何判断滴定终点:_________________ 。
(3)第一次滴定前后,碱式滴定管中的液面位置如下图所示,请将有关数据填入下面表格的空白处。

滴定前_____________ ,滴定后____________ ,溶液体积________________
(4)从上表可以看出,第二次实验中记录消耗NaOH溶液的体积明显多于其余两次,其原因可能是________ 。
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
C.第二次滴定用的锥形瓶用待装液润洗过
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,计算该白醋中醋酸的物质的量浓度:c=______________ 。
 主要是醋酸的水溶液
主要是醋酸的水溶液 的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:
的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定。下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(2)用标准的NaOH溶液滴定待测的白醋时,如何判断滴定终点:
(3)第一次滴定前后,碱式滴定管中的液面位置如下图所示,请将有关数据填入下面表格的空白处。

| 滴定次数 | 待食用白醋的体积/mL | 0.1000mol/L NaOH溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | ______ | ______ | _____ |
| 第二次 | 25.00 | 1.56 | 28.08 | 26.52 |
| 第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(4)从上表可以看出,第二次实验中记录消耗NaOH溶液的体积明显多于其余两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.盛装标准液的滴定管装液前用蒸馏水润洗过,未用标准液润洗
C.第二次滴定用的锥形瓶用待装液润洗过
D.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(5)根据所给数据,计算该白醋中醋酸的物质的量浓度:c=
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】草酸晶体的组成可表示为H2C2O4·xH2O,为测定x值,进行下列实验。
①称取mg草酸晶体,配成100.0mL溶液。
②取25.0mL所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为cmol·L-1KMnO4溶液滴定。
请回答下列问题:
(1)实验①中为了配制准确浓度的草酸溶液,所需要的实验仪器主要有:天平(含砝码)、烧杯、药匙和___________ 、___________ 、___________ 。
(2)在实验②中,滴定时KMnO4溶液应装在___________ 式滴定管中,锥形瓶中___________ (填“需要”或“不需要”)滴加指示剂。
(3)某同学取一定量草酸溶液装入试管,加入一定体积的酸性高锰酸钾溶液,振荡试管,发现溶液开始缓慢褪色,后来迅速变成无色。(反应热效应不明显,可忽略不计)写出该实验离子反应方程式___________ ,该反应的反应速率迅速加快的主要原因可能是___________ 。
(4)在滴定过程中,目光应注视___________ 。
(5)若滴定时,滴定前后两次读数分别为amL和bmL,因此计算出x值为___________ 。
(6)若读取读数a时仰视,读取读数b时俯视,则所测x值___________ (填“偏大”、“偏小”或“不变”)
①称取mg草酸晶体,配成100.0mL溶液。
②取25.0mL所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为cmol·L-1KMnO4溶液滴定。
请回答下列问题:
(1)实验①中为了配制准确浓度的草酸溶液,所需要的实验仪器主要有:天平(含砝码)、烧杯、药匙和
(2)在实验②中,滴定时KMnO4溶液应装在
(3)某同学取一定量草酸溶液装入试管,加入一定体积的酸性高锰酸钾溶液,振荡试管,发现溶液开始缓慢褪色,后来迅速变成无色。(反应热效应不明显,可忽略不计)写出该实验离子反应方程式
(4)在滴定过程中,目光应注视
(5)若滴定时,滴定前后两次读数分别为amL和bmL,因此计算出x值为
(6)若读取读数a时仰视,读取读数b时俯视,则所测x值
您最近半年使用:0次



