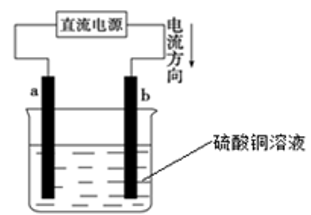
用惰性电极电解饱和硫酸铜溶液,装置由右图所示,则直流电源左端为______ 极(填“正”或“负”),b电极的电极反应式为:_______________ ;电解一段时间后,电解质溶液的pH_______ (填“变大”、“变小”或“不变”)。

更新时间:2018-01-26 22:34:54
|
相似题推荐
【推荐1】当今世界,“碳达峰”“碳中和”已经成为了环保领域的“热词”,我国力争于2030前做到碳达峰,2060年前实现碳中和。深度脱碳(CO2)的资源化利用能有效减少CO2排放,充分利用碳资源。
I.大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧,CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
(a)CH4(g) C(s)+2H2(g) ΔH1=akJ·mol-1
C(s)+2H2(g) ΔH1=akJ·mol-1
(b)CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=bkJ·mol-1
CO(g)+H2O(g) ΔH2=bkJ·mol-1
(c)2CO(g) CO2(g)+C(s) ΔH3=ckJ·mol-1
CO2(g)+C(s) ΔH3=ckJ·mol-1
(d)······
(1)根据盖斯定律,反应CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH =
2CO(g)+2H2(g) ΔH =_______ kJ·mol-1。
II.利用电化学方法可实现二氧化碳的资源化利用。
(2)原电池法:我国科学家研究Li—CO2电池,取得重大突破。该电池发生的原电池反应为:4Li+3CO2=2Li2CO3+C。
①在Li—CO2电池中,Li为单质锂片,是该原电池的_______ (填“正”或“负”)极。
②CO2电还原过程依次按以下四个步骤进行,写出步骤I的电极反应式
i._______
ii.C2O =CO
=CO +CO2
+CO2
iii.CO2+2CO =2CO
=2CO +C
+C
iv.CO +2Li+=Li2CO3
+2Li+=Li2CO3
(3)电解法:如电解CO2制HCOOK。该原理示意图如下:
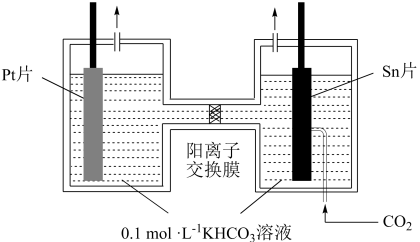
①Pt片为电解池的_______ 极。
②写出CO2还原为HCOO-的电极反应式:_______ 。
③电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是_______ 。
I.大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧,CH4与CO2重整是CO2利用的研究热点之一。该重整反应体系主要涉及以下反应:
(a)CH4(g)
 C(s)+2H2(g) ΔH1=akJ·mol-1
C(s)+2H2(g) ΔH1=akJ·mol-1(b)CO2(g)+H2(g)
 CO(g)+H2O(g) ΔH2=bkJ·mol-1
CO(g)+H2O(g) ΔH2=bkJ·mol-1(c)2CO(g)
 CO2(g)+C(s) ΔH3=ckJ·mol-1
CO2(g)+C(s) ΔH3=ckJ·mol-1(d)······
(1)根据盖斯定律,反应CH4(g)+CO2(g)
 2CO(g)+2H2(g) ΔH =
2CO(g)+2H2(g) ΔH =II.利用电化学方法可实现二氧化碳的资源化利用。
(2)原电池法:我国科学家研究Li—CO2电池,取得重大突破。该电池发生的原电池反应为:4Li+3CO2=2Li2CO3+C。
①在Li—CO2电池中,Li为单质锂片,是该原电池的
②CO2电还原过程依次按以下四个步骤进行,写出步骤I的电极反应式
i.
ii.C2O
 =CO
=CO +CO2
+CO2iii.CO2+2CO
 =2CO
=2CO +C
+Civ.CO
 +2Li+=Li2CO3
+2Li+=Li2CO3(3)电解法:如电解CO2制HCOOK。该原理示意图如下:

①Pt片为电解池的
②写出CO2还原为HCOO-的电极反应式:
③电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】铁、钴(Co)、镍(Ni)是同族元素,都是较活泼的金属,它们的化合物在工业上有重要的应用。
(1)Fe2(SO4)3和明矾一样也具有净水作用,其净水的原理是__________________ (用离子方程式表示)。
(2)已知某溶液中,Co2+、Ni2+的浓度分别为0.6 mol/L和1.2 mol/L ,取一定量的该溶液,向其中滴加NaOH溶液,当Co(OH)2开始沉淀时,溶液中 的值等于
的值等于_____ 。
(已知Ksp[Co(OH)2]=6.0×10-15,Ksp[Ni(OH)2]=2.0×10-15)
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备K2FeO4的流程如下图所示:

①上述氧化过程中,发生反应的离子方程式是:_________________________ ,
在实际生产中一般控制反应温度30℃以下,其原因是:
________________________________________________________ 。
②反应③加入浓KOH溶液可析出高铁酸钾(K2FeO4),这说明________________ 。
③某温度下,将Cl2通入NaOH溶液中,反应后得到NaCl、NaClO、NaClO3的混合溶液, 经测定ClO-与 离子的物质的量之比是1∶2,则Cl2与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为
离子的物质的量之比是1∶2,则Cl2与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为______________ 。
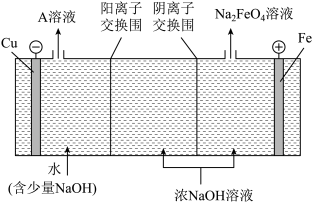
(4)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如下图所示:阳极的电极反应式为___________________ ;其中可循环使用的物质____________ 。
(1)Fe2(SO4)3和明矾一样也具有净水作用,其净水的原理是
(2)已知某溶液中,Co2+、Ni2+的浓度分别为0.6 mol/L和1.2 mol/L ,取一定量的该溶液,向其中滴加NaOH溶液,当Co(OH)2开始沉淀时,溶液中
 的值等于
的值等于(已知Ksp[Co(OH)2]=6.0×10-15,Ksp[Ni(OH)2]=2.0×10-15)
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备K2FeO4的流程如下图所示:

①上述氧化过程中,发生反应的离子方程式是:
在实际生产中一般控制反应温度30℃以下,其原因是:
②反应③加入浓KOH溶液可析出高铁酸钾(K2FeO4),这说明
③某温度下,将Cl2通入NaOH溶液中,反应后得到NaCl、NaClO、NaClO3的混合溶液, 经测定ClO-与
 离子的物质的量之比是1∶2,则Cl2与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为
离子的物质的量之比是1∶2,则Cl2与氢氧化钠反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为(4)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如下图所示:阳极的电极反应式为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】生 产MnO2和Zn的工艺简化流程如图所示(中间产物的固体部分已经略去):

软锰矿: MnO2含量≥65%;Al2O3含量为4%。闪锌矿: ZnS含量≥80%; FeS、CuS、CdS含量各为2%。 滤液B中含金属离子: Zn2+、Mn2+、 Fe2+、Al3+。
试回答下列问题:
(1)步骤①中软锰矿、闪锌矿与硫酸溶液共热时可析出硫,且金属元素转化为相应的硫酸盐(铁元素以+3价存在)。 其中MnO2和FeS发生的离子方程式为___________________________ 。
(2)步骤③ 中的MnO2也可用下列___________________ 物质代替(不考虑Mn2+的反应)
A.KMnO4固体 B.H2O2 C.浓硝酸 D.新制氯水
(3) 步骤⑤电解过程中阳极的电极反应式为___________________________ 。
(4)加入化合物C后可得纯净的ZnSO4 、MnSO4溶液,C可以是ZnO或Zn(OH)2,Mn (OH)2或MnCO3,
则产品D为___________________________ (填化学式)。
(5)I .将制得的MnO2(s)与KOH(s)、KClO3(s)(按比例混合,加热熔融(不断搅拌)可得KCl和K2MnO4的固体混合物;
II.再用5%的KOH溶液溶解得绿色(MnO42-)溶液;
III.向绿色溶液中通入适量的CO2后,将溶液加热,并趁热滤去残渣( 含MnO2(s)];
IV.将滤液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得紫色KMnO4晶体。
①第III步操作中“趁热过滤”的目的是___________________________ 。
② 写出III中生成KMnO4的化学程式__________________________________ 。
③III中需控制CO2的用量,若CO2过量,会使所得产品的纯度降低,原因可能是___________________

软锰矿: MnO2含量≥65%;Al2O3含量为4%。闪锌矿: ZnS含量≥80%; FeS、CuS、CdS含量各为2%。 滤液B中含金属离子: Zn2+、Mn2+、 Fe2+、Al3+。
试回答下列问题:
(1)步骤①中软锰矿、闪锌矿与硫酸溶液共热时可析出硫,且金属元素转化为相应的硫酸盐(铁元素以+3价存在)。 其中MnO2和FeS发生的离子方程式为
(2)步骤③ 中的MnO2也可用下列
A.KMnO4固体 B.H2O2 C.浓硝酸 D.新制氯水
(3) 步骤⑤电解过程中阳极的电极反应式为
(4)加入化合物C后可得纯净的ZnSO4 、MnSO4溶液,C可以是ZnO或Zn(OH)2,Mn (OH)2或MnCO3,
则产品D为
(5)I .将制得的MnO2(s)与KOH(s)、KClO3(s)(按比例混合,加热熔融(不断搅拌)可得KCl和K2MnO4的固体混合物;
II.再用5%的KOH溶液溶解得绿色(MnO42-)溶液;
III.向绿色溶液中通入适量的CO2后,将溶液加热,并趁热滤去残渣( 含MnO2(s)];
IV.将滤液蒸发浓缩、冷却结晶、过滤、洗涤、干燥得紫色KMnO4晶体。
①第III步操作中“趁热过滤”的目的是
② 写出III中生成KMnO4的化学程式
③III中需控制CO2的用量,若CO2过量,会使所得产品的纯度降低,原因可能是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐1】我国科学家以ZrO2、Al2O3、TiO2和活性炭为载体合成具有低温活性的钨酸盐催化剂。以天然锆英石(主要成分是ZrSiO4,含少量FeO、Al2O3、CuO,SiO2等杂质)为原料制备ZrO2的流程如下(部分条件和产物省略):
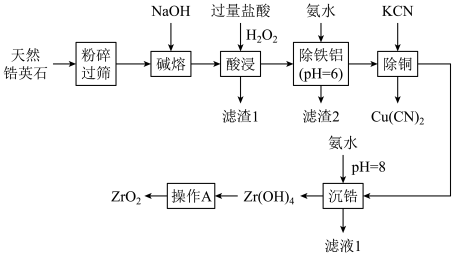
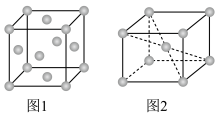
(1)锆单质晶体有最密面心立方、体心立方两种,如图所示。图1、图2晶胞中锆原子配位数之比为_______ 。
(2)“粉碎过筛”的目的是_______ 。
(3)滤渣1的主要成分是_______ (填化学式);实验室完成操作A时,装Zr(OH)4的仪器名称为_______ 。
(4)室温下,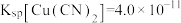 。为了使
。为了使 ,溶液
,溶液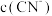 范围为
范围为_______ 。
(5)滤液1中CN-经处理达标后才能排放,常用电化学法处理,装置如图所示。
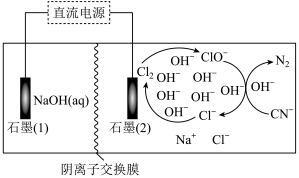
处理CN-的离子方程式为_______ 。

(1)锆单质晶体有最密面心立方、体心立方两种,如图所示。图1、图2晶胞中锆原子配位数之比为

(2)“粉碎过筛”的目的是
(3)滤渣1的主要成分是
(4)室温下,
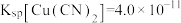 。为了使
。为了使 ,溶液
,溶液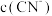 范围为
范围为(5)滤液1中CN-经处理达标后才能排放,常用电化学法处理,装置如图所示。

处理CN-的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
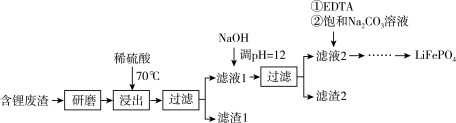
【推荐2】用含锂废渣(主要金属元素的含量:Li 3.50% Ni 6.55% Ca 6.41% Mg 13.24%)制备Li2CO3,并用其制备Li+电池的正极材料LiFePO4。部分工艺流程如下:
资料:ⅰ滤液1、滤液2中部分两者的浓度(g/L)
ⅱEDTA能和某些二价金属离子形成稳定的水溶性络合物。
ⅲ某些物质溶解度(S):
I.制备Li2CO3粗品
(l)上述流程中为加快化学反应速率而采取的措施是___ 。
(2)向滤液2中先加入EDTA,再加入饱和Na2CO3溶液,90℃充分反应后,分离出 固体Li2CO3粗品的操作是______ 。
(3)处理lkg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是____ g。(摩尔质量:Li 7 g.mol-l Li2CO3 74 g.mol-l)
II.纯化Li2CO3粗品
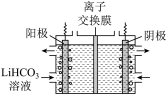
(4)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO3溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,阳极的电极反应式是_______ 。
III.制备LiFePO4
(5)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是__ 。

资料:ⅰ滤液1、滤液2中部分两者的浓度(g/L)
| Li+ | Ni2+ | Ca2+ | Mg2+ | |
| 滤液1 | 22.72 | 20.68 | 0.36 | 60.18 |
| 滤液2 | 21.94 | 7.7×10-3 | 0.08 | 0.78×10-3 |
ⅲ某些物质溶解度(S):
| T/℃ | 20 | 40 | 60 | 80 | 100 |
| S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
| S(Li2SO4)/g | 34.7 | 33.6 | 32.7 | 31.7 | 30.9 |
(l)上述流程中为加快化学反应速率而采取的措施是
(2)向滤液2中先加入EDTA,再加入饱和Na2CO3溶液,90℃充分反应后,分离出 固体Li2CO3粗品的操作是
(3)处理lkg含锂3.50%的废渣,锂的浸出率为a,Li+转化为Li2CO3的转化率为b,则粗品中含Li2CO3的质量是
II.纯化Li2CO3粗品
(4)将Li2CO3转化为LiHCO3后,用隔膜法电解LiHCO3溶液制备高纯度的LiOH,再转化得电池级Li2CO3。电解原理如图所示,阳极的电极反应式是

III.制备LiFePO4
(5)将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】CO2甲烷化是一种实现CO2资源化利用的有效途径。文献报道某课题组利用CO2催化氢化制甲烷的研究过程如图:

反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。CH4、HCOOH、H2的产量和镍粉用量的关系如图所示(仅改变镍粉用量,其他条件不变):
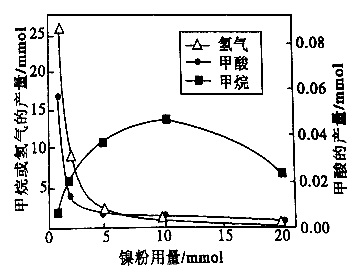
研究人员根据实验结果得出结论:
(1)HCOOH是CO2转化为CH4的中间体,即:CO2 HCOOH
HCOOH CH4
CH4
①由图可知,镍粉是___ 。(填字母)
a.反应Ⅰ的催化剂
b.反应Ⅱ的催化剂
c.反应Ⅰ,Ⅱ的催化剂
d.不是催化剂
②当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是___ 。(填字母)
a.反应Ⅰ的速率增加,反应Ⅱ的速率不变
b.反应Ⅰ的速率不变,反应Ⅱ的速率增加
c.反应Ⅰ,Ⅱ的速率均不变
d.反应Ⅰ,Ⅱ的速率均增加,且反应Ⅰ的速率增加得快
e.反应Ⅰ,Ⅱ的速率均增加,且反应Ⅱ的速率增加得快
f.反应Ⅰ的速率减小,反应Ⅱ的速率增加
(2)多晶Cu可高效催化CO2甲烷化,电解CO2制备CH4的原理示意图如图。电解过程中温度控制在10℃左右,持续通入CO2。阴、阳极室的KHCO3溶液的浓度基本保持不变。
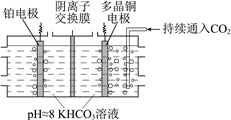
①铂电极作__ (填“阴”或“阳”)极。
②写出阴极的电极反应式,说明阴极室KHCO3溶液浓度基本不变的原因:__ 。

反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。CH4、HCOOH、H2的产量和镍粉用量的关系如图所示(仅改变镍粉用量,其他条件不变):

研究人员根据实验结果得出结论:
(1)HCOOH是CO2转化为CH4的中间体,即:CO2
 HCOOH
HCOOH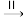 CH4
CH4①由图可知,镍粉是
a.反应Ⅰ的催化剂
b.反应Ⅱ的催化剂
c.反应Ⅰ,Ⅱ的催化剂
d.不是催化剂
②当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是
a.反应Ⅰ的速率增加,反应Ⅱ的速率不变
b.反应Ⅰ的速率不变,反应Ⅱ的速率增加
c.反应Ⅰ,Ⅱ的速率均不变
d.反应Ⅰ,Ⅱ的速率均增加,且反应Ⅰ的速率增加得快
e.反应Ⅰ,Ⅱ的速率均增加,且反应Ⅱ的速率增加得快
f.反应Ⅰ的速率减小,反应Ⅱ的速率增加
(2)多晶Cu可高效催化CO2甲烷化,电解CO2制备CH4的原理示意图如图。电解过程中温度控制在10℃左右,持续通入CO2。阴、阳极室的KHCO3溶液的浓度基本保持不变。

①铂电极作
②写出阴极的电极反应式,说明阴极室KHCO3溶液浓度基本不变的原因:
您最近一年使用:0次



