常温下向100mLFeCl3溶液中通入0.224L H2S,生成单质硫,再加入过量铁粉,反应停止后溶液中含有0.06mol阳离子。原FeCl3溶液的物质的量浓度是
| A.0.2 mol/L | B.0.3 mol/L | C.0.4 mol/L | D.0.6 mol/L |
更新时间:2018-10-22 20:15:07
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】设 表示阿伏加德罗常数的值,下列叙述正确的是
表示阿伏加德罗常数的值,下列叙述正确的是
 表示阿伏加德罗常数的值,下列叙述正确的是
表示阿伏加德罗常数的值,下列叙述正确的是A. 熔融态时含有 熔融态时含有 个离子 个离子 |
B.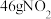 和 和 混合气体中氧原子总数为 混合气体中氧原子总数为 |
C.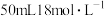 硫酸与足量铜共热,转移的电子数为 硫酸与足量铜共热,转移的电子数为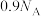 |
D. 的 的 水溶液中含有的氧原子数为 水溶液中含有的氧原子数为 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐2】下列说法正确的是
A.乙醇( )的摩尔质量是46 )的摩尔质量是46 | B.0.5mol/L的硫酸溶液中, 的浓度为1mol/L 的浓度为1mol/L |
| C.2mol/L的NaOH溶液中,含有2molNaOH | D.标准状况下,0.5mol水的体积约为11.2L |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列物质的性质与用途具有对应关系的是
A. 具有导电性,可用于制作光导纤维 具有导电性,可用于制作光导纤维 |
| B.氨气具有弱碱性,可用作食品工业制冷剂 |
C. 具有漂白性,可大量应用于各种食品添加剂 具有漂白性,可大量应用于各种食品添加剂 |
D. 具有氧化性,可用作铜制线路板的蚀刻剂 具有氧化性,可用作铜制线路板的蚀刻剂 |
您最近一年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐2】下列离子方程式书写正确的是
| A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B.将Cl2通入石灰乳中制漂白粉:Cl2+2OH-=Cl-+ClO-+H2O |
C.Ca(HCO3)2溶液中滴加少量NaOH溶液:Ca2++ +OH-=CaCO3↓+H2O +OH-=CaCO3↓+H2O |
D.CuSO4溶液中加入过量氨水:Cu2++2NH3•H2O=Cu(OH)2↓+2 |
您最近一年使用:0次
单选题
|
适中
(0.65)
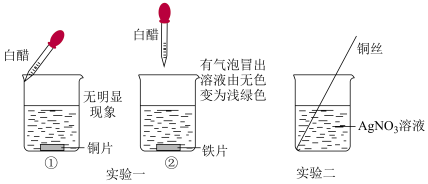
【推荐3】由下列实验操作和现象得出的结论错误的是
| 选项 | 操作 | 现象 | 结论 |
| A | 常温下,分别用浓HNO3和稀HNO3与铁反应 | 稀HNO3与铁反应快 | 其它条件相同,反应物浓度越小,反应速率越快 |
| B | 往盛有FeCl3溶液的试管中滴加几滴淀粉-碘化钾溶液 | 溶液变蓝 | 氧化性:Fe2+>I2 |
| C | 常温下,向三支试管中分别加入1mL0.1mol/L、0.2mol/L、0.3mol/LNa2S2O3溶液,再同时分别加入2mL0.5mol/L稀硫酸 | 加入0.3mol/LNa2S2O3溶液的试管最先沉淀 | 其它条件相同,c(Na2S2O3)越大,反应生成S的速率越快 |
| D | 向盛有稀盐酸的试管中加入铁粉 | 刚开始时一段时间内产生气泡的速率加快 | 铁与稀盐酸反应放出热量 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】下列除杂试剂选用正确且除杂过程不涉及 氧化还原反应的是( )
| 物质(括号内为杂质) | 除杂试剂 | |
| A | CH≡CH(H2S) | CuSO4溶液 |
| B | CO2(HCl) | 饱和Na2CO3溶液 |
| C | 铜粉(铁粉) | 过量盐酸 |
| D | Cl2(HCl) | H2O |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】在给定条件下,下列选项所示的物质间转化均能实现的是
A. |
B. |
C.稀盐酸 漂白粉 漂白粉 |
D.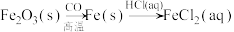 |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐1】在给定条件下,下列选项所示的物质间转化均能实现的是
A.AlCl3 Al(OH)3 Al(OH)3  [Al(OH)4 ]- [Al(OH)4 ]- |
B.Fe2O3(s)  Fe(s) Fe(s) FeCl3(aq) FeCl3(aq) |
C.NaHCO3(s) Na2CO3 Na2CO3 NaOH(aq) NaOH(aq) |
D.Al(s) NaAlO2(aq) NaAlO2(aq)  Al(OH)3 (s) Al(OH)3 (s) |
您最近一年使用:0次
单选题
|
适中
(0.65)
【推荐2】下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是:( )


| 甲 | 乙 | 丙 | 丁 | |
| A. | S | SO3 | SO2 | H2S |
| B. | Fe | FeCl3 | Fe(OH)3 | Fe2O3 |
| C. | Al2O3 | Al(OH)3 | NaAlO2 | AlCl3 |
| D. | Na2CO3 | NaOH | NaHCO3 | CO2 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
解题方法
【推荐3】探究铁及其化合物的性质,下列实验方案、现象或结论不正确的是
| 选项 | 实验方案 | 现象 | 结论 |
| A | 2mL0.01mol·L-1FeCl3溶液滴加 浓盐酸 浓盐酸 | 溶液颜色变浅 | 氢离子抑制了Fe3+的水解 |
| B | 常温下,向 溶液中加入 溶液中加入 溶液,将带火星的木条放在试管口 溶液,将带火星的木条放在试管口 | 木条复燃 |  比 比 的氧化性强 的氧化性强 |
| C | 向氢氧化铁胶体中逐滴加入稀硫酸至过量 | 先产生沉淀后逐渐溶解 | Fe(OH)3先聚集为沉淀,后与 应 应 |
| D | 向K3Fe(CN)6溶液中加入少许铁粉,静置一段时间 | 有蓝色沉淀生成 | K3Fe(CN)6具有氧化性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次