请回答下列问题:
(1)现有下列状态的物质:①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦熔融KOH ⑧盐酸。其中能导电的是__________ ,(填序号,下同),属于电解质的是___________ ,属于非电解质的是___________ 。
(2)将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则p、q的关系是________
(3)在同温、同压下,实验测得CO、N2和SO2三种气体的混合气体的密度是H2的20倍,其中SO2的体积分数为______ ;若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为______ 。
(1)现有下列状态的物质:①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦熔融KOH ⑧盐酸。其中能导电的是
(2)将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则p、q的关系是
(3)在同温、同压下,实验测得CO、N2和SO2三种气体的混合气体的密度是H2的20倍,其中SO2的体积分数为
更新时间:2018-11-24 22:37:23
|
相似题推荐
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】Ⅰ.如图所示,一密闭容器被无摩擦、可滑动的两隔板a、b分成甲、乙两室;标准状况下,在乙室中充入NH30.4mol,甲室中充入HCl、N2的混合气体,静止时隔板位置如图所示。已知甲、乙两室中气体的质量之差为17.3g。

(1)甲室中HCl、N2的质量之比为__________________ 。
(2)将隔板a去掉,一段时间后,隔板b将稳定位于刻度“________ ’’处(填数字,不考虑固体物质产生的压强),此时体系的平均相对分子质量为________ 。
Ⅱ.已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
(1)表中硫酸的质量分数为________ (不写单位,用含c1、ρ1,的代数式表示)。
(2)物质的量浓度为c1 mol•L-1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为________ mol•L-1。
(3)将物质的量浓度分别为c2 mol•L-1和0.2c2 mol•L-1的氨水等质量混合,所得溶液的物质的量浓度__________ 0.6c2 mol•L-1(填“大于”、“小于”或“等于”)(设混合后溶液的体积变化忽略不计)
Ⅲ.电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极)。
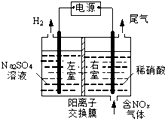
若用NO2气体进行模拟电解法吸收实验。
①写出电解时NO2发生反应的电极反应式:_________________________________ 。
②若有标准状况下2.24LNO2被吸收,通过阳离子交换膜的H+为________ mol。

(1)甲室中HCl、N2的质量之比为
(2)将隔板a去掉,一段时间后,隔板b将稳定位于刻度“
Ⅱ.已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
| 溶质的物质的量浓度/mol•L-1 | 溶液的密度/g•cm-3 | |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为
(2)物质的量浓度为c1 mol•L-1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为
(3)将物质的量浓度分别为c2 mol•L-1和0.2c2 mol•L-1的氨水等质量混合,所得溶液的物质的量浓度
Ⅲ.电解法处理含氮氧化物废气,可回收硝酸,具有较高的环境效益和经济效益。实验室模拟电解法吸收NOx的装置如图所示(图中电极均为石墨电极)。

若用NO2气体进行模拟电解法吸收实验。
①写出电解时NO2发生反应的电极反应式:
②若有标准状况下2.24LNO2被吸收,通过阳离子交换膜的H+为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】(1)在标准状况下,CO和CO2的混合气体共28L,质量为51g。其中CO2的质量为_____ g,混合气体中CO的物质的量分数为____ 。混合气体的平均摩尔质量为_______ 。
(2)同温同压下,同质量的NH3和H2S气体体积比为______ ,密度之比为________
(3)在120℃时分别进行如下四个反应(除S外其它物质均为气体):
A.2H2S+O2=2H2O+2S↓ B.2H2S+3O2=2H2O+2SO2
C.C2H4+3O2=2H2O+2CO2 D.C4H8+6O2=4H2O+4CO2
若反应在压强恒定、容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和V前<V后的是___________ ;符合d前>d后和V前>V后的是 ___________ (填写反应的代号)。
(2)同温同压下,同质量的NH3和H2S气体体积比为
(3)在120℃时分别进行如下四个反应(除S外其它物质均为气体):
A.2H2S+O2=2H2O+2S↓ B.2H2S+3O2=2H2O+2SO2
C.C2H4+3O2=2H2O+2CO2 D.C4H8+6O2=4H2O+4CO2
若反应在压强恒定、容积可变的容器内进行,反应前后气体密度(d)和气体体积(V)分别符合关系式d前>d后和V前<V后的是
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】回答下列问题:
(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为___________ 。
(2)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为___________ 。
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为___________ 。
(4)相同条件下,体积比为a∶b和质量比为a∶b的H2和O2的混合气体,其平均相对分子质量分别是___________ 和___________ 。
(1)标准状况下,1.92 g某气体的体积为672 mL,则此气体的相对分子质量为
(2)在25 ℃、101 kPa的条件下,同质量的CH4和A气体的体积之比是15∶8,则A的摩尔质量为
(3)两个相同容积的密闭容器X、Y,在25 ℃下,X中充入a g A气体,Y中充入a g CH4气体,X与Y内的压强之比是4∶11,则A的摩尔质量为
(4)相同条件下,体积比为a∶b和质量比为a∶b的H2和O2的混合气体,其平均相对分子质量分别是
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】(1)现有下列状态的物质:①干冰 ②NaHCO3晶体 ③氨水 ④纯醋酸 ⑤FeCl3溶液 ⑥铜 ⑦熔融KOH。其中能导电的是___ ,(填序号,下同),属于电解质的是___ ,属于非电解质的是___ 。
(2)将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则q___ 2p(填“大于”、“小于”、或“等于”)。
(3)在同温、同压下,实验测得CO、N2和SO2三种气体的混合气体的密度是H2的20倍,其中SO2的体积分数为____ %(小数点后保留一位数字);若其中CO和N2的物质的量之比为1∶1,则混合气体中氧元素的质量分数为____ %。
(2)将3p%的硫酸与同体积的p%的硫酸混合得到q%的稀硫酸,则q
(3)在同温、同压下,实验测得CO、N2和SO2三种气体的混合气体的密度是H2的20倍,其中SO2的体积分数为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】以下11种物质为中学化学中常见的物质:
①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4
⑥C2H5OH ⑦CaCO3 ⑧BaSO4 ⑨HCl
⑩NaOH ⑪NH3·H2O
请按下列要求回答问题。(注意:答案填序号)
(1)属于电解质的是____________________ ,非电解质的是____________________ 。
(2)在水溶液中能电离出H+的是________ ,属于酸的是________ 。
(3)属于碱的是________________ ,其中属于弱碱的是________ 。
(4)属于难溶性盐的是________ ,属于易溶性盐的是___________ 。
(5)属于强电解质的是________ ,属于弱电解质的是___________ 。
①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4
⑥C2H5OH ⑦CaCO3 ⑧BaSO4 ⑨HCl
⑩NaOH ⑪NH3·H2O
请按下列要求回答问题。(注意:答案填序号)
(1)属于电解质的是
(2)在水溶液中能电离出H+的是
(3)属于碱的是
(4)属于难溶性盐的是
(5)属于强电解质的是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】对于成千上万、形形色色的化学物质,用分类的思想对其进行学习和研究极其重要。有以下物质,请按要求作答。
① ②
② ③熔融
③熔融 ④盐酸 ⑤葡萄糖溶液 ⑥
④盐酸 ⑤葡萄糖溶液 ⑥ ⑦
⑦ 胶体 ⑧
胶体 ⑧ ⑨细铁丝 ⑩
⑨细铁丝 ⑩
(1)上述物质能导电的有_______ (填序号,下同),属于电解质的有_______ 。
(2)请写出②与④反应的离子反应方程式_______ 。
(3)写出⑧在水溶液中的电离方程式_______
(4)向⑩的水溶液中逐滴滴加⑧的水溶液,溶液的导电能力变化曲线如图中的_______ (填字母),当溶液恰好呈中性时 与
与 的物质的量之比为
的物质的量之比为_______ 。
A. B.
B. 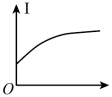
C.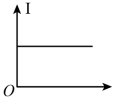 D.
D.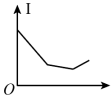
①
 ②
② ③熔融
③熔融 ④盐酸 ⑤葡萄糖溶液 ⑥
④盐酸 ⑤葡萄糖溶液 ⑥ ⑦
⑦ 胶体 ⑧
胶体 ⑧ ⑨细铁丝 ⑩
⑨细铁丝 ⑩
(1)上述物质能导电的有
(2)请写出②与④反应的离子反应方程式
(3)写出⑧在水溶液中的电离方程式
(4)向⑩的水溶液中逐滴滴加⑧的水溶液,溶液的导电能力变化曲线如图中的
 与
与 的物质的量之比为
的物质的量之比为A.
 B.
B. 
C.
 D.
D.
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】以下11种物质为中学化学中常见的物质:
①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4
⑥C2H5OH ⑦CaCO3 ⑧BaSO4 ⑨HCl
⑩NaOH ⑪NH3·H2O
请按下列要求回答问题。(注意:答案填序号)
(1)属于电解质的是____________________ ,非电解质的是____________________ 。
(2)在水溶液中能电离出H+的是________ ,属于酸的是________ 。
(3)属于碱的是________________ ,其中属于弱碱的是________ 。
(4)属于难溶性盐的是________ ,属于易溶性盐的是___________ 。
(5)属于强电解质的是________ ,属于弱电解质的是___________ 。
①Cu ②NaCl ③NaHSO4 ④SO3 ⑤H2SO4
⑥C2H5OH ⑦CaCO3 ⑧BaSO4 ⑨HCl
⑩NaOH ⑪NH3·H2O
请按下列要求回答问题。(注意:答案填序号)
(1)属于电解质的是
(2)在水溶液中能电离出H+的是
(3)属于碱的是
(4)属于难溶性盐的是
(5)属于强电解质的是
您最近一年使用:0次



