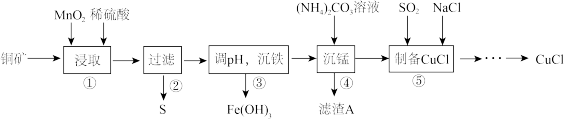
用某铜矿(含CuS以及少量FeO和Fe2O3)制备CuCl的主要流程如下:
已知Fe3+、Mn2+、Cu2+生成氢氧化物沉淀时的pH如下表所示:
(1)浸取时,CuS被浸取的离子方程式为CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O,该反应的氧化剂是________ (填化学式),Fe2O3被浸取的离子方程式为________________ 。
(2)步骤③调整pH的范围为______ ,滤渣A的成分为________ (填化学式)。
(3)“沉铁”时,需要检验Fe3+是否沉淀完全,所用的试剂为________ (填化学式)。
(4)准确称取所制备的氯化亚铜样品1.600 g,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用0.100 0 mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液25.00 mL,反应中Cr2O72-被还原为Cr3+,计算样品中CuCl的质量分数(写出计算过程)______ 。
已知Fe3+、Mn2+、Cu2+生成氢氧化物沉淀时的pH如下表所示:
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Mn(OH)2 | 7.1 | 10.1 |
| Cu(OH)2 | 4.7 | 6.7 |
(2)步骤③调整pH的范围为
(3)“沉铁”时,需要检验Fe3+是否沉淀完全,所用的试剂为
(4)准确称取所制备的氯化亚铜样品1.600 g,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用0.100 0 mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液25.00 mL,反应中Cr2O72-被还原为Cr3+,计算样品中CuCl的质量分数(写出计算过程)
更新时间:2019-02-24 17:39:04
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
【推荐1】镍酸锂( )被认为是一种具有较好发展前景的锂离子电池材料。一种以铁镍铜合金废料为原料生产
)被认为是一种具有较好发展前景的锂离子电池材料。一种以铁镍铜合金废料为原料生产 的工艺流程如图。
的工艺流程如图。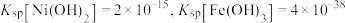 ,
,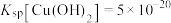 ,
, ,
,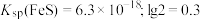 。
。
②常温下,有关金属阳离子开始沉淀和沉淀完全的pH如表。
回答下列问题:
(1)“酸溶”后,废料中的铁、镍和铜完全溶于混酸中,所得溶液中的溶质为 及过量的
及过量的 ,则尾气的主要成分为
,则尾气的主要成分为_____ 。
(2)“氧化”是将“酸溶”后溶液中的少量 氧化,适当升高温度会加快“氧化”速率,但温度高于60℃时,“氧化”速率会降低,其原因为
氧化,适当升高温度会加快“氧化”速率,但温度高于60℃时,“氧化”速率会降低,其原因为_____ 。
(3)“除铁”后滤渣的主要成分为_____ (写化学式),表格中的
_____ 。
(4)“沉铜”时,加入的试剂X可能为_____ (填字母)。
a.NaOH溶液 b. 气体 c.
气体 c. 溶液 d.FeS
溶液 d.FeS
(5)“沉镍”析出 沉淀,则滤液中的溶质主要为
沉淀,则滤液中的溶质主要为_____ (填化学式);在空气中“煅烧”的化学方程式为_____ 。
(6)若1.0t铁镍铜合金废料(含镍质量分数为59.0%)经过上述流程制得 ,则
,则 的产率为
的产率为_____ %(结果保留3位有效数字)。
 )被认为是一种具有较好发展前景的锂离子电池材料。一种以铁镍铜合金废料为原料生产
)被认为是一种具有较好发展前景的锂离子电池材料。一种以铁镍铜合金废料为原料生产 的工艺流程如图。
的工艺流程如图。
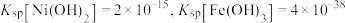 ,
,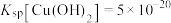 ,
, ,
,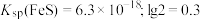 。
。②常温下,有关金属阳离子开始沉淀和沉淀完全的pH如表。
| 金属阳离子 |  |  |  |  |
| 开始沉淀的pH | 2.2 | 5.8 | 4.2 | 6.7 |
沉淀完全( )的pH )的pH | x | 8.8 | 7.7 | 9.3 |
(1)“酸溶”后,废料中的铁、镍和铜完全溶于混酸中,所得溶液中的溶质为
 及过量的
及过量的 ,则尾气的主要成分为
,则尾气的主要成分为(2)“氧化”是将“酸溶”后溶液中的少量
 氧化,适当升高温度会加快“氧化”速率,但温度高于60℃时,“氧化”速率会降低,其原因为
氧化,适当升高温度会加快“氧化”速率,但温度高于60℃时,“氧化”速率会降低,其原因为(3)“除铁”后滤渣的主要成分为

(4)“沉铜”时,加入的试剂X可能为
a.NaOH溶液 b.
 气体 c.
气体 c. 溶液 d.FeS
溶液 d.FeS(5)“沉镍”析出
 沉淀,则滤液中的溶质主要为
沉淀,则滤液中的溶质主要为(6)若1.0t铁镍铜合金废料(含镍质量分数为59.0%)经过上述流程制得
 ,则
,则 的产率为
的产率为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐2】工业上以电解锰渣(主要成分 、
、 ,含有少量
,含有少量 、
、 、
、 等)为原料制取
等)为原料制取 。
。

(1)“氧化”时发生反应的离子方程式为___________ ,工业上调节pH的过程选择在加热条件下进行,其目的是___________ 。
(2) 的溶解度曲线如图所示,从过滤后的滤液中获得
的溶解度曲线如图所示,从过滤后的滤液中获得 的操作为
的操作为___________ ,洗涤,低温干燥。

(3)为测定制得的 的纯度,称取
的纯度,称取 样品,配成
样品,配成 酸性溶液,取出
酸性溶液,取出 ,加入适量
,加入适量 和
和 溶液,加热使
溶液,加热使 全部氧化成
全部氧化成 ,用
,用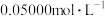 的
的 溶液滴定冷却后的含锰溶液至终点(滴定过程中
溶液滴定冷却后的含锰溶液至终点(滴定过程中 被还原为
被还原为 ),用去
),用去 溶液
溶液 ,计算该
,计算该 样品的纯度(写出计算过程)
样品的纯度(写出计算过程) ___ 。
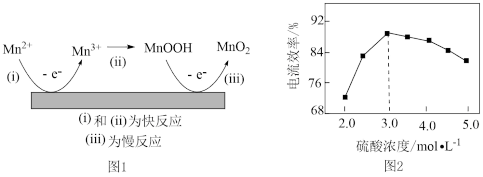
(4)工业上用电解 体系制备
体系制备 。电解获得
。电解获得 的机理(部分)如图1所示,电极上刚产生的
的机理(部分)如图1所示,电极上刚产生的 有更强反应活性。如图2
有更强反应活性。如图2 浓度与电流效率浓度超过
浓度与电流效率浓度超过 时,电流效率降低的原因是
时,电流效率降低的原因是___________ 。实验表明, 浓度过大,也会导致电流效率降低,可能的原因是
浓度过大,也会导致电流效率降低,可能的原因是___________ 。
 、
、 ,含有少量
,含有少量 、
、 、
、 等)为原料制取
等)为原料制取 。
。
(1)“氧化”时发生反应的离子方程式为
(2)
 的溶解度曲线如图所示,从过滤后的滤液中获得
的溶解度曲线如图所示,从过滤后的滤液中获得 的操作为
的操作为
(3)为测定制得的
 的纯度,称取
的纯度,称取 样品,配成
样品,配成 酸性溶液,取出
酸性溶液,取出 ,加入适量
,加入适量 和
和 溶液,加热使
溶液,加热使 全部氧化成
全部氧化成 ,用
,用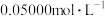 的
的 溶液滴定冷却后的含锰溶液至终点(滴定过程中
溶液滴定冷却后的含锰溶液至终点(滴定过程中 被还原为
被还原为 ),用去
),用去 溶液
溶液 ,计算该
,计算该 样品的纯度(写出计算过程)
样品的纯度(写出计算过程) (4)工业上用电解
 体系制备
体系制备 。电解获得
。电解获得 的机理(部分)如图1所示,电极上刚产生的
的机理(部分)如图1所示,电极上刚产生的 有更强反应活性。如图2
有更强反应活性。如图2 浓度与电流效率浓度超过
浓度与电流效率浓度超过 时,电流效率降低的原因是
时,电流效率降低的原因是 浓度过大,也会导致电流效率降低,可能的原因是
浓度过大,也会导致电流效率降低,可能的原因是
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
【推荐3】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:

(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为_______ 。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。
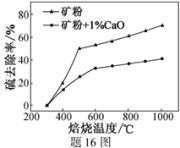
已知:多数金属硫酸盐的分解温度都高于600 ℃
硫去除率=(1— )×100%
)×100%
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于_______ 。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是__ 。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由__ (填化学式)转化为__ (填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3.Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=_______ 。

(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。

已知:多数金属硫酸盐的分解温度都高于600 ℃
硫去除率=(1—
 )×100%
)×100%①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由
(4)“过滤”得到的滤渣中含大量的Fe2O3.Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】CuCl用于石油工业脱硫与脱色,还可用作CO吸附剂和脱氧剂。CuCl是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。
Ⅰ.利用以下装置可制备CuCl

已知: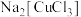 为无色溶液,加水稀释即析出CuCl白色固体,回答下列问题:
为无色溶液,加水稀释即析出CuCl白色固体,回答下列问题:
(1)制取 :A中发生的反应氧化剂和还原剂的物质的量之比为
:A中发生的反应氧化剂和还原剂的物质的量之比为_______ ,为吸收 尾气,C中可选用试剂
尾气,C中可选用试剂_______ (填标号)。
A. 溶液 B.饱和食盐水 C.
溶液 B.饱和食盐水 C. 溶液 D.浓
溶液 D.浓
(2)制备CuCl:打开分液漏斗旋塞与搅拌器,B中依次发生反应的离子方程式为:
①
②_______
③
观察到_______ 时停止反应。将B中溶液倾入盛有_______ 的烧杯中,立即得到白色CuCl沉淀。过滤得CuCl粗品。
(3)洗涤CuCl:洗涤时最好用_______ (填序号)洗涤滤饼3~4次,其目的是_______ 。
a. b.稀硫酸 c.95%的乙醇
b.稀硫酸 c.95%的乙醇
Ⅱ.工业上常用CuCl作 、CO的吸收剂,某同学利用如下图所示装置模拟工业上测定高炉煤气中CO、
、CO的吸收剂,某同学利用如下图所示装置模拟工业上测定高炉煤气中CO、 、
、 和
和 的含量。
的含量。
已知: 和KOH的混合溶液也能吸收氧气。
和KOH的混合溶液也能吸收氧气。
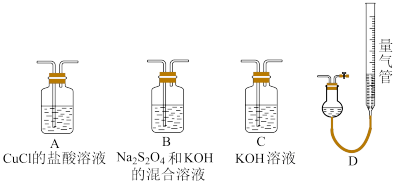
(4)装置的连接顺序应为_______ 。
(5)用D装置测 含量,若读数时右侧量气管液面高于左侧液面,则测得
含量,若读数时右侧量气管液面高于左侧液面,则测得 含量
含量_______ (填“偏大”“偏小”或“不变”)。
Ⅰ.利用以下装置可制备CuCl

已知:
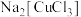 为无色溶液,加水稀释即析出CuCl白色固体,回答下列问题:
为无色溶液,加水稀释即析出CuCl白色固体,回答下列问题:(1)制取
 :A中发生的反应氧化剂和还原剂的物质的量之比为
:A中发生的反应氧化剂和还原剂的物质的量之比为 尾气,C中可选用试剂
尾气,C中可选用试剂A.
 溶液 B.饱和食盐水 C.
溶液 B.饱和食盐水 C. 溶液 D.浓
溶液 D.浓
(2)制备CuCl:打开分液漏斗旋塞与搅拌器,B中依次发生反应的离子方程式为:
①

②
③

观察到
(3)洗涤CuCl:洗涤时最好用
a.
 b.稀硫酸 c.95%的乙醇
b.稀硫酸 c.95%的乙醇Ⅱ.工业上常用CuCl作
 、CO的吸收剂,某同学利用如下图所示装置模拟工业上测定高炉煤气中CO、
、CO的吸收剂,某同学利用如下图所示装置模拟工业上测定高炉煤气中CO、 、
、 和
和 的含量。
的含量。已知:
 和KOH的混合溶液也能吸收氧气。
和KOH的混合溶液也能吸收氧气。
(4)装置的连接顺序应为
(5)用D装置测
 含量,若读数时右侧量气管液面高于左侧液面,则测得
含量,若读数时右侧量气管液面高于左侧液面,则测得 含量
含量
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】某校化学研究性学习小组在学习了金属的知识后,探究Cu的常见化合物的性质。过程如下:
【提出问题】
①在元素周期表中,Cu、Al位置接近,Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,Fe2+的稳定性小于Fe3+的,Cu+的稳定性小于Cu2+的吗?
③CuO有氧化性,能被H2、CO等还原,也能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有CuSO4溶液、_________________________ (填试剂名称,一种或多种),同时进行相关实验。
(2)解决问题②的实验步骤和现象如下:取 98 g Cu(OH)2固体,加热至80~100 ℃ 时,得到80 g黑色固体粉末,继续加热到1000 ℃ 以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72 g,A的化学式为________________ 。向A中加入足量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,则反应的离子方程式为______________________________________________ 。
(3)为解决问题③,设计的实验装置如图所示(夹持及尾气处理装置未画出):实验中观察到CuO变为红色物质。查资料可知,同时生成一种无污染的气体,该气体的化学式为________ 。
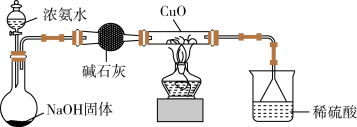
【实验结论】
(4)Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是_________________________ 。
(5)根据实验方案(2),得出的Cu+和Cu2+稳定性大小的结论:在高温时_________________ ;在酸性溶液中____________________________________________________________________ 。
(6)CuO能被NH3还原。有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物。请你设计一个简单的实验方案验证NH3与CuO反应后生成的红色物质中是否含有A:______________________________________________________________________ 。
【提出问题】
①在元素周期表中,Cu、Al位置接近,Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,Fe2+的稳定性小于Fe3+的,Cu+的稳定性小于Cu2+的吗?
③CuO有氧化性,能被H2、CO等还原,也能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有CuSO4溶液、
(2)解决问题②的实验步骤和现象如下:取 98 g Cu(OH)2固体,加热至80~100 ℃ 时,得到80 g黑色固体粉末,继续加热到1000 ℃ 以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72 g,A的化学式为
(3)为解决问题③,设计的实验装置如图所示(夹持及尾气处理装置未画出):实验中观察到CuO变为红色物质。查资料可知,同时生成一种无污染的气体,该气体的化学式为

【实验结论】
(4)Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是
(5)根据实验方案(2),得出的Cu+和Cu2+稳定性大小的结论:在高温时
(6)CuO能被NH3还原。有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物。请你设计一个简单的实验方案验证NH3与CuO反应后生成的红色物质中是否含有A:
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】工业上,处理低品位黄铜矿( 含量较低)常采用生物堆浸法。堆浸所得的溶液可用于制备碳酸亚铁和胆矾,相关流程如下图所示。
含量较低)常采用生物堆浸法。堆浸所得的溶液可用于制备碳酸亚铁和胆矾,相关流程如下图所示。
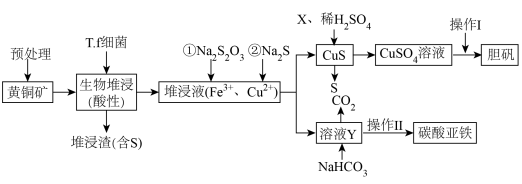
已知:①硫杆菌(T.f细菌)在 为
为 范围内可保持活性。
范围内可保持活性。
②金属离子沉淀的 如下表。
如下表。
回答下列问题:
(1) 中各元素均显常见价态且铜显最高价,则铁显
中各元素均显常见价态且铜显最高价,则铁显___________ 价;预处理的内容包括矿石的筛选、___________ 。
(2)生物堆浸(在空气环境中)过程中,溶液的 范围应控制在
范围应控制在___________ 较好;生物堆浸主要涉及两个反应:①___________ (写离子方程式),②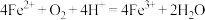 。
。
(3)堆浸液中加入 固体会还原
固体会还原 得到溶液
得到溶液 ,该反应
,该反应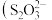 被氧化为
被氧化为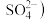 的氧化剂与还原剂物质的量之比为
的氧化剂与还原剂物质的量之比为___________ ,X是常用的绿色氧化剂,如 、
、___________ 。
(4)“操作I”是___________ 、过滤、洗涤、干燥。
(5)写出生成 的化学方程式:
的化学方程式:___________ 。
 含量较低)常采用生物堆浸法。堆浸所得的溶液可用于制备碳酸亚铁和胆矾,相关流程如下图所示。
含量较低)常采用生物堆浸法。堆浸所得的溶液可用于制备碳酸亚铁和胆矾,相关流程如下图所示。
已知:①硫杆菌(T.f细菌)在
 为
为 范围内可保持活性。
范围内可保持活性。②金属离子沉淀的
 如下表。
如下表。 |  |  | |
开始沉淀时的 | 1.5 | 4.2 | 6.3 |
完全沉淀时的 | 2.8 | 6.7 | 8.3 |
(1)
 中各元素均显常见价态且铜显最高价,则铁显
中各元素均显常见价态且铜显最高价,则铁显(2)生物堆浸(在空气环境中)过程中,溶液的
 范围应控制在
范围应控制在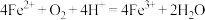 。
。(3)堆浸液中加入
 固体会还原
固体会还原 得到溶液
得到溶液 ,该反应
,该反应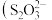 被氧化为
被氧化为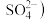 的氧化剂与还原剂物质的量之比为
的氧化剂与还原剂物质的量之比为 、
、(4)“操作I”是
(5)写出生成
 的化学方程式:
的化学方程式:
您最近一年使用:0次



