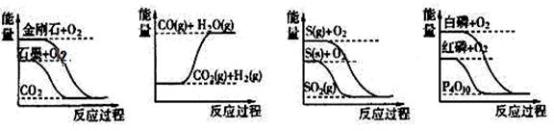
下列叙述正确的是( )
| A.吸热反应发生过程中需要不断地从外界获得能量,放热反应发生过程中不需要外界能量 |
| B.是放热反应还是吸热反应要由反应物、生成物所具有的总能量的相对大小决定 |
| C.若反应A(g)=B(g)是放热的,说明A物质比B物质稳定,分子内共价键键能A比B大 |
| D.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的放出的热量不同 |
更新时间:2019-05-10 10:34:13
|
相似题推荐
单选题
|
较易
(0.85)
名校
解题方法
【推荐1】石墨和金刚石互为同素异形体,石墨在一定条件下可以转化为金刚石。已知12g石墨完全转化为金刚石,需要吸收1.2kJ能量。下列说法正确的是
| A.石墨不如金刚石稳定 |
| B.金刚石不如石墨稳定 |
| C.石墨转化为金刚石是物理变化 |
| D.等质量的石墨与金刚石完全燃烧,石墨放出的能量更多 |
您最近一年使用:0次
【推荐2】2SO2(g)+O2(g) 2SO3(g)反应过程中的能量变化如图所示(图中 E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中 E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是

 2SO3(g)反应过程中的能量变化如图所示(图中 E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中 E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
| A.该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数 |
| B.该反应中,反应物的总键能大于生成物的总键能 |
C.500℃、101kPa 下,将 1molSO2(g)和 0.5molO2(g)置于密闭容器中充分反应生成 SO3(g)放热 akJ,其热化学方程式为 2SO2(g) + O2(g) 2SO3(g) ΔH<-2a kJ·mol-l 2SO3(g) ΔH<-2a kJ·mol-l |
| D.ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐3】下列有关反应热的叙述正确的是( )
| A.X(g)+Y(g)⇌Z(g)+W(s) △H>0,恒温恒容条件下达到平衡后加入X,上述反应的△H增大 |
| B.C(s,石墨)=C(s,金刚石) △H=+1.9kJ/mol,说明金刚石比石墨稳定 |
| C.已知2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol |
| D.已知C(s)+O2(g)=CO2(g) △H1,C(s)+1/2O2(g)=CO(g) △H2,则△H1<△H2 |
您最近一年使用:0次
【推荐1】下列图象分别表示有关反应的反应过程与能量变化的关系,下列说法中不正确的是
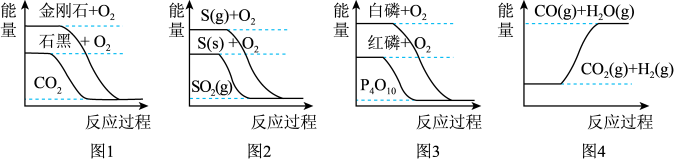

| A.由图1知,石墨转变为金刚石是吸热反应 |
B.由图2知, , , ,则 ,则 |
| C.由图3知,红磷比白磷稳定 |
D.由图4知, |
您最近一年使用:0次
【推荐2】理论研究表明,在101kPa和298K下,HCN(g)⇌HNC(g)异构化反应过程的能量变化如图所示。下列说法正确的是


| A.HNC比HCN稳定 |
| B.该异构化反应的△H=-59.3kJ/mol |
| C.反应物的键能大于生成物的键能 |
| D.使用催化剂,可以改变反应的反应热 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】下列属于吸热反应的是
| A.可燃冰的燃烧 | B.盐酸和氢氧化钠反应 |
| C.石灰石高温分解 | D.锌与稀硫酸反应 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐2】二氧化硫是一种重要的化工原料,可以制取硫酸等化工产品。其中,催化制取三氧化硫的热化学方程式为: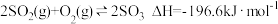 ,二氧化硫也是形成酸雨的主要污染物,可以通过氨气水溶液进行吸收。实验室可以用浓硫酸与铜加热制取少量二氧化硫。在恒温恒压的密闭容器中,二氧化硫转化成三氧化硫,下列相关说法正确的是
,二氧化硫也是形成酸雨的主要污染物,可以通过氨气水溶液进行吸收。实验室可以用浓硫酸与铜加热制取少量二氧化硫。在恒温恒压的密闭容器中,二氧化硫转化成三氧化硫,下列相关说法正确的是
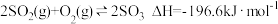 ,二氧化硫也是形成酸雨的主要污染物,可以通过氨气水溶液进行吸收。实验室可以用浓硫酸与铜加热制取少量二氧化硫。在恒温恒压的密闭容器中,二氧化硫转化成三氧化硫,下列相关说法正确的是
,二氧化硫也是形成酸雨的主要污染物,可以通过氨气水溶液进行吸收。实验室可以用浓硫酸与铜加热制取少量二氧化硫。在恒温恒压的密闭容器中,二氧化硫转化成三氧化硫,下列相关说法正确的是| A.该反应中,反应物的总能量<产物的总能量 |
B.使用优质催化剂,平衡时体系中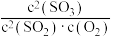 的值增大 的值增大 |
C.相同时间内,当消耗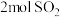 同时生成 同时生成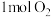 时,反应处于平衡状态 时,反应处于平衡状态 |
| D.升高温度,能加快反应速率,提高二氧化硫的平衡转化率 |
您最近一年使用:0次
【推荐1】N2(g)+3H2(g)⇌2NH3(g),∆H=-akJ·mol-1反应过程中的能量变化如图所示(图中 E1表示无催化剂时正反应活化能的数值,E2表示无催化剂时逆反应活化能的数值)。下列说法错误的是


| A.升高温度可提高 N2、H2、NH3的活化分子百分数 |
| B.a = E2-E1 |
| C.恒温恒压条件下通氦气的瞬间,单位体积内 N2的活化分子数减小 |
| D.将 1molN2(g) 和 3molH2(g) 置于密闭容器中充分反应放出 akJ 的热量 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐2】反应2C+O2=2CO的能量变化如图所示。下列说法正确的是( )
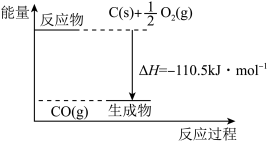

| A.12gC(s)与一定量O2(g)反应生成14gCO(g)放出的热量为110.5kJ |
| B.2molC(s)与足量O2(g)反应生成CO2(g)放出的热量大于221kJ |
| C.该反应的热化学方程式是2C(s)+O2(g)=2CO(g) ΔH=-221kJ |
| D.该反应的反应热等于生成的CO(g)中所具有的能量与参加反应的O2(g)中所具有的能量的差 |
您最近一年使用:0次