某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体______ g。
(2)从下表中选择称量NaOH固体所需要的仪器是(填字母):____ 。
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
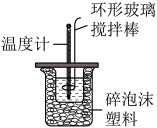
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):_____ 。
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写下表 中的空白:
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热△H=___ (取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)________ 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体
(2)从下表中选择称量NaOH固体所需要的仪器是(填字母):
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |  |  |  |  |  |  |
序号 | a | b | c | d | e | f |

(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写
| 温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热△H=
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
13-14高一下·黑龙江·期中 查看更多[4]
2019年秋高三化学复习强化练习—— 中和热安徽省池州市第一中学2019-2020学年高二上学期期中考试化学试题江西省南昌市八一中学、洪都中学、麻丘高中等六校2017-2018学年高二10月联考化学试题(已下线)2013-2014黑龙江省哈六中学高一下学期期中考试化学试卷
更新时间:2019-11-18 06:48:23
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:___________ 。
(2)写出表示该反应中和热的热化学方程式(中和热为57.3kJ·mol-1):___________ (用离子方程式表示)
(3)实验中改用60mL0.50mol•L-1盐酸与60mL0.55mol•L-1NaOH溶液进行反应,与上述实验相比,所放出的热量___________ (填“相等”或“不相等”),所求得的中和热___________ (填“相等”或“不相等”)。
(4)若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为①3.3℃、②3.5℃、③4.5℃,则最终代入计算式的温差平均值为___________ ℃。计算该实验测得的中和反应反应热ΔH=___________ (结果保留一位小数)[已知Q=cmΔt,设盐酸和NaOH溶液的密度为1 g/cm3,反应后混合溶液的比热容(c)为4.18 J/(g·℃)]。

(2)写出表示该反应中和热的热化学方程式(中和热为57.3kJ·mol-1):
(3)实验中改用60mL0.50mol•L-1盐酸与60mL0.55mol•L-1NaOH溶液进行反应,与上述实验相比,所放出的热量
(4)若三次平行操作测得数据中起始时盐酸与烧碱溶液平均温度相同,而终止温度与起始温度差(t2-t1)分别为①3.3℃、②3.5℃、③4.5℃,则最终代入计算式的温差平均值为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】已知:叠氮酸(NH3)是一元弱酸,弱酸电离时要吸热。某小组用 溶液和
溶液和 叠氮酸溶液测定中和反应的反应热,使用的简易量热计装置如图所示。
叠氮酸溶液测定中和反应的反应热,使用的简易量热计装置如图所示。

实验步骤:
步骤1:用一个量筒量取 叠氮酸溶液,打开杯盖,倒入量热计的内筒中,盖上杯盖,插入温度计,测量并记录叠氮酸溶液的温度。用水把温度计上的酸冲洗干净,擦干备用。
叠氮酸溶液,打开杯盖,倒入量热计的内筒中,盖上杯盖,插入温度计,测量并记录叠氮酸溶液的温度。用水把温度计上的酸冲洗干净,擦干备用。
步骤2:用另一个量筒量取 溶液,用温度计测量并记录KOH溶液的温度。
溶液,用温度计测量并记录KOH溶液的温度。
步骤3:打开杯盖,将量筒中的KOH溶液迅速一次性倒入量热计的内筒中,立即盖上杯盖,插入温度计,用环形玻璃搅拌棒匀速搅拌,密切关注温度变化,将最高温度记录为反应后混合溶液的终止温度。
通过三次平行实验测得反应前后体系的平均温度差为3.3℃。
已知:50mL溶液质量近似为50.0g,溶液的比热容 。
。
请回答下列问题:
(1)环形玻璃搅拌棒的操作方法是___________ ;如果用铜质搅拌棒替代,测得放出的热量会___________ (填“偏高”“偏低”或“无影响”)。
(2)上述操作中加入稍过量KOH溶液的目的是___________ ;如果KOH溶液过量较多,测得放出的热量会___________ (填“偏高”“偏低”或“无影响”)。
(3)步骤3中将KOH溶液迅速一次性加入的目的是___________ 。
(4)计算上述中和反应的中和热∆H=___________ kJ∙mol-1(结果保留一位小数)。
(5)已知利用强酸稀溶液和强碱稀溶液做实验测得的中和反应的中和热∆H=-57.3kJ∙mol-1。(4)中测得的中和热∆H___________ - 57.3kJ∙mol-1(填“大于”“小于”或“等于”),其原因是___________ (假设其他操作均正确)。
 溶液和
溶液和 叠氮酸溶液测定中和反应的反应热,使用的简易量热计装置如图所示。
叠氮酸溶液测定中和反应的反应热,使用的简易量热计装置如图所示。
实验步骤:
步骤1:用一个量筒量取
 叠氮酸溶液,打开杯盖,倒入量热计的内筒中,盖上杯盖,插入温度计,测量并记录叠氮酸溶液的温度。用水把温度计上的酸冲洗干净,擦干备用。
叠氮酸溶液,打开杯盖,倒入量热计的内筒中,盖上杯盖,插入温度计,测量并记录叠氮酸溶液的温度。用水把温度计上的酸冲洗干净,擦干备用。步骤2:用另一个量筒量取
 溶液,用温度计测量并记录KOH溶液的温度。
溶液,用温度计测量并记录KOH溶液的温度。步骤3:打开杯盖,将量筒中的KOH溶液迅速一次性倒入量热计的内筒中,立即盖上杯盖,插入温度计,用环形玻璃搅拌棒匀速搅拌,密切关注温度变化,将最高温度记录为反应后混合溶液的终止温度。
通过三次平行实验测得反应前后体系的平均温度差为3.3℃。
已知:50mL溶液质量近似为50.0g,溶液的比热容
 。
。请回答下列问题:
(1)环形玻璃搅拌棒的操作方法是
(2)上述操作中加入稍过量KOH溶液的目的是
(3)步骤3中将KOH溶液迅速一次性加入的目的是
(4)计算上述中和反应的中和热∆H=
(5)已知利用强酸稀溶液和强碱稀溶液做实验测得的中和反应的中和热∆H=-57.3kJ∙mol-1。(4)中测得的中和热∆H
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】中和热的测定是高中化学中重要的定量实验。取50mL、0.55mol/L的NaOH溶液与50mL、0.25mol/L的H2SO4溶液置于如图所示的装置中进行中和热的测定实验,回答下列问题:

(1)从如图所示实验装置看,其中尚缺少的一种玻璃用品是_____________ ,装置的一个明显错误是_______________________________________________ 。
(2)烧杯间填满碎纸条的作用是_____________________ 。
(3)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会________ ;(填“偏大”、“偏小”、“无影响”).
(4)倒入NaOH溶液的正确操作是__________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次性迅速倒入
(5)实验数据如下表:
①近似认为0.55mol/L NaOH溶液和0.25mol/L H2SO4溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g∙℃),则中和热∆H=__________ (取小数点后一位)。
②上述实验的结果与57.3kJ/mol有偏差,产生偏差的原因可能是____________ 。
A.实验装置保温、隔热效果差
B.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
C.做实验的当天室温较高
D.量取H2SO4时仰视读数

(1)从如图所示实验装置看,其中尚缺少的一种玻璃用品是
(2)烧杯间填满碎纸条的作用是
(3)用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会
(4)倒入NaOH溶液的正确操作是
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次性迅速倒入
(5)实验数据如下表:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
②上述实验的结果与57.3kJ/mol有偏差,产生偏差的原因可能是
A.实验装置保温、隔热效果差
B.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
C.做实验的当天室温较高
D.量取H2SO4时仰视读数
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】某学生用12 mol·L-1的浓盐酸配制0.10 mol·L-1的稀盐酸500 mL。可供选择的仪器有:①玻璃棒、②烧瓶、③烧杯、④胶头滴管、⑤量筒、⑥500 mL容量瓶
回答下列问题:
(1)计算量取浓盐酸的体积为____ mL
(2)配制过程中,一定用不到的仪器是________ (填序号)
(3)将浓盐酸加入适量蒸馏水稀释后,全部转移到500 mL容量瓶中,转移过程中玻璃棒的作用是____ 。转移完毕,用少量蒸馏水洗涤仪器2~3次,并将洗涤液全部转移到容量瓶中。然后缓缓地把蒸馏水直接注入容量瓶,直到液面接近刻度线1-2cm处。改用______ 滴加蒸馏水,使溶液的凹液面的最低处与刻度线相切。振荡、摇匀后,装瓶、贴签。
(4)在配制过程中,其他操作都准确,下列操作对所配溶液浓度的影响(填“偏高”、“偏低”或“无影响”)
①定容时,加蒸馏水超过刻度线,又用胶头滴管吸出重新加水至刻度线_______
②转移前,容量瓶中含有少量蒸馏水_________
回答下列问题:
(1)计算量取浓盐酸的体积为
(2)配制过程中,一定用不到的仪器是
(3)将浓盐酸加入适量蒸馏水稀释后,全部转移到500 mL容量瓶中,转移过程中玻璃棒的作用是
(4)在配制过程中,其他操作都准确,下列操作对所配溶液浓度的影响(填“偏高”、“偏低”或“无影响”)
①定容时,加蒸馏水超过刻度线,又用胶头滴管吸出重新加水至刻度线
②转移前,容量瓶中含有少量蒸馏水
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】为实现工业含铝、铁、铜合金(假定其余杂质与酸碱都不反应)废料的再利用,某化学兴趣小组设计了如下回收利用方案:
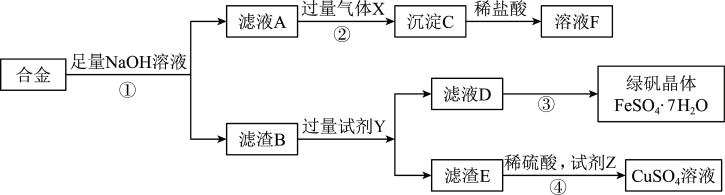
回答下列问题:
(1)合金与NaOH溶液反应的化学方程式为___________ ;操作①为___________ 。
(2)气体X为___________ ;②中发生反应的离子方程式为___________ 。
(3)试剂Y为___________ ,若要从滤液D得到绿矾晶体,步骤③的实验操作有:___________ 、___________ 、过滤、洗涤、干燥。
(4)若试剂Z是H2O2溶液,④中发生反应的化学方程式为___________ 。
(5)为配制250mL0.2mol/L的FeSO4溶液,需称量绿矾晶体质量为___________ g,配制该溶液用到的玻璃仪器除量筒、烧杯、玻璃棒外,还需要___________ 。下列操作会导致所配溶液浓度偏高的是___________ (填字母)。
A.所称取的晶体失去了部分结晶水B.转移溶液前容量瓶中存在少量蒸馏水
C.定容前未洗涤烧杯和玻璃棒D.定容时俯视容量瓶刻度线

回答下列问题:
(1)合金与NaOH溶液反应的化学方程式为
(2)气体X为
(3)试剂Y为
(4)若试剂Z是H2O2溶液,④中发生反应的化学方程式为
(5)为配制250mL0.2mol/L的FeSO4溶液,需称量绿矾晶体质量为
A.所称取的晶体失去了部分结晶水B.转移溶液前容量瓶中存在少量蒸馏水
C.定容前未洗涤烧杯和玻璃棒D.定容时俯视容量瓶刻度线
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】现用质量分数为98%、密度为 的浓H2SO4来配制
的浓H2SO4来配制 、
、 的稀H2SO4。可供选择的仪器有:①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒⑥容量瓶⑦药匙。请回答下列问题:
的稀H2SO4。可供选择的仪器有:①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒⑥容量瓶⑦药匙。请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有_______ (填代号)。
(2)将浓H2SO4加适量蒸馏水稀释后,冷却片刻,随后全部转移到_______ mL的容量瓶中,转移时应用玻璃棒_______ 。转移完毕,用少量蒸馏水洗涤_______ 2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀。然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度_______ 处。改用_______ 加蒸馏水到瓶颈刻度的地方,使溶液的_______ 。振荡、摇匀后,装瓶、贴签。
(3)在配制过程中,其他操作都准确,下列操作中:错误的是_______
①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
②将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
③定容时,加蒸馏水超过标线,又用胶头滴管吸出
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,俯视标线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
 的浓H2SO4来配制
的浓H2SO4来配制 、
、 的稀H2SO4。可供选择的仪器有:①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒⑥容量瓶⑦药匙。请回答下列问题:
的稀H2SO4。可供选择的仪器有:①玻璃棒②烧瓶③烧杯④胶头滴管⑤量筒⑥容量瓶⑦药匙。请回答下列问题:(1)上述仪器中,在配制稀H2SO4时用不到的有
(2)将浓H2SO4加适量蒸馏水稀释后,冷却片刻,随后全部转移到
(3)在配制过程中,其他操作都准确,下列操作中:错误的是
①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
②将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
③定容时,加蒸馏水超过标线,又用胶头滴管吸出
④转移前,容量瓶中含有少量蒸馏水
⑤定容时,俯视标线
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
您最近一年使用:0次



