草酸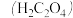 溶液与酸性
溶液与酸性 溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】 溶液氧化
溶液氧化 的反应历程为:
的反应历程为:
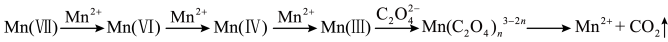
【提出假设】假设1:该反应为放热
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是______ 。
【设计、完成实验】
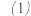 称取
称取______ g草酸晶体 ,配置500mL
,配置500mL
 溶液。
溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和______ 。
②下列操作会使所配溶液浓度偏低的是______  填下列选项的字母序号
填下列选项的字母序号 。
。
A 称取草酸晶体时,将草酸晶体放在托盘天平右盘
B 定容时俯视刻度线
C 将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D 摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
 完成探究,记录数据
完成探究,记录数据
则
______ ,假设______ 成立。
 由于
由于 能氧化水中有机物等因素,配置好稳定的
能氧化水中有机物等因素,配置好稳定的 溶液,其浓度需标定.取
溶液,其浓度需标定.取

 溶液于锥形瓶中,加入10mL
溶液于锥形瓶中,加入10mL 稀硫酸,用
稀硫酸,用 中
中 溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗
溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗 溶液
溶液 ,则草酸溶液与酸性
,则草酸溶液与酸性 溶液反应的离子方程式为:
溶液反应的离子方程式为:______ ,上述实验中 溶液的物质的量浓度为
溶液的物质的量浓度为______ 。
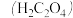 溶液与酸性
溶液与酸性 溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:【查阅资料】
 溶液氧化
溶液氧化 的反应历程为:
的反应历程为: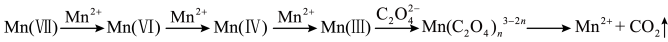
【提出假设】假设1:该反应为放热
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是
【设计、完成实验】
 称取
称取 ,配置500mL
,配置500mL
 溶液。
溶液。①在上述过程中必须用到的2种定量仪器是托盘天平和
②下列操作会使所配溶液浓度偏低的是
 填下列选项的字母序号
填下列选项的字母序号 。
。A 称取草酸晶体时,将草酸晶体放在托盘天平右盘
B 定容时俯视刻度线
C 将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
D 摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容
 完成探究,记录数据
完成探究,记录数据| 实验 编号 | 烧杯中所加试剂及用量 | 控制条件 | 溶液褪 色时间  | |||
  溶液 溶液 | 等浓度 溶液 溶液 |  |  稀硫酸 | |||
| 1 | 30 | 20 | 30 | 20 | 18 | |
| 2 | 30 | 20 | 30 | 20 | 水浴控制温度 | 15 |
| 3 | 30 | 20 | 30 | 20 | 加入少量 固体 固体 |  |
| 4 | 30 | 20 | x | 20 | 加入5mL  溶液 溶液 | 18 |

 由于
由于 能氧化水中有机物等因素,配置好稳定的
能氧化水中有机物等因素,配置好稳定的 溶液,其浓度需标定.取
溶液,其浓度需标定.取

 溶液于锥形瓶中,加入10mL
溶液于锥形瓶中,加入10mL 稀硫酸,用
稀硫酸,用 中
中 溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗
溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗 溶液
溶液 ,则草酸溶液与酸性
,则草酸溶液与酸性 溶液反应的离子方程式为:
溶液反应的离子方程式为: 溶液的物质的量浓度为
溶液的物质的量浓度为
更新时间:2020-02-09 18:22:55
|
相似题推荐
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】聚丙烯简称PP,是一种应用非常广泛的有机合成高分子材料,其单体丙烯可以通过丙烷催化剂脱氢制备。
已知:

(1)
___________ 0(填“>”、“<”或“=”),该反应在___________ (填“高温”或“低温”)更容易自发进行。
(2)已知 、
、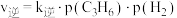 ,其中
,其中 、
、 为速率常数。
为速率常数。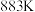 ,
, 时,
时,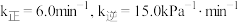 ,在容器中投入一定量的
,在容器中投入一定量的 ,反应达到平衡时,
,反应达到平衡时,
___________ 。( )
)
(3)已知速率常数k与温度T的关系可表示为: 。其中
。其中 为反应活化能,
为反应活化能,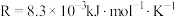 ,A为常数。
,A为常数。
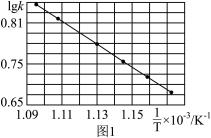
①丙烷脱氢速率常数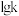 与
与 的图像如图1所示,则可通过斜率计算
的图像如图1所示,则可通过斜率计算___________ 。
②800K时,其他条件不变,使用某催化剂使丙烷脱氢反应的总活化能降低了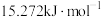 ,则反应速率变为原来的
,则反应速率变为原来的___________ 倍。
③若催化剂能降低相同的活化能,当温度越___________ (填“高”或“低”)时, 越大。
越大。
(4)“丙烷催化脱氢膜反应器”的原理如图2所示。在一定压强下,该装置采用___________ 措施提高了 的转化率。
的转化率。

(5)丙烷催化氧化也是制备丙烯的常见方法,下图为两种催化剂(甲采用碳基催化剂,乙采用钒系催化剂)催化氧化丙烷的机理。
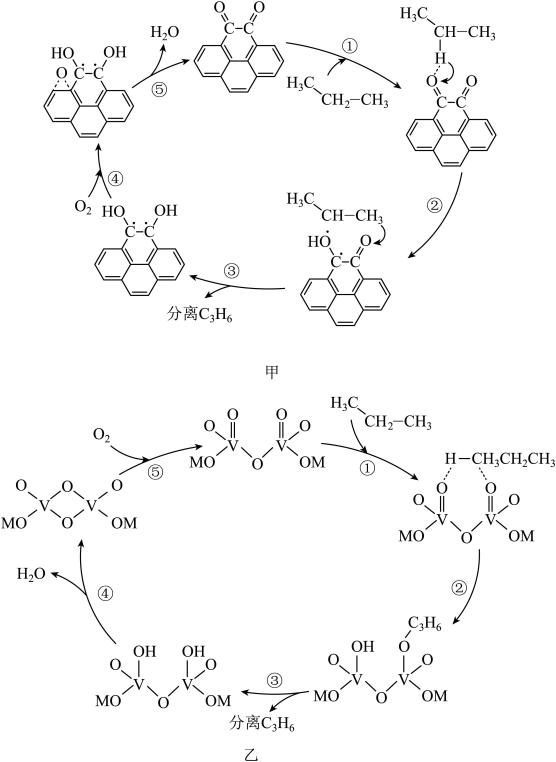
下列说法正确的是___________。
已知:


(1)

(2)已知
 、
、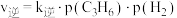 ,其中
,其中 、
、 为速率常数。
为速率常数。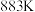 ,
, 时,
时,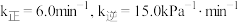 ,在容器中投入一定量的
,在容器中投入一定量的 ,反应达到平衡时,
,反应达到平衡时,
 )
)(3)已知速率常数k与温度T的关系可表示为:
 。其中
。其中 为反应活化能,
为反应活化能,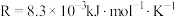 ,A为常数。
,A为常数。①丙烷脱氢速率常数
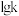 与
与 的图像如图1所示,则可通过斜率计算
的图像如图1所示,则可通过斜率计算
②800K时,其他条件不变,使用某催化剂使丙烷脱氢反应的总活化能降低了
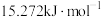 ,则反应速率变为原来的
,则反应速率变为原来的③若催化剂能降低相同的活化能,当温度越
 越大。
越大。(4)“丙烷催化脱氢膜反应器”的原理如图2所示。在一定压强下,该装置采用
 的转化率。
的转化率。
(5)丙烷催化氧化也是制备丙烯的常见方法,下图为两种催化剂(甲采用碳基催化剂,乙采用钒系催化剂)催化氧化丙烷的机理。

下列说法正确的是___________。
| A.每步反应都是氧化还原反应 |
| B.两种催化剂都可防止丙烯进一步被氧化 |
| C.碳基催化剂的活性温度低 |
D.若用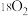 参与反应,最终两种催化剂中都含有 参与反应,最终两种催化剂中都含有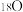 |
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】甲烷是一种清洁燃料,与水制氢和天然气脱硫具有重要的现实意义。回答下列问题:
Ⅰ.一定条件下,甲烷和水蒸气催化制氢主要有如下两个反应:
①
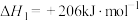
②
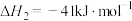
恒定压强为100kPa时,将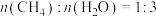 的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如图所示。
的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如图所示。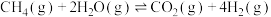

______  ,反应在
,反应在______ 条件下能自发进行。
(2)600℃时, 的平衡分压为
的平衡分压为______ kPa,反应②的物质的量分数的平衡常数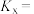
______ (用物质的量分数代替平衡浓度计算,保留2位有效数字)。
(3)系统中q的含量在700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:______ 。
Ⅱ.H2S与 重整,不但可以消除污染,还可以制氢。主要反应如下:
重整,不但可以消除污染,还可以制氢。主要反应如下: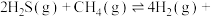
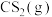
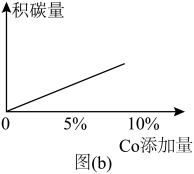
 。在研究反应发生的适宜条件时,Co助剂有稳定催化剂的作用。
。在研究反应发生的适宜条件时,Co助剂有稳定催化剂的作用。
(4)图(a)为800℃、 催化剂条件下投入等量
催化剂条件下投入等量 ,不同投料比分别达到平衡时
,不同投料比分别达到平衡时 转化率、平均反应速率图。C组图像中平均速率最低的原因可能是
转化率、平均反应速率图。C组图像中平均速率最低的原因可能是______ ;相同质量的同种催化剂,在载体上的分散度越高,催化作用越强,原因是______ 。______ 反应(填化学方程式)。
Ⅰ.一定条件下,甲烷和水蒸气催化制氢主要有如下两个反应:
①

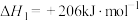
②

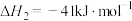
恒定压强为100kPa时,将
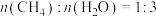 的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如图所示。
的混合气体投入反应器中,平衡时,各组分的物质的量分数与温度的关系如图所示。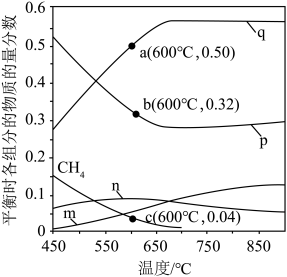
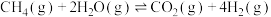

 ,反应在
,反应在(2)600℃时,
 的平衡分压为
的平衡分压为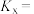
(3)系统中q的含量在700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:
Ⅱ.H2S与
 重整,不但可以消除污染,还可以制氢。主要反应如下:
重整,不但可以消除污染,还可以制氢。主要反应如下: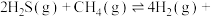
 。在研究反应发生的适宜条件时,Co助剂有稳定催化剂的作用。
。在研究反应发生的适宜条件时,Co助剂有稳定催化剂的作用。(4)图(a)为800℃、
 催化剂条件下投入等量
催化剂条件下投入等量 ,不同投料比分别达到平衡时
,不同投料比分别达到平衡时 转化率、平均反应速率图。C组图像中平均速率最低的原因可能是
转化率、平均反应速率图。C组图像中平均速率最低的原因可能是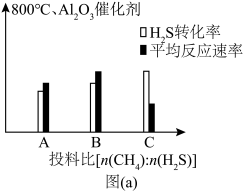
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】国家主席习近平在联合国大会上表示:“中国将争取在2060年前实现碳中和”。
(1)CO2催化加氢制有机物是实现“碳中和”的重要途径。高效催化剂对CO2加氢制甲醇的反应速率影响很大。下图是CO2加氢制甲醇在不同催化条件下两种反应路径的势能图。

①CO2加氢制甲醇的热化学方程式为 ΔH=
ΔH=_______ eV/mol(阿伏加德罗常数用NA表示)。
②由图中信息可知,_______ (填“甲酸盐”或“羧酸”)路径的活化能更大,不利于反应的进行。中间体的稳定性HCOO*_______ COOH*(填“>”、“<”或“=”)。
③下列方法中能提高CO2平衡转化率的是_______
a.升高温度 b.恒压充入氦气 c.恒容充入H2 d.减小反应容器体积 e.选用合适的催化剂
(2)CO2催化加氢制甲醇过程中存在竞争反应: 。在压强为p的恒温恒压密闭容器中,加入1molCO2和3molH2反应并达到平衡状态,CO2平衡转化率为40%,甲醇的选择性为50%(甲醇的选择性
。在压强为p的恒温恒压密闭容器中,加入1molCO2和3molH2反应并达到平衡状态,CO2平衡转化率为40%,甲醇的选择性为50%(甲醇的选择性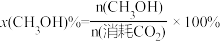 ),计算
),计算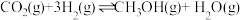 在该温度下的平衡常数Kp=
在该温度下的平衡常数Kp=_______ (列出计算式)。
(3)CO2催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图中直线a所示,已知Arrhenius经验公式为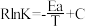 (a为活化能,k为速率常数,R、C为常数)。
(a为活化能,k为速率常数,R、C为常数)。
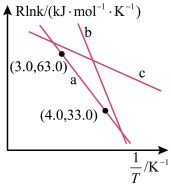
①该反应的活化能Ea=_______ kJ/mol。
②直线_______ (填“b”或“c”)表示使用更高效的催化剂时,Rlnk与 的关系。
的关系。
(1)CO2催化加氢制有机物是实现“碳中和”的重要途径。高效催化剂对CO2加氢制甲醇的反应速率影响很大。下图是CO2加氢制甲醇在不同催化条件下两种反应路径的势能图。

①CO2加氢制甲醇的热化学方程式为
 ΔH=
ΔH=②由图中信息可知,
③下列方法中能提高CO2平衡转化率的是
a.升高温度 b.恒压充入氦气 c.恒容充入H2 d.减小反应容器体积 e.选用合适的催化剂
(2)CO2催化加氢制甲醇过程中存在竞争反应:
 。在压强为p的恒温恒压密闭容器中,加入1molCO2和3molH2反应并达到平衡状态,CO2平衡转化率为40%,甲醇的选择性为50%(甲醇的选择性
。在压强为p的恒温恒压密闭容器中,加入1molCO2和3molH2反应并达到平衡状态,CO2平衡转化率为40%,甲醇的选择性为50%(甲醇的选择性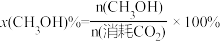 ),计算
),计算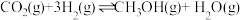 在该温度下的平衡常数Kp=
在该温度下的平衡常数Kp=(3)CO2催化加氢制甲醇反应历程中某一步基元反应的Arthenius经验公式的实验数据如图中直线a所示,已知Arrhenius经验公式为
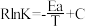 (a为活化能,k为速率常数,R、C为常数)。
(a为活化能,k为速率常数,R、C为常数)。
①该反应的活化能Ea=
②直线
 的关系。
的关系。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】碲 广泛应用于冶金、航空航天、电子等领域。从精炼钢的阳极泥中(主要成分为
广泛应用于冶金、航空航天、电子等领域。从精炼钢的阳极泥中(主要成分为 ,还含有金、铂等)回收碲的工艺流程如下:
,还含有金、铂等)回收碲的工艺流程如下:
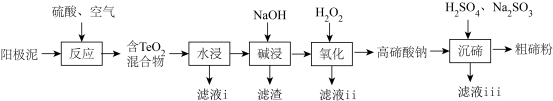
已知: 有强还原性,且
有强还原性,且 、
、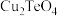 难溶于水;高碲酸钠的化学式:
难溶于水;高碲酸钠的化学式:
回答下列问题:
(1)基态 原子的价电子排布式为
原子的价电子排布式为___________ 。
(2) 的键角大于
的键角大于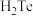 ,原因是
,原因是___________ 。
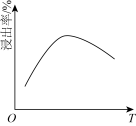
(3)滤液i的主要成分是___________ (写化学式)。滤液i中溶质的浸出率与温度关系如图所示,解释溶质的浸出率随温度变化的可能原因___________ 。
(4)“沉碲”过程中发生反应的离子方程式为___________ 。
(5)粗粉中确质量分数的测定步骤如下:取mg粗粉,加入酸使其转化为亚碲酸 ,配制成100mL溶液,取25.00mL于锥形瓶中。向锥形瓶中加入
,配制成100mL溶液,取25.00mL于锥形瓶中。向锥形瓶中加入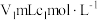 酸性
酸性 溶液,充分反应使亚碎酸转化为碲酸
溶液,充分反应使亚碎酸转化为碲酸 。用
。用 硫酸亚铁铵
硫酸亚铁铵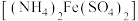 标准溶液滴定剩余的酸性
标准溶液滴定剩余的酸性 溶液,消耗
溶液,消耗 硫酸亚铁铵标准溶液。该粗碲粉中确的质量分数为
硫酸亚铁铵标准溶液。该粗碲粉中确的质量分数为___________ ;若硫酸亚铁铵溶液使用之前部分被氧化,则测定结果___________ (填“偏高”或“偏低”)
 广泛应用于冶金、航空航天、电子等领域。从精炼钢的阳极泥中(主要成分为
广泛应用于冶金、航空航天、电子等领域。从精炼钢的阳极泥中(主要成分为 ,还含有金、铂等)回收碲的工艺流程如下:
,还含有金、铂等)回收碲的工艺流程如下:
已知:
 有强还原性,且
有强还原性,且 、
、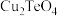 难溶于水;高碲酸钠的化学式:
难溶于水;高碲酸钠的化学式:
回答下列问题:
(1)基态
 原子的价电子排布式为
原子的价电子排布式为(2)
 的键角大于
的键角大于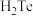 ,原因是
,原因是(3)滤液i的主要成分是

(4)“沉碲”过程中发生反应的离子方程式为
(5)粗粉中确质量分数的测定步骤如下:取mg粗粉,加入酸使其转化为亚碲酸
 ,配制成100mL溶液,取25.00mL于锥形瓶中。向锥形瓶中加入
,配制成100mL溶液,取25.00mL于锥形瓶中。向锥形瓶中加入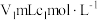 酸性
酸性 溶液,充分反应使亚碎酸转化为碲酸
溶液,充分反应使亚碎酸转化为碲酸 。用
。用 硫酸亚铁铵
硫酸亚铁铵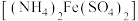 标准溶液滴定剩余的酸性
标准溶液滴定剩余的酸性 溶液,消耗
溶液,消耗 硫酸亚铁铵标准溶液。该粗碲粉中确的质量分数为
硫酸亚铁铵标准溶液。该粗碲粉中确的质量分数为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】含硫化合物,不仅用于研究化学反应的原理,也在生产生活有普遍应用。
(1)以反应 为例,探究外界条件对化学反应速率的影响,实验方案如下表所示。
为例,探究外界条件对化学反应速率的影响,实验方案如下表所示。
请回答:①上表中,a为_______ ,b为_______ 。
②上述三个实验中的反应速率最快的应该是实验_______ (用I、II、III作答)
(2)亚硫酸钠是一种常见的食品添加剂。为检验某食品中亚硫酸钠含量(通常以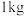 样品中含
样品中含 的质量计),某研究小组同学设计了如下实验方案。
的质量计),某研究小组同学设计了如下实验方案。
I.称取样品 ;
;
II.向样品中加入足量稀硫酸;
III.将I中产生的 用足量
用足量 溶液吸收;
溶液吸收;
IV.将II所得硫酸溶液用氢氧化钠标准液滴定;
V.数据处理。
① 是一种食品添加剂。写出
是一种食品添加剂。写出 与稀硫酸反应的离子方程式
与稀硫酸反应的离子方程式_______ 。
②步骤III中 的作用是
的作用是_______ 。
③步骤IV中可选用的指示剂为_______ 。下图显示滴定终点时,滴定管(量程为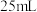 )读数为
)读数为_______  。
。

④步骤IV中消耗 溶液
溶液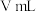 ,则
,则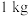 样品中含
样品中含 的质量是
的质量是_______ g(用含W、V的代数式表示)。
⑤步骤IV中的下列操作会造成该实验亚硫酸盐含量测定结果偏低的有_______ 。
a.滴定开始读数时仰视读数
b.装入氢氧化钠标准液前,碱式滴定管未用氢氧化钠标准液润洗
c.锥形瓶内用水冲洗后未干燥
d.在滴定过程中发现局部溶液发生色变就立即停止滴定
(1)以反应
 为例,探究外界条件对化学反应速率的影响,实验方案如下表所示。
为例,探究外界条件对化学反应速率的影响,实验方案如下表所示。| 实验序号 |  溶液 溶液 |  溶液 溶液 | 蒸馏水 | 温度/℃ | ||
浓度/( ) ) | 体积/mL | 浓度/( ) ) | 体积/mL | 体积/mL | ||
| I | 0.1 | 1.5 | 0.1 | 1.5 | 10 | 20 |
| II | 0.1 | 2.5 | 0.1 | 1.5 | 9 | a |
| III | 0.1 | b | 0.1 | 1.5 | 9 | 30 |
②上述三个实验中的反应速率最快的应该是实验
(2)亚硫酸钠是一种常见的食品添加剂。为检验某食品中亚硫酸钠含量(通常以
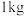 样品中含
样品中含 的质量计),某研究小组同学设计了如下实验方案。
的质量计),某研究小组同学设计了如下实验方案。I.称取样品
 ;
;II.向样品中加入足量稀硫酸;
III.将I中产生的
 用足量
用足量 溶液吸收;
溶液吸收;IV.将II所得硫酸溶液用氢氧化钠标准液滴定;
V.数据处理。
①
 是一种食品添加剂。写出
是一种食品添加剂。写出 与稀硫酸反应的离子方程式
与稀硫酸反应的离子方程式②步骤III中
 的作用是
的作用是③步骤IV中可选用的指示剂为
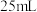 )读数为
)读数为 。
。
④步骤IV中消耗
 溶液
溶液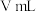 ,则
,则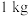 样品中含
样品中含 的质量是
的质量是⑤步骤IV中的下列操作会造成该实验亚硫酸盐含量测定结果偏低的有
a.滴定开始读数时仰视读数
b.装入氢氧化钠标准液前,碱式滴定管未用氢氧化钠标准液润洗
c.锥形瓶内用水冲洗后未干燥
d.在滴定过程中发现局部溶液发生色变就立即停止滴定
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】KI可用于分析试剂、感光材料、制药等,其制备原理如下:
反应I:
反应Ⅱ: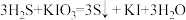
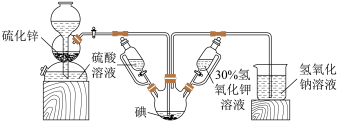
请回答有关问题。
(1)装置中盛装30%氢氧化钾溶液的仪器名称是___________ 。
(2)关闭启普发生器活塞,先滴入30%的KOH溶液。待观察到三颈烧瓶中溶液颜色由棕黄色变为___________ (填现象),停止滴入KOH溶液;然后打开启普发生器活塞,待___________ (描述现象)时停止通气。
(3)滴入硫酸溶液,并对三颈烧瓶中的溶液进行水浴加热,其目的是___________ 。
(4)把三颈烧瓶中的溶液倒入烧杯中,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还含有单质硫和___________ (填名称)。合并滤液和洗涤液,蒸发至析出结晶,干燥得成品。
(5)碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KIO3用于加碘盐中。实验室模拟工业制备KIO3流程如下:
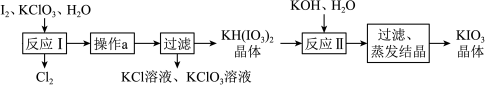
几种物质的溶解度见下表:
①由上表数据分析可知,“操作a”为___________ 。
②反应I中,两种还原产物得电子数相等,请写出发生的化学反应方程式___________ 。
(6)某同学测定上述流程生产的KIO3样品的纯度。
取1.00g样品溶于蒸馏水中并用硫酸酸化,再加入过量的KI和少量的淀粉溶液,逐滴滴加2.0 mol/LNa2S2O3溶液,恰好完全反应时共消耗12.60mLNa2S2O3溶液。该样品中KIO3的质量分数为___________ (已知反应: )。
)。
反应I:

反应Ⅱ:
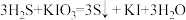

请回答有关问题。
(1)装置中盛装30%氢氧化钾溶液的仪器名称是
(2)关闭启普发生器活塞,先滴入30%的KOH溶液。待观察到三颈烧瓶中溶液颜色由棕黄色变为
(3)滴入硫酸溶液,并对三颈烧瓶中的溶液进行水浴加热,其目的是
(4)把三颈烧瓶中的溶液倒入烧杯中,加入碳酸钡,在过滤器中过滤,过滤得到的沉淀中除含有过量碳酸钡外,还含有单质硫和
(5)碘被称为“智力元素”,科学合理地补充碘可防治碘缺乏病,KIO3用于加碘盐中。实验室模拟工业制备KIO3流程如下:

几种物质的溶解度见下表:
| KCl | KH(IO3)2 | KClO3 | |
| 25℃时的溶解度 | 20.8 | 0.8 | 7.5 |
| 80℃时的溶解度 | 37.1 | 12.4 | 16.2 |
②反应I中,两种还原产物得电子数相等,请写出发生的化学反应方程式
(6)某同学测定上述流程生产的KIO3样品的纯度。
取1.00g样品溶于蒸馏水中并用硫酸酸化,再加入过量的KI和少量的淀粉溶液,逐滴滴加2.0 mol/LNa2S2O3溶液,恰好完全反应时共消耗12.60mLNa2S2O3溶液。该样品中KIO3的质量分数为
 )。
)。
您最近一年使用:0次



