我国《食品添加剂使用卫生标准》中规定葡萄酒中SO2最大使用量为0.25g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中的SO2,并对其含量进行测定。
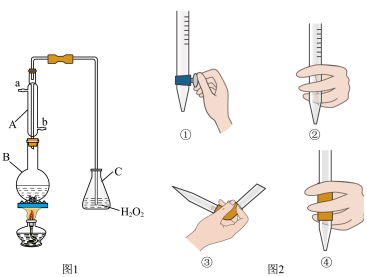
(1)仪器B的名称是__________ ,冷却水的进口为________ 。(填“a”或“b”)
(2)B中加入300.00mL葡萄酒和适量硫酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为______________________________________________ 。
(3)除去C中过量的H2O2,然后用0.1000mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的________ ;若选择酚酞为指示剂,则滴定终点的现象为_____________________ ;
(4)经3次平行实验,消耗NaOH溶液体积如下:
该葡萄酒中SO2含量为______________ g·L-1(保留两位小数)。

(1)仪器B的名称是
(2)B中加入300.00mL葡萄酒和适量硫酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为
(3)除去C中过量的H2O2,然后用0.1000mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的
(4)经3次平行实验,消耗NaOH溶液体积如下:
| 序号 | 滴定前读数 | 滴定后读数 |
| 1 | 0.00 | 20.01 |
| 2 | 1.00 | 20.99 |
| 3 | 0.00 | 21.10 |
更新时间:2020-03-17 09:25:23
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】H2C2O4·2H2O是一种无色晶体,在实验室常用作络合剂、掩蔽剂、沉淀剂、还原剂以及用于校准高锰酸钾标准溶液等。
回答下列问题:
(1)实验室需配制0.1 mol·L-1的H2C2O4溶液250 mL。若用H2C2O4·2H2O配制,需用托盘天平称量H2C2O4·2H2O质量为_______ g;若用H2C2O4溶液稀释配制,需量取2 mol·L-1的H2C2O4溶液的体积为_________ mL。
(2)用H2C2O4·2H2O配制时,涉及称量、溶解、溶液转移、定容等操作。
①下列图示对应的操作规范的是___________ (填字母,下同)。
A.称量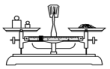 B.溶解
B.溶解 C.转移溶液
C.转移溶液 D.定容
D.定容 
②下列操作会导致配得的溶液浓度偏高的是___________ 。
A.所用的H2C2O4·2H2O晶体中含有少量无水的H2C2O4
B.溶解时,洗涤烧杯及玻璃棒的溶液未转移到容量瓶中
C.定容时,视线如图所示:
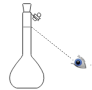
D.摇匀后发现液面低于刻度线,用胶头滴管滴加水到刻度线处
(3)利用反应5H2C2O4+3H2SO4+2KMnO4=K2SO4+2MnSO4+8H2O+10CO2↑可校准KMnO4标准溶液。精确称取0.7875 g H2C2O4·2H2O,加入适量稀硫酸,然后向其中滴入KMnO4溶液,消耗KMnO4溶液50.00 mL,则KMnO4溶液的物质的量浓度为___________ 。
回答下列问题:
(1)实验室需配制0.1 mol·L-1的H2C2O4溶液250 mL。若用H2C2O4·2H2O配制,需用托盘天平称量H2C2O4·2H2O质量为
(2)用H2C2O4·2H2O配制时,涉及称量、溶解、溶液转移、定容等操作。
①下列图示对应的操作规范的是
A.称量
 B.溶解
B.溶解 C.转移溶液
C.转移溶液 D.定容
D.定容 
②下列操作会导致配得的溶液浓度偏高的是
A.所用的H2C2O4·2H2O晶体中含有少量无水的H2C2O4
B.溶解时,洗涤烧杯及玻璃棒的溶液未转移到容量瓶中
C.定容时,视线如图所示:

D.摇匀后发现液面低于刻度线,用胶头滴管滴加水到刻度线处
(3)利用反应5H2C2O4+3H2SO4+2KMnO4=K2SO4+2MnSO4+8H2O+10CO2↑可校准KMnO4标准溶液。精确称取0.7875 g H2C2O4·2H2O,加入适量稀硫酸,然后向其中滴入KMnO4溶液,消耗KMnO4溶液50.00 mL,则KMnO4溶液的物质的量浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】[Co( NH3)6]Cl3(三氯六氨合钴)是一种重要的化工产品,实验室制备过程如下:
①将一定量的氯化铵和浓氨水置于锥形瓶中,混合均匀;
②分批加入氯化钴粉末,边加边搅拌,直至溶液呈棕色稀浆;
③再向其中滴加30%H2O2,当固体完全溶解后,慢慢加入浓盐酸加热10~15min;
④在室温下冷却,过滤,可得到橙黄色[Co(NH3)6]Cl3晶体。
(1)[ Co( NH3)6]Cl3中Co的化合价是__________ ,该配合物中心离子的核外电子排布式为_______ 。
(2)“加热”应控温在60°C进行,控温方式可采取_____________________ ,温度不宜过高的原因是___________ 。
(3)溶液中CoCl2、NH4Cl和浓氨水混合后与H2O2溶液反应生成[ Co(NH3)6]Cl3的化学方程式是_________ 。
(4)加入浓盐酸的作用是____________________________ 。
(5)沉淀滴定法测定产品中Cl-的质量分数:
i.准确称取mg的产品,配制成100mL溶液,移取20mL于锥形瓶中;.
ii.滴加几滴K2CrO4溶液为指示剂,用c mol· L-1AgNO3溶液滴定至终点;
iii.重复滴定三次,消耗AgNO3溶液体积的平均值为VmL,计算晶体中Cl-的质量分数。
已知溶解度:AgCl 1.3×10-6mol · L-1,Ag2CrO4(砖红色)6.5×10-5mol ·L-1
①ii中,滴定至终点的现象是____________________ 。
②制备的晶体中Cl-的质量分数是_________ (列计算式即可)。
①将一定量的氯化铵和浓氨水置于锥形瓶中,混合均匀;
②分批加入氯化钴粉末,边加边搅拌,直至溶液呈棕色稀浆;
③再向其中滴加30%H2O2,当固体完全溶解后,慢慢加入浓盐酸加热10~15min;
④在室温下冷却,过滤,可得到橙黄色[Co(NH3)6]Cl3晶体。
(1)[ Co( NH3)6]Cl3中Co的化合价是
(2)“加热”应控温在60°C进行,控温方式可采取
(3)溶液中CoCl2、NH4Cl和浓氨水混合后与H2O2溶液反应生成[ Co(NH3)6]Cl3的化学方程式是
(4)加入浓盐酸的作用是
(5)沉淀滴定法测定产品中Cl-的质量分数:
i.准确称取mg的产品,配制成100mL溶液,移取20mL于锥形瓶中;.
ii.滴加几滴K2CrO4溶液为指示剂,用c mol· L-1AgNO3溶液滴定至终点;
iii.重复滴定三次,消耗AgNO3溶液体积的平均值为VmL,计算晶体中Cl-的质量分数。
已知溶解度:AgCl 1.3×10-6mol · L-1,Ag2CrO4(砖红色)6.5×10-5mol ·L-1
①ii中,滴定至终点的现象是
②制备的晶体中Cl-的质量分数是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】学习小组以锡和氯气为原料制备 并探究其水解产物的组成。
并探究其水解产物的组成。 制备装置如下图,请回答下列问题:
制备装置如下图,请回答下列问题:

已知: 熔点为
熔点为 ℃,沸点为114℃,是无色发烟液体,极易水解。
℃,沸点为114℃,是无色发烟液体,极易水解。
(1)装置D中热源仪器名称为___________ ,装置F中球形干燥管的试剂为___________ 。
(2)装置A中实验室制取氯气的化学方程式为___________ 。
(3)装置B中的试剂为饱和食盐水,若去掉装置B,有什么影响?___________ 。
(4) 在碱中水解可得白色胶状沉淀
在碱中水解可得白色胶状沉淀 锡酸,
锡酸, 锡酸在母液中静置或加热就转变为
锡酸在母液中静置或加热就转变为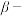 锡酸,可表示为
锡酸,可表示为 。现称取
。现称取 纯净的
纯净的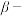 锡酸,在惰性氛围中加热得到氧化物
锡酸,在惰性氛围中加热得到氧化物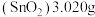 ,则
,则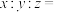
___________ 。
(5)制得的产品中含有少量 ,现对产品纯度进行测定:取0.800产品溶于足量稀盐酸中,加入淀粉溶液作指示剂,用
,现对产品纯度进行测定:取0.800产品溶于足量稀盐酸中,加入淀粉溶液作指示剂,用 的碘酸钾标准溶液滴定至终点,消耗标准溶液
的碘酸钾标准溶液滴定至终点,消耗标准溶液 。
。
①滴定原理如下,请完成反应ⅰ的离子方程式。
i.___________ 。
ii.
②滴定终点的现象是___________ 。
③产品的纯度为___________ %(保留一位小数)。
 并探究其水解产物的组成。
并探究其水解产物的组成。 制备装置如下图,请回答下列问题:
制备装置如下图,请回答下列问题:
已知:
 熔点为
熔点为 ℃,沸点为114℃,是无色发烟液体,极易水解。
℃,沸点为114℃,是无色发烟液体,极易水解。(1)装置D中热源仪器名称为
(2)装置A中实验室制取氯气的化学方程式为
(3)装置B中的试剂为饱和食盐水,若去掉装置B,有什么影响?
(4)
 在碱中水解可得白色胶状沉淀
在碱中水解可得白色胶状沉淀 锡酸,
锡酸, 锡酸在母液中静置或加热就转变为
锡酸在母液中静置或加热就转变为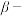 锡酸,可表示为
锡酸,可表示为 。现称取
。现称取 纯净的
纯净的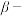 锡酸,在惰性氛围中加热得到氧化物
锡酸,在惰性氛围中加热得到氧化物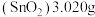 ,则
,则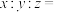
(5)制得的产品中含有少量
 ,现对产品纯度进行测定:取0.800产品溶于足量稀盐酸中,加入淀粉溶液作指示剂,用
,现对产品纯度进行测定:取0.800产品溶于足量稀盐酸中,加入淀粉溶液作指示剂,用 的碘酸钾标准溶液滴定至终点,消耗标准溶液
的碘酸钾标准溶液滴定至终点,消耗标准溶液 。
。①滴定原理如下,请完成反应ⅰ的离子方程式。
i.
ii.

②滴定终点的现象是
③产品的纯度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】工业烧碱成分NaOH、Na2CO3和可溶于水但不与酸反应的杂质,工业纯碱成分Na2CO3、NaHCO3和可溶于水但不与酸碱反应的杂质。为测定碱中各成分的百分含量可采用滴定法、气体法等。
完成下列填空:
(1)滴定法测定工业烧碱样品:配制250mL待测液,所用的主要仪器有烧杯、量筒、胶头滴管、玻璃棒、_____________________________ 。
(2)测定工业烧碱的总碱量n Na2O(或总耗酸量):进行滴定时,先向盛待测液的锥形瓶中加______ 作为指示剂。判断滴定终点的现象是___________________ 。
(3)气体法测定工业烧碱的Na2CO3含量(如图):

装置中B部分盛放的试液是___________________ 。装置中A部分的分液漏斗与烧瓶之间连接的导管所起的作用是___________________ 。
(4)用中和滴定的氯化钡法测定工业烧碱中NaOH的含量时,可先在混合液中滴加过量的BaCl2溶液,再以酚酞作指示剂,然后用标准盐酸滴定。
滴加过量的BaCl2溶液目的是___________________ 。向混有碳酸钡沉淀的氢氧化钠溶液中滴入盐酸,为什么不会使碳酸钡溶解而能测定氢氧化钠的含量___________________ 。
(5)用中和滴定的氯化钡法测定工业纯碱中NaHCO3的含量时,使用与测定烧碱相同的实验操作,过程稍作改变即可。简述该操作过程___________________ 。
完成下列填空:
(1)滴定法测定工业烧碱样品:配制250mL待测液,所用的主要仪器有烧杯、量筒、胶头滴管、玻璃棒、
(2)测定工业烧碱的总碱量n Na2O(或总耗酸量):进行滴定时,先向盛待测液的锥形瓶中加
(3)气体法测定工业烧碱的Na2CO3含量(如图):

装置中B部分盛放的试液是
(4)用中和滴定的氯化钡法测定工业烧碱中NaOH的含量时,可先在混合液中滴加过量的BaCl2溶液,再以酚酞作指示剂,然后用标准盐酸滴定。
滴加过量的BaCl2溶液目的是
(5)用中和滴定的氯化钡法测定工业纯碱中NaHCO3的含量时,使用与测定烧碱相同的实验操作,过程稍作改变即可。简述该操作过程
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】实验室以工业废渣(主要含 及杂质)为原料与
及杂质)为原料与 溶液进行浸取,然后过滤取滤渣再进行纯化得轻质
溶液进行浸取,然后过滤取滤渣再进行纯化得轻质 。
。
(1)将氨水和 溶液混合,可制得
溶液混合,可制得 溶液,其离子方程式为
溶液,其离子方程式为_______ ;浸取废渣时,向 溶液中加入适量浓氨水的目的是
溶液中加入适量浓氨水的目的是_______ 。
(2)废渣浸取控制反应温度在60~70℃,搅拌,反应3小时。温度过高将会导致 的转化率下降,其原因是
的转化率下降,其原因是_______ 。
(3)样品中 的测定:已知
的测定:已知 请补充完整实验方案:
请补充完整实验方案:
①取一定量样品碾碎后放入足量盐酸中充分反应(设该样品的其余部分不与HCl反应)过滤,取滤液加入 ,使
,使 完全生成
完全生成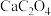 沉淀。将沉淀过滤洗涤后溶解于强酸中,将溶液完全转移到250 mL容量瓶中后定容
沉淀。将沉淀过滤洗涤后溶解于强酸中,将溶液完全转移到250 mL容量瓶中后定容
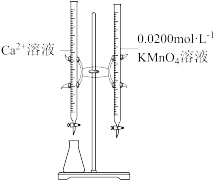
②按规定操作分别将 溶液和待测
溶液和待测 溶液装入如图所示的滴定管中;
溶液装入如图所示的滴定管中;
③_______ 。
(4)若上述实验中一定量样品为1.25g,取用待测 溶液体积为25.00 mL,最终消耗
溶液体积为25.00 mL,最终消耗 溶液体积为20.00 mL,请计算样品中碳酸钙的含量
溶液体积为20.00 mL,请计算样品中碳酸钙的含量_______ (写出计算过程)。
 及杂质)为原料与
及杂质)为原料与 溶液进行浸取,然后过滤取滤渣再进行纯化得轻质
溶液进行浸取,然后过滤取滤渣再进行纯化得轻质 。
。(1)将氨水和
 溶液混合,可制得
溶液混合,可制得 溶液,其离子方程式为
溶液,其离子方程式为 溶液中加入适量浓氨水的目的是
溶液中加入适量浓氨水的目的是(2)废渣浸取控制反应温度在60~70℃,搅拌,反应3小时。温度过高将会导致
 的转化率下降,其原因是
的转化率下降,其原因是(3)样品中
 的测定:已知
的测定:已知 请补充完整实验方案:
请补充完整实验方案:①取一定量样品碾碎后放入足量盐酸中充分反应(设该样品的其余部分不与HCl反应)过滤,取滤液加入
 ,使
,使 完全生成
完全生成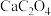 沉淀。将沉淀过滤洗涤后溶解于强酸中,将溶液完全转移到250 mL容量瓶中后定容
沉淀。将沉淀过滤洗涤后溶解于强酸中,将溶液完全转移到250 mL容量瓶中后定容②按规定操作分别将
 溶液和待测
溶液和待测 溶液装入如图所示的滴定管中;
溶液装入如图所示的滴定管中;
③
(4)若上述实验中一定量样品为1.25g,取用待测
 溶液体积为25.00 mL,最终消耗
溶液体积为25.00 mL,最终消耗 溶液体积为20.00 mL,请计算样品中碳酸钙的含量
溶液体积为20.00 mL,请计算样品中碳酸钙的含量
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】硫酸亚锡(SnSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:

查阅资料:Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。(Sn: 119)
回答下列问题:
(1) 操作Ⅰ是________ 、过滤洗涤。
(2)SnCl2粉末需加浓盐酸进行溶解,目的是_______________________________ 。
(3)加入Sn粉的作用有两个:①调节溶液pH,②____________________________ 。[
(4)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是___________________ 。
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl SnCl2 + H2↑;
SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl 6FeCl3 + 2KCl + 2CrCl3 +7H2O
6FeCl3 + 2KCl + 2CrCl3 +7H2O
现取0.80 g锡粉,经上述各步反应后,共用去0.1000 mol/L K2Cr2O7溶液20.00mL。则锡粉中锡的纯度为_______________ 。

查阅资料:Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成碱式氯化亚锡。(Sn: 119)
回答下列问题:
(1) 操作Ⅰ是
(2)SnCl2粉末需加浓盐酸进行溶解,目的是
(3)加入Sn粉的作用有两个:①调节溶液pH,②
(4)反应Ⅰ得到沉淀是SnO,得到该沉淀的离子反应方程式是
(5)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl
 SnCl2 + H2↑;
SnCl2 + H2↑;②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:
6FeCl2 + K2Cr2O7 + 14HCl
 6FeCl3 + 2KCl + 2CrCl3 +7H2O
6FeCl3 + 2KCl + 2CrCl3 +7H2O现取0.80 g锡粉,经上述各步反应后,共用去0.1000 mol/L K2Cr2O7溶液20.00mL。则锡粉中锡的纯度为
您最近一年使用:0次



