工业上可用隔膜电解槽电解食盐水的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,如次氯酸钠等。根据题意完成下列计算:
(1)某氯碱厂测得某组电解槽的阳极每小时产生气体485.92m3(折算到标准状况,下同),合________________ mol;测知其中Cl2的体积分数为0.985(杂质为O2),则该气体的密度为________________ ;阴极产生NaOH_________ mol(保留四位有效数字,下同)。
(2)下表提供了两极溶液浓度的变化数据(阴阳两个极区的物料不流通,忽略其中溶液的体积变化)。
若某个电解槽每小时进NaOH溶液52.000 kg,得到碱溶液初产品90.416 kg,则阳极区每小时加入NaCl溶液_______________ m3。取碱溶液初产品中的40% 加入一定量纯水,达到阴极进料液的浓度要求,则需要加入纯水_________________ L。
(3)产品之一----漂水(NaClO溶液)具有良好的消毒、漂白能力。在制漂水过程中取1L溶液,测得pH=12(忽略水解),NaClO含量为0.3725g。在一定条件下,将该溶液制成晶体,质量最多为1.335g。通过列式计算,写出该晶体的化学式_________________ 。
(1)某氯碱厂测得某组电解槽的阳极每小时产生气体485.92m3(折算到标准状况,下同),合
(2)下表提供了两极溶液浓度的变化数据(阴阳两个极区的物料不流通,忽略其中溶液的体积变化)。
阴极:NaOH溶液质量分数 | 阳极:NaCl溶液浓度(g/L) | |
进料液 | 0.30 | 310 |
电解后 | 0.32 | 210 |
若某个电解槽每小时进NaOH溶液52.000 kg,得到碱溶液初产品90.416 kg,则阳极区每小时加入NaCl溶液
(3)产品之一----漂水(NaClO溶液)具有良好的消毒、漂白能力。在制漂水过程中取1L溶液,测得pH=12(忽略水解),NaClO含量为0.3725g。在一定条件下,将该溶液制成晶体,质量最多为1.335g。通过列式计算,写出该晶体的化学式
更新时间:2020-03-24 21:39:00
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐1】一种以冷热镀管废料锌灰制ZnSO4·7H2O晶体,进而获取ZnO,并探索氢电极增压还原氧化锌电解法制锌的方法,工艺流程如图所示:
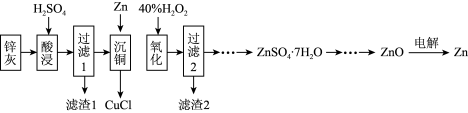
已知:①锌灰的主要成分为ZnO,ZnCl2,还含有SiO2,CuO,PbO和FeO。
②Cu++Cl-=CuCl↓
回答下列问题:
(1)滤渣1的主要成分为SiO2和__ 。
(2)酸浸时,若硫酸浓度过高,可能发生副反应的化学方程式为__ 。
(3)写出“沉铜”时的离子方程式__ 。
(4)在pH为5.6的条件下氧化后,再加入聚丙烯酰胺絮凝剂并加热搅拌,其目的是__ 。
(5)氢电极增压还原氧化锌的装置如图所示,储罐内ZnO溶解后形成Zn(OH) 离子,每溶解1molZnO需消耗
离子,每溶解1molZnO需消耗__ molKOH。电解池中的总反应离子方程式为:__ 。

(6)该工艺废水中含有Zn2+,排放前需处理。向废水中加入CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2S ZnS(s)+2H+。处理后的废水中部分微粒子浓度为:
ZnS(s)+2H+。处理后的废水中部分微粒子浓度为:
处理后的废水的pH=__ ,c(Zn2+)=__ 。
(已知:Ksp(ZnS)=1.0×10-23,Ka1(H2S)=1.0×10-7,Ka2(H2S)=1.0×10-14,Ka(CH3COOH)=2.0×10-5)

已知:①锌灰的主要成分为ZnO,ZnCl2,还含有SiO2,CuO,PbO和FeO。
②Cu++Cl-=CuCl↓
回答下列问题:
(1)滤渣1的主要成分为SiO2和
(2)酸浸时,若硫酸浓度过高,可能发生副反应的化学方程式为
(3)写出“沉铜”时的离子方程式
(4)在pH为5.6的条件下氧化后,再加入聚丙烯酰胺絮凝剂并加热搅拌,其目的是
(5)氢电极增压还原氧化锌的装置如图所示,储罐内ZnO溶解后形成Zn(OH)
 离子,每溶解1molZnO需消耗
离子,每溶解1molZnO需消耗
(6)该工艺废水中含有Zn2+,排放前需处理。向废水中加入CH3COOH和CH3COONa组成的缓冲溶液调节pH,通入H2S发生反应:Zn2++H2S
 ZnS(s)+2H+。处理后的废水中部分微粒子浓度为:
ZnS(s)+2H+。处理后的废水中部分微粒子浓度为:| 微粒 | H2S | CH3COOH | CH3COO- |
| 浓度/mol·L-1 | 0.10 | 0.05 | 0.10 |
处理后的废水的pH=
(已知:Ksp(ZnS)=1.0×10-23,Ka1(H2S)=1.0×10-7,Ka2(H2S)=1.0×10-14,Ka(CH3COOH)=2.0×10-5)
您最近一年使用:0次
【推荐2】大气中NOx、SO2等污染物的有效去除和资源的充分利用是当今社会的重要研究课题,目前采用的方法如下:
I.直接转化法:利用高效催化剂将汽车尾气直接转化为无毒物质。
已知:N2(g)+O2(g)=2NO(g)△H1=+180kJ·mol-1
(1)利用固体表面催化工艺将NO分解为N2、O2而消除污染。
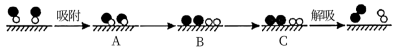
用 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是________________________ (填字母序号)。
(2)利用稀土等催化剂能将汽车尾气中的CO、NO直接转化成无毒物质N2、CO2。
①已知:C(s)、CO(g)的燃烧热分别为393kJ·mol-1、283kJ·mol-1,写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式________________________ 。
②为研究上述反应,某学习小组在密闭容器中充入10molCO和10molNO,发生上述①所写反应,实验测得平衡时NO的体积分数随温度、压强的关系如图。
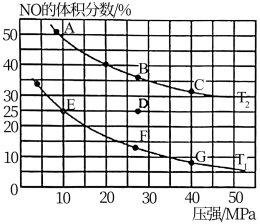
a.某温度下的平衡状态D点,若同时采取缩小容器体积和降低温度,重新达到平衡状态时,可能到达图中A~G点中的________________________ 点。
b.当压强为10MPa、温度为T时的平衡常数Kp=________________________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;保留3位有效数字)。
II.催化还原法:利用还原剂在催化剂的作用下将氮氧化物转为无毒物质N2、CO2。
(3)用活性炭还原法可以处理汽车尾气中的氮氧化物。
某研究小组在2L的恒容密闭容器中加入一定量的NO和足量的固体活性炭,发生反应:C(s)+2NO(g) N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如表:
N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如表:
①该反应的正反应为________________________ (填“吸热”或“放热”)反应。
②350℃时,反应达到平衡后向恒容容器中再充入0.100molNO,再次达到平衡后,N2的体积分数应为________________________ 。
A.0.5B.0.25C.介于0.25和0.5之间D.无法确定
III.电解法:利用电解的方法将氨氧化物转化为有用物质,从而达到资源的回收利用。
(4)如图所示的电解装置,可将雾霾中的NO2、SO2转化为硫酸铵,从而实现废气的回收再利用,回答下列问题:

①阴极的电极反应式为________________________ 。
②上图中A物质是________________________ 。
I.直接转化法:利用高效催化剂将汽车尾气直接转化为无毒物质。
已知:N2(g)+O2(g)=2NO(g)△H1=+180kJ·mol-1
(1)利用固体表面催化工艺将NO分解为N2、O2而消除污染。
用
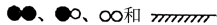 分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是
分别表示N2、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如图所示。从吸附到解吸的过程中,能量状态最低的是
(2)利用稀土等催化剂能将汽车尾气中的CO、NO直接转化成无毒物质N2、CO2。
①已知:C(s)、CO(g)的燃烧热分别为393kJ·mol-1、283kJ·mol-1,写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式
②为研究上述反应,某学习小组在密闭容器中充入10molCO和10molNO,发生上述①所写反应,实验测得平衡时NO的体积分数随温度、压强的关系如图。

a.某温度下的平衡状态D点,若同时采取缩小容器体积和降低温度,重新达到平衡状态时,可能到达图中A~G点中的
b.当压强为10MPa、温度为T时的平衡常数Kp=
II.催化还原法:利用还原剂在催化剂的作用下将氮氧化物转为无毒物质N2、CO2。
(3)用活性炭还原法可以处理汽车尾气中的氮氧化物。
某研究小组在2L的恒容密闭容器中加入一定量的NO和足量的固体活性炭,发生反应:C(s)+2NO(g)
 N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如表:
N2(g)+CO2(g)。在不同温度下测得平衡体系中各物质的物质的量如表:| T/℃ | m(固体活性炭) | n(NO)/mol | n(N2)/mol | n(CO2)/mol |
| 200 | 2.000 | 0.040 | 0.030 | 0.030 |
| 350 | 2.005 | 0.050 | 0.025 | 0.025 |
①该反应的正反应为
②350℃时,反应达到平衡后向恒容容器中再充入0.100molNO,再次达到平衡后,N2的体积分数应为
A.0.5B.0.25C.介于0.25和0.5之间D.无法确定
III.电解法:利用电解的方法将氨氧化物转化为有用物质,从而达到资源的回收利用。
(4)如图所示的电解装置,可将雾霾中的NO2、SO2转化为硫酸铵,从而实现废气的回收再利用,回答下列问题:

①阴极的电极反应式为
②上图中A物质是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】乙炔、乙烯均是重要的化工原料。回答下列问题:
(1)1902年,Sabatier首次发现,常压下过渡金属可以催化含有双键或叁键的气态烃的加氢反应。
①已知:C2H2(g)+H2(g)=C2H4(g)△H1=-174.3kJ·mol—1
K1(300K)=3.37×1024
C2H2(g)+2H2(g)=C2H6(g)△H2=-311.0kJ·mol一l
K2(300K)═1.19×1042
则反应C2H4(g)+H2(g)=C2H6(g)的△H=___ kJ·mol一1,K(300K)=__ (保留三位有效数字)。
②2010年Sheth等得出乙炔在Pd表面选择加氢的反应机理(如图)。其中吸附在Pd表面上的物种用*标注。

上述吸附反应为____ (填“放热”或“吸热”)反应,该历程中最大能垒(活化能)为____ kJ·mol-1,该步骤的化学方程式为____ 。
(2)在恒容密闭容器中充入乙烯,一定条件下发生反应C2H4(g)⇌C2H2(g)+H2(g)。乙烯的离解率为a,平衡时容器内气体总压强为P总,则分压p(C2H4)═___ (用p总和a表示)。
(3)用如图装置电解含CO2的某酸性废水溶液,阴极产物中含有乙烯。
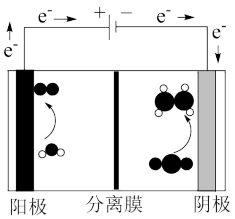
该分离膜为___ (填“阳”或“阴”)离子选择性交换膜;生成乙烯的电极反应式为___ 。
(1)1902年,Sabatier首次发现,常压下过渡金属可以催化含有双键或叁键的气态烃的加氢反应。
①已知:C2H2(g)+H2(g)=C2H4(g)△H1=-174.3kJ·mol—1
K1(300K)=3.37×1024
C2H2(g)+2H2(g)=C2H6(g)△H2=-311.0kJ·mol一l
K2(300K)═1.19×1042
则反应C2H4(g)+H2(g)=C2H6(g)的△H=
②2010年Sheth等得出乙炔在Pd表面选择加氢的反应机理(如图)。其中吸附在Pd表面上的物种用*标注。

上述吸附反应为
(2)在恒容密闭容器中充入乙烯,一定条件下发生反应C2H4(g)⇌C2H2(g)+H2(g)。乙烯的离解率为a,平衡时容器内气体总压强为P总,则分压p(C2H4)═
(3)用如图装置电解含CO2的某酸性废水溶液,阴极产物中含有乙烯。

该分离膜为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】现需设计一套实验装置来电解饱和食盐水,并测量电解产生的氢气的体积(约6 mL)和检验氯气的氧化性(不应将多余的氯气排入空气中)。
(1)试从下图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是A接__________ ,B接__________ 。
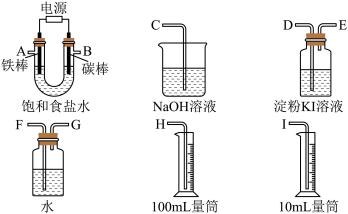
(2)铁棒接直流电源的________ 极;碳棒上发生的电极反应为_______ 。
(3)能说明氯气具有氧化性的实验现象是_______________________ 。
(4)假定装入的食盐水为50 mL,一段时间后,产生5.6 mL(标准状况)H2时,所得溶液在25 ℃时的pH=________ 。
(5)若将B电极换成铁电极,写出在电解过程中U形管底部出现的现象:__________ 。
(1)试从下图中选用几种必要的仪器,连成一整套装置,各种仪器接口的连接顺序(填编号)是A接

(2)铁棒接直流电源的
(3)能说明氯气具有氧化性的实验现象是
(4)假定装入的食盐水为50 mL,一段时间后,产生5.6 mL(标准状况)H2时,所得溶液在25 ℃时的pH=
(5)若将B电极换成铁电极,写出在电解过程中U形管底部出现的现象:
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐2】化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。请回答:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示装置来制取。装置中的离子交换膜只允许___________ 离子通过,氯气的逸出口是___________ (填字母符号)。


(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数 与
与 的关系如图b所示[
的关系如图b所示[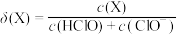 ,X为
,X为 或
或 ,则
,则 的电离常数
的电离常数 值为
值为___________ 。当溶液 时,
时,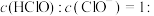
___________ (用 表示)。
表示)。
(3)“84”消毒液的有效成分 也具有漂白和杀菌作用。已知常温下:
也具有漂白和杀菌作用。已知常温下: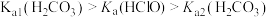 。
。
①常温下,浓度均为0.1mol/L的 溶液和
溶液和 溶液中,
溶液中,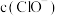
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②向 溶液通入少量
溶液通入少量 ,反应的离子方程式是
,反应的离子方程式是___________ 。
③用过量的冷 溶液吸收氯气,可制得
溶液吸收氯气,可制得 溶液(不含
溶液(不含 ),加热时
),加热时 转化为
转化为 。有研究表明,生成
。有研究表明,生成 的反应分两步进行:
的反应分两步进行:
ⅰ.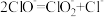 ⅱ.
ⅱ.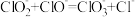
常温下,反应ⅱ能快速进行,但氯气与 溶液反应很难得到
溶液反应很难得到 ,试用碰撞理论解释其原因
,试用碰撞理论解释其原因___________ 。
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示装置来制取。装置中的离子交换膜只允许


(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数
 与
与 的关系如图b所示[
的关系如图b所示[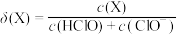 ,X为
,X为 或
或 ,则
,则 的电离常数
的电离常数 值为
值为 时,
时,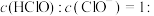
 表示)。
表示)。(3)“84”消毒液的有效成分
 也具有漂白和杀菌作用。已知常温下:
也具有漂白和杀菌作用。已知常温下: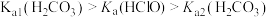 。
。①常温下,浓度均为0.1mol/L的
 溶液和
溶液和 溶液中,
溶液中,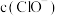
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②向
 溶液通入少量
溶液通入少量 ,反应的离子方程式是
,反应的离子方程式是③用过量的冷
 溶液吸收氯气,可制得
溶液吸收氯气,可制得 溶液(不含
溶液(不含 ),加热时
),加热时 转化为
转化为 。有研究表明,生成
。有研究表明,生成 的反应分两步进行:
的反应分两步进行:ⅰ.
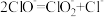 ⅱ.
ⅱ.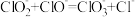
常温下,反应ⅱ能快速进行,但氯气与
 溶液反应很难得到
溶液反应很难得到 ,试用碰撞理论解释其原因
,试用碰撞理论解释其原因
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】氯及其化合物在生活生产中有着重要的应用。按要求回答下列问题。
Ⅰ.氯气的制备
(1)实验室中用 与浓盐酸反应制取并收集纯净的
与浓盐酸反应制取并收集纯净的 ,从下面装置中选出合理装置并连接组装,达成该实验目的的连接顺序为
,从下面装置中选出合理装置并连接组装,达成该实验目的的连接顺序为___________ 。
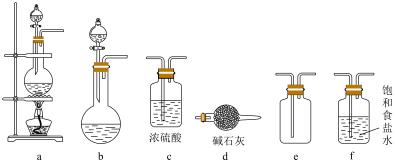
(2)忽略溶液中水蒸气的影响,在方框内画出上述实验中装置的可替代装置,并标注所需试剂的名称。______
(3)写出 在该替代装置中发生反应的离子方程式:
在该替代装置中发生反应的离子方程式:___________ 。
(4)工业上电解饱和食盐水方法制备 反应的离子方程式为
反应的离子方程式为___________ 。
Ⅱ.探究光照条件下氯水体系中粒子的变化
用强光照射盛有氯水的广口瓶,利用传感器采集到氯水的pH、 、广口瓶中
、广口瓶中 的体积分数随时间(t)变化的数据,如下图所示:
的体积分数随时间(t)变化的数据,如下图所示:
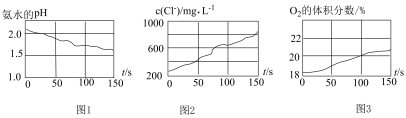
(5)由图1可得结论:___________ 。
(6)分析上述三个图示数据信息,用离子方程式表示得出的结论:___________ 、___________ 。
Ⅲ.探究“84”消毒液(主要成分NaClO)的使用方法
(7)“84”消毒液呈碱性的原因(用化学用语解释):___________ 。
(8)“84”消毒液不能与洁厕灵(含盐酸)混用,否则会产生气体为___________ 。
(9)“84”消毒液与消毒酒精混用会产生乙醛,写出反应的离子方程式___________ 。
Ⅰ.氯气的制备
(1)实验室中用
 与浓盐酸反应制取并收集纯净的
与浓盐酸反应制取并收集纯净的 ,从下面装置中选出合理装置并连接组装,达成该实验目的的连接顺序为
,从下面装置中选出合理装置并连接组装,达成该实验目的的连接顺序为
(2)忽略溶液中水蒸气的影响,在方框内画出上述实验中装置的可替代装置,并标注所需试剂的名称。
(3)写出
 在该替代装置中发生反应的离子方程式:
在该替代装置中发生反应的离子方程式:(4)工业上电解饱和食盐水方法制备
 反应的离子方程式为
反应的离子方程式为Ⅱ.探究光照条件下氯水体系中粒子的变化
用强光照射盛有氯水的广口瓶,利用传感器采集到氯水的pH、
 、广口瓶中
、广口瓶中 的体积分数随时间(t)变化的数据,如下图所示:
的体积分数随时间(t)变化的数据,如下图所示:
(5)由图1可得结论:
(6)分析上述三个图示数据信息,用离子方程式表示得出的结论:
Ⅲ.探究“84”消毒液(主要成分NaClO)的使用方法
(7)“84”消毒液呈碱性的原因(用化学用语解释):
(8)“84”消毒液不能与洁厕灵(含盐酸)混用,否则会产生气体为
(9)“84”消毒液与消毒酒精混用会产生乙醛,写出反应的离子方程式
您最近一年使用:0次



