金属及其化合物在生产生活中有广泛的应用。

(一)金属的应用和防护
(1)航空煤油是飞机的燃料,它主要是由_________________ 炼制的。
(2)铁易生锈,提出防止铁生锈的一种方法____________________ 。
(3)特种钢中含有少量 Mn,MnO2 和 Al 粉混合在高温下反应可得到 Mn,该反应的化学方程式为___________________ 。
(4)Mg(OH)2 受热分解生成高熔点的 MgO。Mg(OH)2 可用作阻燃剂,其主要原理是___________ (选填序号)。
a 分解吸热,降低可燃物着火点 b MgO 覆盖燃烧物,隔绝氧气
(二)制备还原性铁粉
实验室利用废铁屑(含少量 Fe2O3)为原料制备还原性铁粉的流程如下:
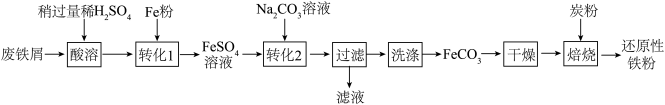
(5)Fe 粉可使“酸溶”产生的 Fe2(SO4)3 转化为 FeSO4,该反应的化学方程式为_____________ 。
(6)检验 FeCO3 已洗净的方法:取最后一次洗涤后的滤液,先加入一定量稀盐酸,再滴加____________ 溶液,无明显现象。
(7) “ 干燥” 时有少量 FeCO3发生下列转化: FeCO3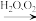 FeOOH+CO2,该转化的化学方程式为
FeOOH+CO2,该转化的化学方程式为____________________________ 。
(8)“焙烧”前,应将炭粉与“干燥”所得固体均匀混合,目的是_______________________ 。

(一)金属的应用和防护
(1)航空煤油是飞机的燃料,它主要是由
(2)铁易生锈,提出防止铁生锈的一种方法
(3)特种钢中含有少量 Mn,MnO2 和 Al 粉混合在高温下反应可得到 Mn,该反应的化学方程式为
(4)Mg(OH)2 受热分解生成高熔点的 MgO。Mg(OH)2 可用作阻燃剂,其主要原理是
a 分解吸热,降低可燃物着火点 b MgO 覆盖燃烧物,隔绝氧气
(二)制备还原性铁粉
实验室利用废铁屑(含少量 Fe2O3)为原料制备还原性铁粉的流程如下:

(5)Fe 粉可使“酸溶”产生的 Fe2(SO4)3 转化为 FeSO4,该反应的化学方程式为
(6)检验 FeCO3 已洗净的方法:取最后一次洗涤后的滤液,先加入一定量稀盐酸,再滴加
(7) “ 干燥” 时有少量 FeCO3发生下列转化: FeCO3
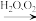 FeOOH+CO2,该转化的化学方程式为
FeOOH+CO2,该转化的化学方程式为(8)“焙烧”前,应将炭粉与“干燥”所得固体均匀混合,目的是
更新时间:2020-05-01 22:51:23
|
相似题推荐
综合应用题
|
适中
(0.65)
【推荐1】酸、碱、盐、氧化物是九年级化学学习的重要知识。
(1)酸、碱、盐、氧化物之间发生复分解反应,一定会生成的物质是_______ (填字母序号)
a.酸 b.碱 c.盐 d.氧化物
(2)如图是氢氧化钠溶液与稀盐酸反应的实验操作和溶液pH变化示意图


①该反应的化学方程式为_______ ;
②当滴入溶液的体积为15mL时,溶液中的溶质为_______ 。
(3)已知甲酸是一种具有挥发性的酸,在热的浓硫酸作用下分解生成H2O和CO。某化学兴趣小组利用甲酸分解产生的CO还原Fe2O3,并检验气体生成物,设计了下图所示实验装置。

①B装置的作用是什么?_____
②写出C处玻璃管中发生反应的化学方程式_____ 。
(4)向盛有硝酸铜溶液的烧杯中,加入一定量锌粉和铁粉的混合物,充分反应后过滤,得到滤渣和滤液。
①若滤液呈无色,请分析滤渣的成分_____ 。
②所得滤液的质量与反应前溶液的质量相比,可能增大,其原因是什么?______
(5)实验室有一瓶标签破损的硝酸银溶液,为测定其溶质质量分数,取50.00g该硝酸银液,向其中加入足量的氯化钠溶液,充分反应后,过滤、洗涤、烘干,称得所得沉淀的质量为2.87g,则该硝酸银溶液的溶质质量分数是_____ ?
(1)酸、碱、盐、氧化物之间发生复分解反应,一定会生成的物质是
a.酸 b.碱 c.盐 d.氧化物
(2)如图是氢氧化钠溶液与稀盐酸反应的实验操作和溶液pH变化示意图


①该反应的化学方程式为
②当滴入溶液的体积为15mL时,溶液中的溶质为
(3)已知甲酸是一种具有挥发性的酸,在热的浓硫酸作用下分解生成H2O和CO。某化学兴趣小组利用甲酸分解产生的CO还原Fe2O3,并检验气体生成物,设计了下图所示实验装置。

①B装置的作用是什么?
②写出C处玻璃管中发生反应的化学方程式
(4)向盛有硝酸铜溶液的烧杯中,加入一定量锌粉和铁粉的混合物,充分反应后过滤,得到滤渣和滤液。
①若滤液呈无色,请分析滤渣的成分
②所得滤液的质量与反应前溶液的质量相比,可能增大,其原因是什么?
(5)实验室有一瓶标签破损的硝酸银溶液,为测定其溶质质量分数,取50.00g该硝酸银液,向其中加入足量的氯化钠溶液,充分反应后,过滤、洗涤、烘干,称得所得沉淀的质量为2.87g,则该硝酸银溶液的溶质质量分数是
您最近一年使用:0次
综合应用题
|
适中
(0.65)
【推荐2】人类社会的发展离不开金属,请依据所学知识填空。
(1)金属材料具有广泛的用途。我国大型C919客机大量使用了铝锂合金,钛合金等。其原因是合金比纯金属具有_____ 。在空气中,铝比铁具有更好的抗腐蚀性。原因是_____ (用文字叙述).下列金属制品中,其用途利用金属导热性的是_____ (填字母序号)

(2)金属资源在地球上分布广泛。人们在自然界中仅发现金、银等少数金属单质,其余金属元素都以化合物形式存在,你认为金属的存在形式主要和_____ 有关。农业上用硫酸铜,生石灰加水配制波尔多液作为杀菌剂,有经验的农民都不用铁制容器来配制或盛放波尔多液,原因是_____ (用化学方程式表示),该反应类型为_____ 。
(3)某硫酸厂开采的黄铁矿(主要成分是FeS2)是生产H2SO4的重要原料。利用黄铁矿生产H2SO4的第一步反应为:4FeS2+11O2═2Fe2O3+8X.所得产物Fe2O3是冶炼铁的重要原料。已知FeS2中Fe的化合价为+2,则S的化合价为_____ ,X的化学式是_____ ,高炉中CO还原Fe2O3的化学方程式为_____ 。工业上用盐酸除铁锈的化学方程式为_____ 。
(1)金属材料具有广泛的用途。我国大型C919客机大量使用了铝锂合金,钛合金等。其原因是合金比纯金属具有

(2)金属资源在地球上分布广泛。人们在自然界中仅发现金、银等少数金属单质,其余金属元素都以化合物形式存在,你认为金属的存在形式主要和
(3)某硫酸厂开采的黄铁矿(主要成分是FeS2)是生产H2SO4的重要原料。利用黄铁矿生产H2SO4的第一步反应为:4FeS2+11O2═2Fe2O3+8X.所得产物Fe2O3是冶炼铁的重要原料。已知FeS2中Fe的化合价为+2,则S的化合价为
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐3】草酸(H2C2O4)是一种酸,易溶于水。
(一)草酸的化学性质
(1)草酸溶液的pH______ 7选填“>”“<”或“=”。
(2)草酸溶液中加入石灰水,生成草酸钙(CaC2O4)固体,该反应的化学方程式为_________ 。
(二)CaC2O4热分解探究:部分资料:①CaC2O4 CaCO3+CO
CaCO3+CO ②草酸钙分解能产生CO2
②草酸钙分解能产生CO2
兴趣小组称一定量的CaC2O4固体,在老师的指导下用如图装置进行实验。


实验一:先通入N2,再加热相应固体,一段时间后停止加热,缓缓通入N2至试管冷却。
(1)装置B增重6.6g,装置B中发生反应的化学方程式为________ 。
(2)装置C中观察到_______ 的现象,说明反应生成CO。
实验二:取出实验一后装置A试管中的剩余固体,按图进行①-③实验。
(3)②中温度升高,则剩余固体中含有______ ,(填化学式)③中产生2.2g气体。
(4)将③中溶液蒸发得CaCl2固体22.2g。结论:取用的CaC2O4固体的质量为______ g。
(一)草酸的化学性质
(1)草酸溶液的pH
(2)草酸溶液中加入石灰水,生成草酸钙(CaC2O4)固体,该反应的化学方程式为
(二)CaC2O4热分解探究:部分资料:①CaC2O4
 CaCO3+CO
CaCO3+CO ②草酸钙分解能产生CO2
②草酸钙分解能产生CO2兴趣小组称一定量的CaC2O4固体,在老师的指导下用如图装置进行实验。


实验一:先通入N2,再加热相应固体,一段时间后停止加热,缓缓通入N2至试管冷却。
(1)装置B增重6.6g,装置B中发生反应的化学方程式为
(2)装置C中观察到
实验二:取出实验一后装置A试管中的剩余固体,按图进行①-③实验。
(3)②中温度升高,则剩余固体中含有
(4)将③中溶液蒸发得CaCl2固体22.2g。结论:取用的CaC2O4固体的质量为
您最近一年使用:0次
【推荐1】某化学兴趣小组对金属的性质做了如下探究,请你填写空格:
(1)用下图所示实验探究铁生锈的条件(每支试管中均放有完全相同的洁净铁片):

(2)A和B的对比试验,说明铁生锈除了需要水,还需要_____ (化学式),A和____ (字母) 说明铁生锈需要水蒸气。
①D实验证明铁在食盐水中与空气接触,_______ (易或不易)锈蚀。
②为防止钢铁锈蚀,除了采用覆盖_________ 等保护膜措施外,还可以制成不锈钢合金。
(3)语言表达铝制品具有很好的抗腐蚀性能的原因是_______________ 。
(4)将一定质量的铁粉放入硫酸铜、硫酸锌的混合溶液中,充分反应后过滤,所得固体中一定含有的物质是___________ ,(本题填写化学式)说明铁、铜、锌的金属活动性由弱到强的顺序是_________ 将等量的铁粉、锌粉、铜粉分别放入等浓度的足量稀盐酸溶液中,产生气体较慢,溶液变为浅绿色的金属是______
(1)用下图所示实验探究铁生锈的条件(每支试管中均放有完全相同的洁净铁片):

(2)A和B的对比试验,说明铁生锈除了需要水,还需要
①D实验证明铁在食盐水中与空气接触,
②为防止钢铁锈蚀,除了采用覆盖
(3)语言表达铝制品具有很好的抗腐蚀性能的原因是
(4)将一定质量的铁粉放入硫酸铜、硫酸锌的混合溶液中,充分反应后过滤,所得固体中一定含有的物质是
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐2】金属及金属材料在生产、生活中有广泛的应用。如图所示,请回答下列问题:

(1)近年来,云南省多地纷纷开展文明城市创建工作,垃圾分类回收是其中一项重要举措。某市街道垃圾桶如图所示,请回答下列问题:
 图中标示的物质,属于金属材料的是
图中标示的物质,属于金属材料的是______  写出一种即可
写出一种即可
 使用铝合金做内筒的优点是
使用铝合金做内筒的优点是______  写出一点即可
写出一点即可 。某品牌饮料的空易拉罐应收入
。某品牌饮料的空易拉罐应收入______  填“可回收”或“不可回收”
填“可回收”或“不可回收” 筒中
筒中
 铁制品锈蚀的过程,实际上是铁跟空气中的
铁制品锈蚀的过程,实际上是铁跟空气中的______ 发生化学反应的过程。
(2)将甲、乙、丙三种金属分别投入稀硫酸中,甲、丙表面有气泡产生,乙无明显现象 若将甲放入丙的盐溶液中,一段时间后,甲的表面有丙析出。由此推断这三种金属的活动性由强到弱的顺序是
若将甲放入丙的盐溶液中,一段时间后,甲的表面有丙析出。由此推断这三种金属的活动性由强到弱的顺序是______ 。
(3)将一定质量的铁粉加入 、
、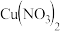 、
、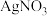 三种物质的混合溶液中,充分反应后过滤,得到滤液和滤渣。下列有关说法正确的是
三种物质的混合溶液中,充分反应后过滤,得到滤液和滤渣。下列有关说法正确的是  填字母
填字母 。
。

(1)近年来,云南省多地纷纷开展文明城市创建工作,垃圾分类回收是其中一项重要举措。某市街道垃圾桶如图所示,请回答下列问题:
 图中标示的物质,属于金属材料的是
图中标示的物质,属于金属材料的是 写出一种即可
写出一种即可
 使用铝合金做内筒的优点是
使用铝合金做内筒的优点是 写出一点即可
写出一点即可 。某品牌饮料的空易拉罐应收入
。某品牌饮料的空易拉罐应收入 填“可回收”或“不可回收”
填“可回收”或“不可回收” 筒中
筒中
 铁制品锈蚀的过程,实际上是铁跟空气中的
铁制品锈蚀的过程,实际上是铁跟空气中的(2)将甲、乙、丙三种金属分别投入稀硫酸中,甲、丙表面有气泡产生,乙无明显现象
 若将甲放入丙的盐溶液中,一段时间后,甲的表面有丙析出。由此推断这三种金属的活动性由强到弱的顺序是
若将甲放入丙的盐溶液中,一段时间后,甲的表面有丙析出。由此推断这三种金属的活动性由强到弱的顺序是(3)将一定质量的铁粉加入
 、
、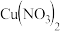 、
、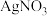 三种物质的混合溶液中,充分反应后过滤,得到滤液和滤渣。下列有关说法正确的是
三种物质的混合溶液中,充分反应后过滤,得到滤液和滤渣。下列有关说法正确的是  填字母
填字母 。
。| A.若滤液为蓝色,则滤渣中一定有银,可能有铜 |
B.若滤渣中含有银、铜、铁,则滤液中一定含有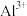 、 、 、 、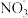 |
| C.若滤液为浅绿色,则滤渣中一定含有银、铜、铝 |
D.若滤渣中加稀盐酸无气泡产生,则滤液中一定有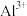 、 、 、 、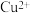 ,可能有 ,可能有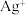 |
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐3】我国城市高铁和地铁的开通运行,给天们的生活带来了很多便利。高铁和地铁的建设广泛使用了金属材料。
(1)地铁建设中使用了钢轨,钢轨长时间使用后会生锈,写出用稀盐酸除去铁锈的化学方程式__________ 。写出防止铁制品锈蚀的一种常用方法___________ 。
(2)防止金属锈蚀是保护金属资源的有效途径之一。下列情况铁最不容易生锈的是__________ (填序号)。
①部分浸没在海水中少许 ②在潮湿空气中 ③浸没在植物油中
(3)我国的高铁技术在当今世界上遥遥领先,其中铁轨用锰钢而不使用纯铁的原因是__________ ,已知锰的金属活动性介于镁和锌之间,下列试剂能够验证铁和锰的金属活动性强弱的是__________ 。
A铁、锰、硫酸锌溶液
B铁、锰、硫酸镁溶液
C铜、硫酸亚铁溶液、硫酸锰溶液
(1)地铁建设中使用了钢轨,钢轨长时间使用后会生锈,写出用稀盐酸除去铁锈的化学方程式
(2)防止金属锈蚀是保护金属资源的有效途径之一。下列情况铁最不容易生锈的是
①部分浸没在海水中少许 ②在潮湿空气中 ③浸没在植物油中
(3)我国的高铁技术在当今世界上遥遥领先,其中铁轨用锰钢而不使用纯铁的原因是
A铁、锰、硫酸锌溶液
B铁、锰、硫酸镁溶液
C铜、硫酸亚铁溶液、硫酸锰溶液
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐1】碳元素是非常神奇的元素,绝大多数重要化合物都离不开碳元素的身影,同时也是人类得以利用最早的元素之一。
(1)《平复帖》的书写年代距今已有1700余年,虽历经千百年仍字迹清晰,这是因为墨汁中的主要成分碳在常温下具有______ 。
(2)出土的青铜器表面有一些绿色固体,俗称“铜绿”,其主要成分是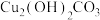 ,铜绿是铜与氧气、
,铜绿是铜与氧气、______ 和______ 共同作用产生的。
(3)二氧化碳可用于灭火,其原因是______ 。
(4)在实际生产中,常采用过量 溶液来“捕捉”(吸收)二氧化碳,部分流程图如图所示(部分条件及物质未标出)。
溶液来“捕捉”(吸收)二氧化碳,部分流程图如图所示(部分条件及物质未标出)。

①分离室中进行的操作是______ 。
②请分析从捕捉室出来的X溶液中含有的溶质成分_____________ (简要写出实验操作、现象和结论)。
③向X溶液中加入 ,写出发生反应的化学方程式
,写出发生反应的化学方程式_____________ 。(写出一个即可)
(5)《天工开物》中有利用炉甘石(主要成分是 )火法炼锌的工艺记载,主要反应原理是高温时
)火法炼锌的工艺记载,主要反应原理是高温时 被碳还原为金属
被碳还原为金属 ,同时生成
,同时生成 。现有20kg炉甘石,与足量碳充分反应(假设杂质不参与反应),生成8.4kg
。现有20kg炉甘石,与足量碳充分反应(假设杂质不参与反应),生成8.4kg  ,求此炉甘石中
,求此炉甘石中 的质量分数
的质量分数_______ 。
(1)《平复帖》的书写年代距今已有1700余年,虽历经千百年仍字迹清晰,这是因为墨汁中的主要成分碳在常温下具有
(2)出土的青铜器表面有一些绿色固体,俗称“铜绿”,其主要成分是
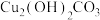 ,铜绿是铜与氧气、
,铜绿是铜与氧气、(3)二氧化碳可用于灭火,其原因是
(4)在实际生产中,常采用过量
 溶液来“捕捉”(吸收)二氧化碳,部分流程图如图所示(部分条件及物质未标出)。
溶液来“捕捉”(吸收)二氧化碳,部分流程图如图所示(部分条件及物质未标出)。
①分离室中进行的操作是
②请分析从捕捉室出来的X溶液中含有的溶质成分
③向X溶液中加入
 ,写出发生反应的化学方程式
,写出发生反应的化学方程式(5)《天工开物》中有利用炉甘石(主要成分是
 )火法炼锌的工艺记载,主要反应原理是高温时
)火法炼锌的工艺记载,主要反应原理是高温时 被碳还原为金属
被碳还原为金属 ,同时生成
,同时生成 。现有20kg炉甘石,与足量碳充分反应(假设杂质不参与反应),生成8.4kg
。现有20kg炉甘石,与足量碳充分反应(假设杂质不参与反应),生成8.4kg  ,求此炉甘石中
,求此炉甘石中 的质量分数
的质量分数
您最近一年使用:0次
综合应用题
|
适中
(0.65)
【推荐2】化学是以实验为基础的科学,实验是科学探究的重要手段。
(1)如图是用微型Y形管探究CO2性质的实验。

①实验中,干燥管中紫色石蕊溶液浸湿的纸质小花颜色变为_____ 色。
②右边支管B中发生反应的化学方程式为_____ 。
(2)同学们在实验室用氯化钠固体配制50g溶质质量分数为5%的氯化钠溶液。需要称取氯化钠的质量为_____ g;实验结束后对所配制的溶液进行检测,发现溶质质量分数偏大,可能的原因是_____ 。(写出一种即可)
(3)下图是实验室模拟工业炼铁的实验装置图。
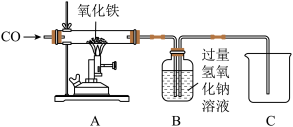
①实验前先通入CO再点燃酒精灯的目的是_____ 。
②硬质玻璃管中观察到的实验现象是_____ 。
③请设计实验验证反应后装置B内溶液中溶质的成分_____ 。(简要叙述实验步骤及现象)
(4)某同学用锌粒和稀硫酸制取氢气,将足量的锌粒加入50g溶质质量分数为9.8%的稀硫酸中,充分反应。理论上制得氢气的质量是多少?
(1)如图是用微型Y形管探究CO2性质的实验。

①实验中,干燥管中紫色石蕊溶液浸湿的纸质小花颜色变为
②右边支管B中发生反应的化学方程式为
(2)同学们在实验室用氯化钠固体配制50g溶质质量分数为5%的氯化钠溶液。需要称取氯化钠的质量为
(3)下图是实验室模拟工业炼铁的实验装置图。

①实验前先通入CO再点燃酒精灯的目的是
②硬质玻璃管中观察到的实验现象是
③请设计实验验证反应后装置B内溶液中溶质的成分
(4)某同学用锌粒和稀硫酸制取氢气,将足量的锌粒加入50g溶质质量分数为9.8%的稀硫酸中,充分反应。理论上制得氢气的质量是多少?
您最近一年使用:0次
综合应用题
|
适中
(0.65)
真题
解题方法
【推荐3】归纳总结是化学学习的常用方法.
(1)甲+HCl→NaCl+H2O,甲物质可以是______ 、_____ (填两种不同类别物质的化学式).上述转化中,属于中和反应的化学方程式是________________ .
(2)乙在空气中燃烧生成CO2和H2O,请写出符合条件的一个化学方程式_________________________________ .
(3)A、B、C、D、E都是初中化学常见的物质.B、D、E均为氧化物,常温下B为固态,D为液态,E为气态;A、B、C中均含有同一种金属元素.它们之间的转化关系如图所示(部分生成物略去).

写出下列转化的化学方程式:
B→C:_________________________________ ;
C→A:_________________________________ .
(1)甲+HCl→NaCl+H2O,甲物质可以是
(2)乙在空气中燃烧生成CO2和H2O,请写出符合条件的一个化学方程式
(3)A、B、C、D、E都是初中化学常见的物质.B、D、E均为氧化物,常温下B为固态,D为液态,E为气态;A、B、C中均含有同一种金属元素.它们之间的转化关系如图所示(部分生成物略去).

写出下列转化的化学方程式:
B→C:
C→A:
您最近一年使用:0次
综合应用题
|
适中
(0.65)
解题方法
【推荐1】人们在生活中由于忽视燃烧的条件经常会发生重大的火灾事故。现请你运用所学知识对下列案例进行分析或探究。
【案例一】某餐厅服务员往尚未熄灭的酒精炉内添加酒精,结果引起爆燃。
(1)用作燃料的酒精浓度一般为95%,该酒精属于_________ (填“纯净物”或“混合物”)。
(2)尚未熄灭的酒精炉在这次爆燃中所起的主要作用是______(填字母序号)。
【案例二】在某次山火扑灭后,没有留下人员值守,结果刚扑灭的地方不久又重新燃烧起来了。
(3)你认为刚扑灭的地方又重新燃烧起来的原因可能是_______ 。
(4)如果你是留下来的值守人员,怎样做就可以防止“死灰复燃”_____ (写出一点即可)。
步骤一:按如图组装装置,装入药品,玻璃管内充满二氧化碳,用酒精灯对准B处的红磷加热,观察现象。
步骤二:打开分液漏斗的活塞,向锥形瓶内注入双氧水,再观察现象。
(5)向锥形瓶内注入双氧水时发生反应的化学方程式是________ 。
(6)通过上述实验,能证明燃烧需要氧气的实验现象是_____ ,能证明燃烧需要使温度达到可燃物着火点的实验现象是_________ 。
(7)该实验存在的不足之处是_______ (写出一点即可)。
【实验探究】再探镁的燃烧
(8)查阅文献:镁不仅能在氧气中燃烧,还能在二氧化碳和氮气中燃烧,镁在氮气中燃烧生成氮化镁(化学式是Mg3N2)。结合已有知识,回答下列问题:
①由上面的文献资料,你对燃烧有什么新的认识________ 。
②镁在二氧化碳中燃烧的化学方程式是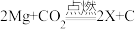 ,则X的化学式是
,则X的化学式是______ 。
③若将2.4g镁在氮气、氧气和二氧化碳三种气体的混合物中充分燃烧,生成物的质量是mg,则m的取值范围是________ 。
【案例一】某餐厅服务员往尚未熄灭的酒精炉内添加酒精,结果引起爆燃。
(1)用作燃料的酒精浓度一般为95%,该酒精属于
(2)尚未熄灭的酒精炉在这次爆燃中所起的主要作用是______(填字母序号)。
| A.提供了可燃物 | B.使温度达到可燃物着火点 | C.降低了可燃物的着火点 |
【案例二】在某次山火扑灭后,没有留下人员值守,结果刚扑灭的地方不久又重新燃烧起来了。
(3)你认为刚扑灭的地方又重新燃烧起来的原因可能是
(4)如果你是留下来的值守人员,怎样做就可以防止“死灰复燃”

步骤一:按如图组装装置,装入药品,玻璃管内充满二氧化碳,用酒精灯对准B处的红磷加热,观察现象。
步骤二:打开分液漏斗的活塞,向锥形瓶内注入双氧水,再观察现象。
(5)向锥形瓶内注入双氧水时发生反应的化学方程式是
(6)通过上述实验,能证明燃烧需要氧气的实验现象是
(7)该实验存在的不足之处是
【实验探究】再探镁的燃烧
(8)查阅文献:镁不仅能在氧气中燃烧,还能在二氧化碳和氮气中燃烧,镁在氮气中燃烧生成氮化镁(化学式是Mg3N2)。结合已有知识,回答下列问题:
①由上面的文献资料,你对燃烧有什么新的认识
②镁在二氧化碳中燃烧的化学方程式是
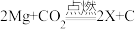 ,则X的化学式是
,则X的化学式是③若将2.4g镁在氮气、氧气和二氧化碳三种气体的混合物中充分燃烧,生成物的质量是mg,则m的取值范围是
您最近一年使用:0次
综合应用题
|
适中
(0.65)
名校
解题方法
【推荐2】温室效应加剧引起的气候异常变化是人类面临的全球性问题。中国政府提出2060年前实现“碳中和”的目标,体现了大国担当。实现“碳中和”可以从多方面进行:
I.“碳减排”
(1)下列做法符合节能减排的是_______ 。(填字母)
a.提倡绿色出行
b.提倡人走灯熄
c.垃圾焚烧处理
d.推广使用太阳能
Ⅱ.“碳捕获”
(2)“碳捕获”并封存被认为是目前减缓全球变暖最经济可行的方式。图1是一种利用NaOH溶液实现“碳捕获”的技术主要流程。_______ 。
②将捕捉到的二氧化碳和氦气压入自动灭火陶瓷砖,用这种砖砌成的房屋发生火灾时,在高温烘烧下,砖会裂开并喷出氦气和二氧化碳,从而灭火。自动灭火陶瓷砖的灭火原理是_______ 。
Ⅲ.“碳转化”
(3)2020年哥伦比亚大学化学团队开发出了镍基双金属催化剂,用来将二氧化碳和甲烷两种温室气体在一定条件下进行重整得到两种气体燃料。反应过程如图2所示,写出总反应的化学方程式_______ ,应一段时间后该催化剂的催化效果降低的原因是_______ 。反应中各物质的量随温度变化的曲线如图3所示,纵坐标数值越大表示该物质越多,由此可知,反应应在_______ (填“较低”或“较高”)温度下进行。
I.“碳减排”
(1)下列做法符合节能减排的是
a.提倡绿色出行
b.提倡人走灯熄
c.垃圾焚烧处理
d.推广使用太阳能
Ⅱ.“碳捕获”
(2)“碳捕获”并封存被认为是目前减缓全球变暖最经济可行的方式。图1是一种利用NaOH溶液实现“碳捕获”的技术主要流程。

②将捕捉到的二氧化碳和氦气压入自动灭火陶瓷砖,用这种砖砌成的房屋发生火灾时,在高温烘烧下,砖会裂开并喷出氦气和二氧化碳,从而灭火。自动灭火陶瓷砖的灭火原理是
Ⅲ.“碳转化”
(3)2020年哥伦比亚大学化学团队开发出了镍基双金属催化剂,用来将二氧化碳和甲烷两种温室气体在一定条件下进行重整得到两种气体燃料。反应过程如图2所示,写出总反应的化学方程式

您最近一年使用:0次
综合应用题
|
适中
(0.65)
【推荐3】人类的生产生活离不开金属材料,随着科技水平的不断提高,金属及其合金在日常生活中扮演着越来越重要的角色。
(1)人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”,在“五金”顺序中把金属____ 的位置移到最后,正好符合由弱到强的顺序.
(2)汽车车体多用钢材制造。表面喷漆不仅美观,而且可有效防止与__________ 接触而生锈。
(3)工业上用CO还原赤铁矿(主要成分为Fe2O3)冶炼金属铁的化学方程式为_____ 。
西汉时期中国古老的冶铜方法是“湿法冶铜”主要的反应原理是铁与硫酸铜溶液反应,写出反应的化学方程式_______ 。
(4)在实验室中探究铝、铜的金属活动性顺序,除铝、铜外,还需要用到的试剂是______ 。(填一种即可)
(5)铁锅、铝锅是生活中常用的炊具,下图是铁锅的示意图。

①铁锅所含金属单质_______ (写化学式),含有的有机合成材料是______ 。(填写名称)
②炒菜时铁锅中的油着火可用锅盖盖灭,其原理是_______ 。
③铜也易生锈,铜锈的主要成分是碱式碳酸铜(Cu2(OH)2CO3),是铜与空气中的氧气、水和______ 共同作用的结果.
④将5.6克铁与足量的稀硫酸反应可制得氢气的质量是___________ (写出解题过程)。
(1)人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”,在“五金”顺序中把金属
(2)汽车车体多用钢材制造。表面喷漆不仅美观,而且可有效防止与
(3)工业上用CO还原赤铁矿(主要成分为Fe2O3)冶炼金属铁的化学方程式为
西汉时期中国古老的冶铜方法是“湿法冶铜”主要的反应原理是铁与硫酸铜溶液反应,写出反应的化学方程式
(4)在实验室中探究铝、铜的金属活动性顺序,除铝、铜外,还需要用到的试剂是
(5)铁锅、铝锅是生活中常用的炊具,下图是铁锅的示意图。

①铁锅所含金属单质
②炒菜时铁锅中的油着火可用锅盖盖灭,其原理是
③铜也易生锈,铜锈的主要成分是碱式碳酸铜(Cu2(OH)2CO3),是铜与空气中的氧气、水和
④将5.6克铁与足量的稀硫酸反应可制得氢气的质量是
您最近一年使用:0次



