铁及其合金是日常生活中应用广泛的金属材料,以下对铁的冶炼进行探究。
I如图为工业炼铁示意图。
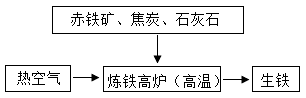
(1)焦炭所起的作用是什么?______
(2)炼铁的固体原料需经过粉碎,其目的是什么?_____
Ⅱ以下为在实验室中进行模拟炼铁实验。
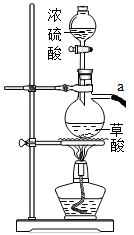
(1)下图为实验室制取CO的发生装置。其原理为草酸(化学式为H2C2O4)在浓硫酸催化并加热的条件下分解出一氧化碳、二氧化碳和水,写出其化学方程式。______
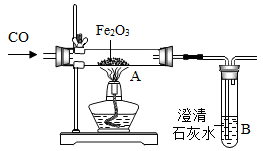
(2)利用下图装置可以制取并利用纯净、干燥的CO还原Fe2O3并检验气体产物。
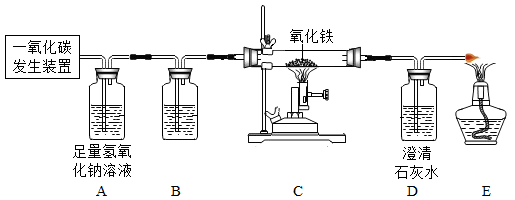
①实验中装置B中应盛放的试剂是什么?______
②装置E的作用是什么?_______
③装置C、D里可分别观察到什么现象?______
④写出装置C中反应的化学方程式。______
Ⅲ 取反应后已部分变质的A装置内的溶液150g,向其中加入溶质质量分数为4.9%的稀硫酸100g,恰好完全反应得到中性溶液,计算反应后溶液中溶质的质量_____ 。
I如图为工业炼铁示意图。

(1)焦炭所起的作用是什么?
(2)炼铁的固体原料需经过粉碎,其目的是什么?
Ⅱ以下为在实验室中进行模拟炼铁实验。
(1)下图为实验室制取CO的发生装置。其原理为草酸(化学式为H2C2O4)在浓硫酸催化并加热的条件下分解出一氧化碳、二氧化碳和水,写出其化学方程式。

(2)利用下图装置可以制取并利用纯净、干燥的CO还原Fe2O3并检验气体产物。

①实验中装置B中应盛放的试剂是什么?
②装置E的作用是什么?
③装置C、D里可分别观察到什么现象?
④写出装置C中反应的化学方程式。
Ⅲ 取反应后已部分变质的A装置内的溶液150g,向其中加入溶质质量分数为4.9%的稀硫酸100g,恰好完全反应得到中性溶液,计算反应后溶液中溶质的质量
更新时间:2020-06-30 05:53:18
|
相似题推荐
综合应用题
|
较难
(0.4)
名校
解题方法
【推荐1】金属材料是人类赖以生存和发展的重要物质。
(一)金属制品的广泛应用
(1)航母用钢要具有低磁性。下列具有磁性的是______ 。
a.FeO b.Fe3O4 c.Fe2O3
(2)钢铁材料通常分为生铁和钢。
①生铁和钢物理性质有很大差异主要由于______ (选填序号)。
a.生铁是混合物,钢是纯净物 b.含碳量不同
②生铁炼钢时,硅(Si)与氧化亚铁在高温下转化为二氧化硅和铁,该反应的化学方程式______ 。
(3)金属铝具有很好的抗腐蚀性能,原因是______ 。
(二)铁及其化合物的实验
(4)将Fe粉溶于稀H2SO4,此反应属于______ (填基本反应类型),反应的化学方程式为______ 。
(5)向上述反应后的溶液中滴加NaOH溶液,生成白色Fe(OH)2沉淀,随后沉淀变为灰绿色。白色沉淀变为灰绿色的原因之一是部分Fe(OH)2接触氧气化合生成Fe(OH)3,反应的化学方程式______ 。生成的Fe(OH)3会分解为Fe2O3。
(三)铁锈成分的确定
铁锈的成分可简单表示为Fe2O3·nH2O。兴趣小组发现实验室中有一保管不善的铁粉,部分已经结块成红棕色,为了探究铁锈(Fe2O3·nH2O)的组成,称取20.0g这种铁粉样品,按如图所示装置进行实验。
(资料:浓H2SO4可吸收H2O;碱石灰可吸收H2O和CO2)
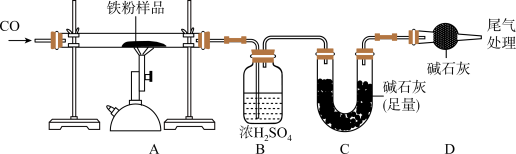
(6)连接装置,先______ ,再装入药品。
(7)实验开始时应先通入CO目的是______ ,停止加热后继续通CO的目的是防止倒吸和______ 。
反应过程中通入足量的CO充分反应,直至装置A中剩余固体质量不再改变为止,冷却后称得装置B增重2.7g,装置C增重6.6g。下图是装置A中固体质量与加热时间的关系图像。
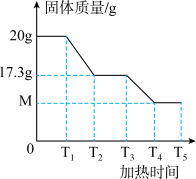
(8)0-T1固体质量不变的原因______ 。
(9)n的值是______ 。
(10)图中M点的数值是______ 。
(11)实验中若缺少D装置,测得的n的值会______ (填“偏大”、“偏小”或“不变”)。
(一)金属制品的广泛应用
(1)航母用钢要具有低磁性。下列具有磁性的是
a.FeO b.Fe3O4 c.Fe2O3
(2)钢铁材料通常分为生铁和钢。
①生铁和钢物理性质有很大差异主要由于
a.生铁是混合物,钢是纯净物 b.含碳量不同
②生铁炼钢时,硅(Si)与氧化亚铁在高温下转化为二氧化硅和铁,该反应的化学方程式
(3)金属铝具有很好的抗腐蚀性能,原因是
(二)铁及其化合物的实验
(4)将Fe粉溶于稀H2SO4,此反应属于
(5)向上述反应后的溶液中滴加NaOH溶液,生成白色Fe(OH)2沉淀,随后沉淀变为灰绿色。白色沉淀变为灰绿色的原因之一是部分Fe(OH)2接触氧气化合生成Fe(OH)3,反应的化学方程式
(三)铁锈成分的确定
铁锈的成分可简单表示为Fe2O3·nH2O。兴趣小组发现实验室中有一保管不善的铁粉,部分已经结块成红棕色,为了探究铁锈(Fe2O3·nH2O)的组成,称取20.0g这种铁粉样品,按如图所示装置进行实验。
(资料:浓H2SO4可吸收H2O;碱石灰可吸收H2O和CO2)

(6)连接装置,先
(7)实验开始时应先通入CO目的是
反应过程中通入足量的CO充分反应,直至装置A中剩余固体质量不再改变为止,冷却后称得装置B增重2.7g,装置C增重6.6g。下图是装置A中固体质量与加热时间的关系图像。

(8)0-T1固体质量不变的原因
(9)n的值是
(10)图中M点的数值是
(11)实验中若缺少D装置,测得的n的值会
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐2】金属与人类的生产、生活密切相关,牢固掌握金属的知识非常重要。
(1)铝和铁都是我们生活中常见的金属,铝耐腐蚀性能比铁好的原因是________ 。
①纯铁和生铁性能不同的原因是________ 。
②如图A中的实验现象是_________ 。
③从环保角度考虑,还需对以上装置进行改进,请简述改进措施。______________
(3)铁制品容易锈蚀,是铁与_______ 同时反应的结果。
(4)为了验证锌、铁、铜、银四种金属的活动性顺序,某同学进行如图所示的实验。
①老师认为该同学不能达到实验目的,请说明理由。____________
②请在原实验的基础上补充一个实验,以证明四种金属的活动性顺序(写出所用试剂即可)。_____________________
(5)实验室用足量一氧化碳还原10g赤铁矿。充分反应后.测得生成二氧化碳的质量为6.6g.则该赤铁矿中氧化铁的质量分数是多少?_________________
(1)铝和铁都是我们生活中常见的金属,铝耐腐蚀性能比铁好的原因是
①纯铁和生铁性能不同的原因是
②如图A中的实验现象是
③从环保角度考虑,还需对以上装置进行改进,请简述改进措施。
(3)铁制品容易锈蚀,是铁与
(4)为了验证锌、铁、铜、银四种金属的活动性顺序,某同学进行如图所示的实验。
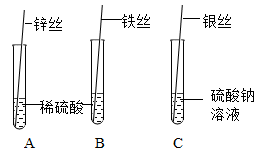
①老师认为该同学不能达到实验目的,请说明理由。
②请在原实验的基础上补充一个实验,以证明四种金属的活动性顺序(写出所用试剂即可)。
(5)实验室用足量一氧化碳还原10g赤铁矿。充分反应后.测得生成二氧化碳的质量为6.6g.则该赤铁矿中氧化铁的质量分数是多少?
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐3】铁及其化合物在工农业生产和生活中有广泛应用。
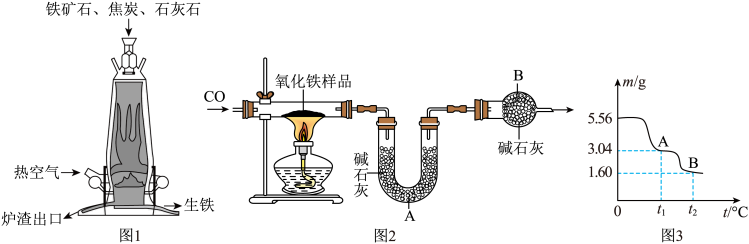
(1)图1工业炼铁的设备为__________ ;从底部流出的生铁属_______ (填“金属单质”或“合金”)。下列作用中①与铁矿石发生反应生成铁 ②燃烧供热 ③除去铁矿石中少量杂质(如SiO2)④生成CO,属于从炉顶加入焦炭的作用有________ (填字母)。
A. ①② B. ①③ C. ②③ D. ②④
(2)实验室可用图2装置模拟工业炼铁并测定样品中氧化铁(Fe2O3)的质量分数(杂质不含铁元素,且不与CO反应)
【查阅资料】碱石灰能吸收二氧化碳和水蒸气
【问题讨论】实验开始时,先___________ (选填“通CO”或“加热”)目的是______________ 反应产生的CO2全部被A吸收,装置B的作用是_________ ,从环保角度看该实验装置有一明显缺陷是:____________ 。
【数据处理】称取样品8.0g,用上述装置进行实验,充分反应后称量A装置增重4.4g。则 样品中氧化铁质量分数为_________ %。
【实验反思】当观察到反应管中固体全部变黑后,若立即停止通CO,则测得的样品中氧化铁的质量分数_________ (填“偏大”,“偏小”,“无影响”)
(3)废铁屑的主要成分是铁,同时还有少量铁锈(Fe2O3),用于制备动物饲料硫酸亚铁的流程如下:

①反应器中发生的反应除了Fe2O3+3H2SO4=Fe2(SO4)3+3H2O和Fe+ Fe2(SO4)3=3FeSO4外,还有____________________ (写方程式);
②滤液M的溶质有________________ ;
(4)5.56g硫酸亚铁晶体(FeSO4·xH2O)隔绝空气受热分解时,生成金属氧化物和气体。固体产物的质量随温度变化的曲线如图3所示。
①0~t1℃,发生的变化是加热失去结晶水(方程式为:FeSO4·xH2O====FeSO4 + xH2O),则x=_____________ ;
②t2℃时B点固体组成只有一种(铁的氧化物),化学式为_________ 。

(1)图1工业炼铁的设备为
A. ①② B. ①③ C. ②③ D. ②④
(2)实验室可用图2装置模拟工业炼铁并测定样品中氧化铁(Fe2O3)的质量分数(杂质不含铁元素,且不与CO反应)
【查阅资料】碱石灰能吸收二氧化碳和水蒸气
【问题讨论】实验开始时,先
【数据处理】称取样品8.0g,用上述装置进行实验,充分反应后称量A装置增重4.4g。则 样品中氧化铁质量分数为
【实验反思】当观察到反应管中固体全部变黑后,若立即停止通CO,则测得的样品中氧化铁的质量分数
(3)废铁屑的主要成分是铁,同时还有少量铁锈(Fe2O3),用于制备动物饲料硫酸亚铁的流程如下:

①反应器中发生的反应除了Fe2O3+3H2SO4=Fe2(SO4)3+3H2O和Fe+ Fe2(SO4)3=3FeSO4外,还有
②滤液M的溶质有
(4)5.56g硫酸亚铁晶体(FeSO4·xH2O)隔绝空气受热分解时,生成金属氧化物和气体。固体产物的质量随温度变化的曲线如图3所示。
①0~t1℃,发生的变化是加热失去结晶水(方程式为:FeSO4·xH2O====FeSO4 + xH2O),则x=
②t2℃时B点固体组成只有一种(铁的氧化物),化学式为
您最近一年使用:0次
综合应用题
|
较难
(0.4)
真题
解题方法
【推荐1】含有镁的合金广泛应用于航空航天领域,回答下列问题:
(1)取少量光亮的镁条于试管中,向其中加入稀盐酸,观察到______ 的现象可推断二者发生了化学反应;
(2)若验证镁与稀盐酸反应后的溶液中有盐酸剩余,下列实验设计可行的是______ ;
A.取生锈的铁钉于试管中,加入反应后的溶液
B.取少量反应后的溶液于试管中, 滴加AgNO3溶液
C.取少量反应后的溶液于试管中,滴加稀氢氧化钠溶液
(3)向镁条中加入过量稀盐酸,完全反应后,再加入过量氢氧化钠溶液,生成5.8g氢氧化镁沉淀。
①写出加入氢氧化钠溶液时,生成氢氧化镁沉淀的化学方程式______ ;
②计算镁条与稀盐酸完全反应后生成MgCl2的质量为______ g。
(1)取少量光亮的镁条于试管中,向其中加入稀盐酸,观察到
(2)若验证镁与稀盐酸反应后的溶液中有盐酸剩余,下列实验设计可行的是
A.取生锈的铁钉于试管中,加入反应后的溶液
B.取少量反应后的溶液于试管中, 滴加AgNO3溶液
C.取少量反应后的溶液于试管中,滴加稀氢氧化钠溶液
(3)向镁条中加入过量稀盐酸,完全反应后,再加入过量氢氧化钠溶液,生成5.8g氢氧化镁沉淀。
①写出加入氢氧化钠溶液时,生成氢氧化镁沉淀的化学方程式
②计算镁条与稀盐酸完全反应后生成MgCl2的质量为
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐2】酸、碱、盐在生产生活中具有广泛的用途。
(1)化学实验室有失去标签的稀硫酸、硝酸钙、硝酸银、碳酸钠、氯化钡五瓶无色溶液,现将其任意编号:A、B、C、D、E,然后两两组合进行实验,其部分现象如下表(微溶物视为可溶物):
①写出溶液A、C、E中溶质的化学式:A___________ ,C___________ ,E___________ 。
②写出溶液B与D反应的化学方程式___________ 。
(2)我国制碱工业先驱侯德榜发明了“侯氏制碱法”,其主要化学原理:NaCl+H2O+NH3+CO2=NaHCO3↓+X;2NaHCO3 Na2CO3+H2O+CO2↑等。回答下列问题:
Na2CO3+H2O+CO2↑等。回答下列问题:
①X的化学式为___________ 。
②将碳酸钠和碳酸氢钠的混合物18g充分加热至质量不再改变,冷却称量固体质量减少6.2g,则原混合物中碳酸钠和碳酸氢钠的质量比为___________ (写最简比)。
(1)化学实验室有失去标签的稀硫酸、硝酸钙、硝酸银、碳酸钠、氯化钡五瓶无色溶液,现将其任意编号:A、B、C、D、E,然后两两组合进行实验,其部分现象如下表(微溶物视为可溶物):
| 实验 | A+B | A+C | A+D | B+D | B+E | A+E |
| 现象 | 产生沉淀 | 产生沉淀 | 产生沉淀 | 产生沉淀 | 产生沉淀 | 产生气体 |
②写出溶液B与D反应的化学方程式
(2)我国制碱工业先驱侯德榜发明了“侯氏制碱法”,其主要化学原理:NaCl+H2O+NH3+CO2=NaHCO3↓+X;2NaHCO3
 Na2CO3+H2O+CO2↑等。回答下列问题:
Na2CO3+H2O+CO2↑等。回答下列问题:①X的化学式为
②将碳酸钠和碳酸氢钠的混合物18g充分加热至质量不再改变,冷却称量固体质量减少6.2g,则原混合物中碳酸钠和碳酸氢钠的质量比为
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐3】小路同学欲探究实验室制CO2后某剩余废液的成分组成,其实验步骤及对应实验现象如下图所示:
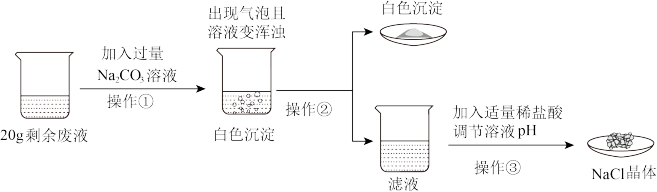
根据上述信息,试回答下列问题:
(1)由上图中的实验现象,可推知该剩余废液中的溶质组成为___________ (填序号)。
A 只有 CaCl2 B CaCl2 和 HCl C CaCl2 和 CaCO3
(2)写出步骤①中产生气体时发生反应的化学方程式___________ 。
(3)操作②的名称为___________ 。
(4)操作③中,用 pH 试纸粗略测定溶液 pH 的方法是_______
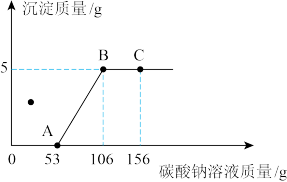
(5)在上述实验过程中,产生白色沉淀的质量与加入溶质质量分数为 10%的 Na2CO3 溶液的质量关系如图所示。试计算:该剩余废液中氯化钙的质量分数__________ ?(计算结果精确到 0.1%)

根据上述信息,试回答下列问题:
(1)由上图中的实验现象,可推知该剩余废液中的溶质组成为
A 只有 CaCl2 B CaCl2 和 HCl C CaCl2 和 CaCO3
(2)写出步骤①中产生气体时发生反应的化学方程式
(3)操作②的名称为
(4)操作③中,用 pH 试纸粗略测定溶液 pH 的方法是
(5)在上述实验过程中,产生白色沉淀的质量与加入溶质质量分数为 10%的 Na2CO3 溶液的质量关系如图所示。试计算:该剩余废液中氯化钙的质量分数

您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐1】某化学兴趣小组的同学为了体验“工业冶炼金属”的过程。在实验室做了CO还原CuO的实验,实验装置如下图。他们称得装有CuO粉末的试管重102g,反应完全后,恢复到室温称量,试管和固体残留物共重100.4g,并收集到CO2气体4.4g。

(1)图中A处实验现象是____ ,B中反应的化学方程式为____ ;
(2)酒精灯火焰上金属网罩的作用是__ ,该装置的缺陷是__ ;
(3)102g – 100.4g = 1.6g,1.6g表示____;(填序号)
(4)该反应制得铜的质量为__ 。(写出计算过程)

(1)图中A处实验现象是
(2)酒精灯火焰上金属网罩的作用是
(3)102g – 100.4g = 1.6g,1.6g表示____;(填序号)
| A.氧化铜的质量 | B.铜的质量 |
| C.实验后固体减少的质量 | D.氧化铜中氧元素的质量 |
(4)该反应制得铜的质量为
您最近一年使用:0次
综合应用题
|
较难
(0.4)
【推荐2】工业铁红主要成分是Fe2O3,还含有少量的FeO、Fe3O4
【查阅资料】(1)草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,化学方程式为:H2C2O4•3H2O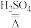 CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
(2)碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。
(3)铁的常见氧化物中铁的质量分数:
【问题讨论】为了测定铁红中铁的质量分数,小组间进行如下实验。(装置气密性良好)
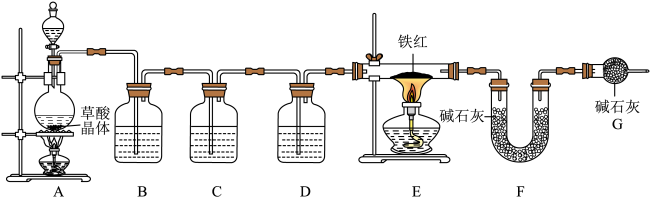
(1)该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是________ (填字母序号)
a.浓硫酸b.澄清的石灰水c氢氧化钠溶液
(2)C装置的作用是__________________________ 。
(3)写出E装置中所发生反应的一个化学方程式:_____________________ 。
(4)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①若E中充分反应后得到铁粉的质量为mg,则____ <m<______ 。
②若实验前后称得F装置增重7.7g,则此铁红中铁的质量分数是_________ 。
【实验反思】(1)如果缺少G装置(不考虑其他因素),则测得样品中铁的质量分数会________ (选填“偏小”“不变”“偏大”)。
(2)该实验装置的一个明显缺陷是___________________ 。
【查阅资料】(1)草酸晶体(H2C2O4•3H2O)在浓硫酸作用下受热分解,化学方程式为:H2C2O4•3H2O
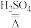 CO2↑+CO↑+H2O
CO2↑+CO↑+H2O(2)碱石灰是固体NaOH和CaO的混合物,能吸收水蒸气和二氧化碳。
(3)铁的常见氧化物中铁的质量分数:
| 铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
| 铁的质量分数 | 77.8% | 70.0% | 72.4% |
【问题讨论】为了测定铁红中铁的质量分数,小组间进行如下实验。(装置气密性良好)

(1)该实验为了保证进入E中的气体是纯净、干燥的CO,则B、C、D中的试剂依次是
a.浓硫酸b.澄清的石灰水c氢氧化钠溶液
(2)C装置的作用是
(3)写出E装置中所发生反应的一个化学方程式:
(4)称取铁红样品10.0g,用上述装置进行实验,测定铁红中铁的质量分数。
①若E中充分反应后得到铁粉的质量为mg,则
②若实验前后称得F装置增重7.7g,则此铁红中铁的质量分数是
【实验反思】(1)如果缺少G装置(不考虑其他因素),则测得样品中铁的质量分数会
(2)该实验装置的一个明显缺陷是
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐3】草酸亚铁晶体(FeC2O4·nH2O)是一种浅黄色固体,难溶于水。某兴趣小组利用铁锈制备草酸亚铁晶体并测定其组成。
(一)制备草酸亚铁晶体
资料1:FeSO4的溶解度如下表:
资料2:FeSO4易被氧气氧化,转化为Fe2(SO4)3。
资料3:草酸(H2C2O4)溶液与FeSO4溶液发生反应: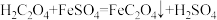
【制备流程】
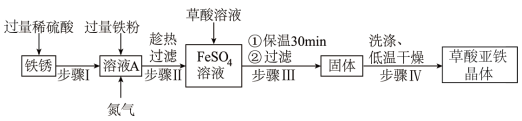
(1)在实验室进行“过滤”操作时,用到的玻璃仪器有___________ 、___________ 和玻璃棒,玻璃棒的作用是___________ 。
(2)已知步骤Ⅰ的反应之一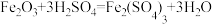 ,则溶液A中加入过量铁粉,发生的反应有:
,则溶液A中加入过量铁粉,发生的反应有: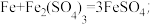
___________ 。步骤Ⅱ中趁热过滤的目的是___________ 。
(3)制备过程中,通入氮气的作用是___________ 。
(二)测定草酸亚铁晶体的组成
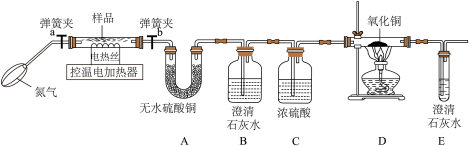
FeC2O4·nH2O加热至300℃完全失去结晶水,继续加热至400℃,剩余固体又变成黑色,同时生成气体。为确定分解产物及n的值,设计了下图所示实验。实验时先打开弹簧夹a、b,鼓入一段时间氮气,然后关闭a,加热热分解装置。
资料1:无水硫酸铜是白色固体,遇水变蓝;浓硫酸具有吸水性。
资料2:FeO是一种黑色固体,在空气中不稳定,易被氧化。
【实验设计】
【实验分析】
(4)实验过程中观察到:A中白色固体变蓝,证明产物有___________ :B中石灰水变浑浊,证明产物有CO2;D中___________ (填实验现象),证明产物有CO。
(5)上述实验装置不足之处是___________ 。
(6)为进一步探究加热至400℃时固体产物的成分,另取1.80gFeC2O4·nH2O重新实验,测得热分解装置中固体质量随温度变化如图所示。
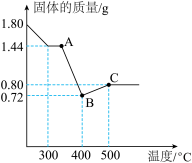
①FeC2O4·nH2O中n的值为___________ (写出计算过程)。
②若草酸亚铁晶体中混有杂质(杂质不参加反应),会导致测得的的值___________ (填“偏大”、“不变”或“偏小”)。
③B点物质的化学式为___________ 。
④将B点物质在空气中继续加热至500℃得到C点物质,BC段发生反应的化学反应方程式为___________ 。
(一)制备草酸亚铁晶体
资料1:FeSO4的溶解度如下表:
| 温度℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 溶解度/g | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 | 59.8 |
资料3:草酸(H2C2O4)溶液与FeSO4溶液发生反应:
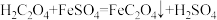
【制备流程】

(1)在实验室进行“过滤”操作时,用到的玻璃仪器有
(2)已知步骤Ⅰ的反应之一
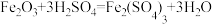 ,则溶液A中加入过量铁粉,发生的反应有:
,则溶液A中加入过量铁粉,发生的反应有: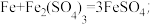
(3)制备过程中,通入氮气的作用是
(二)测定草酸亚铁晶体的组成
FeC2O4·nH2O加热至300℃完全失去结晶水,继续加热至400℃,剩余固体又变成黑色,同时生成气体。为确定分解产物及n的值,设计了下图所示实验。实验时先打开弹簧夹a、b,鼓入一段时间氮气,然后关闭a,加热热分解装置。
资料1:无水硫酸铜是白色固体,遇水变蓝;浓硫酸具有吸水性。
资料2:FeO是一种黑色固体,在空气中不稳定,易被氧化。
【实验设计】

【实验分析】
(4)实验过程中观察到:A中白色固体变蓝,证明产物有
(5)上述实验装置不足之处是
(6)为进一步探究加热至400℃时固体产物的成分,另取1.80gFeC2O4·nH2O重新实验,测得热分解装置中固体质量随温度变化如图所示。

①FeC2O4·nH2O中n的值为
②若草酸亚铁晶体中混有杂质(杂质不参加反应),会导致测得的的值
③B点物质的化学式为
④将B点物质在空气中继续加热至500℃得到C点物质,BC段发生反应的化学反应方程式为
您最近一年使用:0次




