实验室模拟炼铁(装置如图1)

已知B装置中的液体为过量的氢氧化钠和氢氧化钙混合溶液,氢氧化钠吸收二氧化碳能力比氢氧化钙强。请回答下列问题:
(1)实验过程中A处玻璃管中现象:______ ,写出该反应的化学方程式:______ 。
(2)实验装置按图2连接,请将以下四步按正确操作步骤排序:______ (填序号)。
a、点燃A处酒精喷灯 b、通入CO c、停止通入CO d、熄灭酒精喷灯
(3)实验装置图中虚线框内装置起到的作用有______ (填序号)。
A 收集一氧化碳 B 吸收二氧化碳 C 检验二氧化碳
(4)已知此反应过程中温度不同,可能生成铁的不同的氧化物。原固体Fe2O3质量为48.0g,现用热分析仪记录CO与Fe2O3进行反应时有关数据,得到固体质量与反应温度的关系曲线如图2所示。
①根据图像分析,写出D点时固体成分的化学式______ 。
②若B点生成物为一成分固定的化合物,请确定其化学式是______ 。
(5)某钢铁厂采用磁铁矿炼铁,日产含铁1.26×104t的生铁,至少需要含Fe3O480%的磁铁矿的质量是多少?______ (写出计算过程)

已知B装置中的液体为过量的氢氧化钠和氢氧化钙混合溶液,氢氧化钠吸收二氧化碳能力比氢氧化钙强。请回答下列问题:
(1)实验过程中A处玻璃管中现象:
(2)实验装置按图2连接,请将以下四步按正确操作步骤排序:
a、点燃A处酒精喷灯 b、通入CO c、停止通入CO d、熄灭酒精喷灯
(3)实验装置图中虚线框内装置起到的作用有
A 收集一氧化碳 B 吸收二氧化碳 C 检验二氧化碳
(4)已知此反应过程中温度不同,可能生成铁的不同的氧化物。原固体Fe2O3质量为48.0g,现用热分析仪记录CO与Fe2O3进行反应时有关数据,得到固体质量与反应温度的关系曲线如图2所示。
①根据图像分析,写出D点时固体成分的化学式
②若B点生成物为一成分固定的化合物,请确定其化学式是
(5)某钢铁厂采用磁铁矿炼铁,日产含铁1.26×104t的生铁,至少需要含Fe3O480%的磁铁矿的质量是多少?
更新时间:2021-04-04 19:17:27
|
相似题推荐
综合应用题
|
困难
(0.15)
【推荐1】已知在不同的温度下,CO与铁的氧化物反应能生成另一种铁的氧化物(或铁单质)和CO2。现利用下图1的实验装置进行实验,反应过程中管内的固体质量随温度的变化曲线如图2。

注:图1中的仪器甲是一种加热仪器,图2中A、B点的固体组成分别是FeO、Fe3O4中的一种。
(1)查阅资料发现,酒精灯加热时玻璃管的受热温度是400~500℃,酒精喷灯加热时玻璃管的受热温度是800~1200℃。实验室要利用图1来制取金属铁,仪器甲应选用的加热仪器是_____ (填“酒精灯”或“酒精喷灯”);图1装置中的现象有____ ;________ 。
(2)利用图2显示的相关信息,回答如下问题:
①在0~400℃温度范围内,管内固体质量不变,其原因是________ 。
②图中x=__ g。
计算过程:_____
③试据图计算并推断出A点固体的化学式是______ 。

注:图1中的仪器甲是一种加热仪器,图2中A、B点的固体组成分别是FeO、Fe3O4中的一种。
(1)查阅资料发现,酒精灯加热时玻璃管的受热温度是400~500℃,酒精喷灯加热时玻璃管的受热温度是800~1200℃。实验室要利用图1来制取金属铁,仪器甲应选用的加热仪器是
(2)利用图2显示的相关信息,回答如下问题:
①在0~400℃温度范围内,管内固体质量不变,其原因是
②图中x=
计算过程:
③试据图计算并推断出A点固体的化学式是
您最近一年使用:0次
综合应用题
|
困难
(0.15)
解题方法
【推荐2】铁及其化合物在工农业生产和生活中有广泛应用.

(1)图1为高炉炼铁示意图.从炉底流出的生铁属________ (填“金属单质”或“合金”).
下列作用中①与铁矿石发生反应生成铁 ②燃烧供热 ③除去铁矿石中少量杂质(如SiO2)④生成CO,属于从炉顶加入焦炭的作用有_________ (填字母).
A.①② B.①③ C.②③ D.②④
(2)实验室可用图2装置模拟工业炼铁并测定样品中氧化铁(Fe2O3)的质量分数(杂质不含铁元素,且不与CO反应)
【查阅资料】碱石灰能吸收二氧化碳和水蒸气
【问题讨论】装置B的作用是_______________________ ,从环保角度看该实验装置有一明显缺陷是:_________________ .
【数据处理】称取样品8.0g,用上述装置进行实验,充分反应后称量A装置增重4.4g.则 样品中氧化铁质量分数为___________ %.
【实验反思】当观察到反应管中固体全部变黑后,若立即停止通CO,则测得的样品中氧化铁的质量分数_________ (填“偏大”,“偏小”,“无影响”)
(3)废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),用于制备动物饲料硫酸亚铁的流程如下:

①反应器中发生的反应除了Fe2O3+3H2SO4=Fe2(SO4)3+3H2O和Fe+Fe2(SO4)3=3FeSO4外,还有_______________________ ;
②滤液M的溶质有____________________ ,操作1为___________________ ;
③FeSO4的溶解度和析出组成如下表.在操作2中,析出FeSO4•7H2O晶体的最高温度不超过___________ ℃.
(4)5.56g硫酸亚铁晶体(FeSO4•xH2O)隔绝空气受热分解时,生成金属氧化物和气体.固体产物的质量随温度变化的曲线如图3所示.
①0~t1℃,发生的变化是加热失去结晶水,x=__________ ;
②t2℃时B点固体组成只有一种,化学式为_____________ .

(1)图1为高炉炼铁示意图.从炉底流出的生铁属
下列作用中①与铁矿石发生反应生成铁 ②燃烧供热 ③除去铁矿石中少量杂质(如SiO2)④生成CO,属于从炉顶加入焦炭的作用有
A.①② B.①③ C.②③ D.②④
(2)实验室可用图2装置模拟工业炼铁并测定样品中氧化铁(Fe2O3)的质量分数(杂质不含铁元素,且不与CO反应)
【查阅资料】碱石灰能吸收二氧化碳和水蒸气
【问题讨论】装置B的作用是
【数据处理】称取样品8.0g,用上述装置进行实验,充分反应后称量A装置增重4.4g.则 样品中氧化铁质量分数为
【实验反思】当观察到反应管中固体全部变黑后,若立即停止通CO,则测得的样品中氧化铁的质量分数
(3)废铁屑的主要成份是铁,同时还有少量铁锈(Fe2O3),用于制备动物饲料硫酸亚铁的流程如下:

①反应器中发生的反应除了Fe2O3+3H2SO4=Fe2(SO4)3+3H2O和Fe+Fe2(SO4)3=3FeSO4外,还有
②滤液M的溶质有
③FeSO4的溶解度和析出组成如下表.在操作2中,析出FeSO4•7H2O晶体的最高温度不超过
| 温度t/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 |
| 溶解度S/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | 37.2 |
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||
①0~t1℃,发生的变化是加热失去结晶水,x=
②t2℃时B点固体组成只有一种,化学式为
您最近一年使用:0次
综合应用题
|
困难
(0.15)
解题方法
【推荐3】钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉炼铁,常用赤铁矿、焦炭、空气与石灰石作原料。已知赤铁矿被还原剂还原是逐级进行的,还原时温度及CO、CO2的体积分数随温度变化曲线如图所示。

(1)已知:反应a, ;
;
反应b,
反应c, ;
;
反应d, 。(条件见上图)
。(条件见上图)
以上反应都_____ 基本反应类型(填“属于”或“不属于”)。
(2)高炉炼铁采用赤铁矿,主要成分为____ (化学式)、焦炭等作原料。其中焦炭的作用①提供热量;②____________ (用化学反应方程式表示)。
①在温度低于570℃时,赤铁矿的还原分________ 个反应阶段完成(填数字)。
②若反应在800℃条件下进行,为得到FeO,应控制CO的体积分数的范围是______ 。
A 35%~65%
B 10%~75%
C 20%~90%
③为减少高炉排放尾气中CO的含量,下列措施可行的是____ 。
A 其它条件不变,无限增加高炉的高度
B 调节还原时的炉温
(3)工业上利用Fe3O4/FeO之间的循环转换在高温条件下裂解水制氢气的流程如下图所示。

①反应I的化学方程式为______________ ,对比反应I、II,铁的氧化物在循环裂解水制氢气过程中的作用是___________ 。理论上制得8g的氢气需要_____ g的C。
②为避免发生副反应得到Fe,阻碍循环反应的进行,反应II需控制的条件为温度不能高于570℃且_________ 。

(1)已知:反应a,
 ;
;反应b,

反应c,
 ;
;反应d,
 。(条件见上图)
。(条件见上图)以上反应都
(2)高炉炼铁采用赤铁矿,主要成分为
①在温度低于570℃时,赤铁矿的还原分
②若反应在800℃条件下进行,为得到FeO,应控制CO的体积分数的范围是
A 35%~65%
B 10%~75%
C 20%~90%
③为减少高炉排放尾气中CO的含量,下列措施可行的是
A 其它条件不变,无限增加高炉的高度
B 调节还原时的炉温
(3)工业上利用Fe3O4/FeO之间的循环转换在高温条件下裂解水制氢气的流程如下图所示。

①反应I的化学方程式为
②为避免发生副反应得到Fe,阻碍循环反应的进行,反应II需控制的条件为温度不能高于570℃且
您最近一年使用:0次
综合应用题
|
困难
(0.15)
【推荐1】氢气是密度最小的无色气体,被认为是最清洁的燃料。
(1)氢气燃烧的化学方程式为_________________ ,氢能源没有大量使用是因为_________________ (写一条即可)。
(2)氢气能夺取金属氧化物中的氧,使其还原为金属,如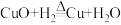 ,该实验可观察到的固体颜色由
,该实验可观察到的固体颜色由_________________ 。王峰同学根据氢气的还原性,在实验室用如图所示装置测定某赤铁矿中铁元素的质量分数,该赤铁矿中的主要成分是Fe2O3,还含有少量的FeO。C装置的硬质玻璃管中的固体物质是干燥的赤铁矿粉,旋钮a可以控制氢气的_________________ 。
(3)装置A中发生的化学反应方程式为_________________ 。
(4)装置B中试剂为_________________ 。

(5)若赤铁矿粉的质量为25 g,完全反应后,U型管E的质量增加了8.1 g。赤铁矿粉中铁元素的质量分数为_________________ 。
(6)反思与评价:U型管E右边连接干燥管F的目的是_________________ ,无干燥管F,则测得样品中铁的质量分数会_________________ (填“偏小”“不变”或“偏大”)。
(1)氢气燃烧的化学方程式为
(2)氢气能夺取金属氧化物中的氧,使其还原为金属,如
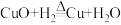 ,该实验可观察到的固体颜色由
,该实验可观察到的固体颜色由(3)装置A中发生的化学反应方程式为
(4)装置B中试剂为

(5)若赤铁矿粉的质量为25 g,完全反应后,U型管E的质量增加了8.1 g。赤铁矿粉中铁元素的质量分数为
(6)反思与评价:U型管E右边连接干燥管F的目的是
您最近一年使用:0次
综合应用题
|
困难
(0.15)
名校
【推荐2】今年扬州迎来高铁交通发展的高潮。高铁给我们带来的不仅是交通方便,出行快捷,甚至是带来旅游业的繁荣。制造铁轨需要大量的合金钢,梅岭中学化学兴趣小组为此展开探究:
(一)工业上炼铁炼钢和轧制钢材的主要流程如下图:

已知:生铁的含碳量为2%~4.3%,钢的含碳量为0.03%~2%。
(1)炼铁的固体原料中加入焦炭的作用是______________ 、___________ (用方程式表示);
(2)炼铁的固体原料需经过粉碎,其目的是____________________ 。
(3)热空气和高炉气体的主要成分有一种相同,这种气体是________ (填化学式);
(4)炼钢炉中,通入纯氧而不用空气的目的是____________________ 。将钢锭轧成钢板,体现了金属的________ 性。
(二)该兴趣小组发现未经处理的钢铁容易生锈。同学们接着探究了铁生锈的相关问题。
【知识回顾】铁生锈的条件为铁与_______ 、_______ 同时接触,为了防止铁制品生锈,应采取的措施是__________ (写出一种)。
【查阅资料】铁锈成分复杂,化学式可简单表示为Fe2O3•xH2O,在加热时会分步反应, 首先失去结晶水,其反应可表示为Fe2O3•nH2O=Fe2O3+nH2O浓硫酸可以吸水,碱石灰可以吸收水和二氧化碳。
【提出问题】铁锈(Fe2O3•nH2O)中n的值等于多少呢?
【问题探究】小明发现实验室中有一保管不善的铁粉,大部分已经结块成红褐色,为了探究铁锈(Fe2O3•nH2O)的组成,称取27.0g这种铁粉样品,按如图2所示装置进行实验。

(1)实验前应先_______________ ;
(2)为了保证实验安全,实验开始时应先__________ ,目的是_______________ ;
(3)A中的现象是________________ ;
(4)请指出该装置中有一处明显不足_____________ ;
【数据处理】如图是加热时间和A中固体质量关系图象,下表是B、C中质量不再变化时B中浓硫酸、C中碱石灰装置质量变化情况。

(5)铁锈(Fe2O3•nH2O)中n的值是_____ ;
(6)写出T3-T4时间段发生反应的化学方程式_______________________ ;
(7)计算原样品中单质铁的质量分数是________ 。(计算结果保留到0.1%)
(一)工业上炼铁炼钢和轧制钢材的主要流程如下图:

已知:生铁的含碳量为2%~4.3%,钢的含碳量为0.03%~2%。
(1)炼铁的固体原料中加入焦炭的作用是
(2)炼铁的固体原料需经过粉碎,其目的是
(3)热空气和高炉气体的主要成分有一种相同,这种气体是
(4)炼钢炉中,通入纯氧而不用空气的目的是
(二)该兴趣小组发现未经处理的钢铁容易生锈。同学们接着探究了铁生锈的相关问题。
【知识回顾】铁生锈的条件为铁与
【查阅资料】铁锈成分复杂,化学式可简单表示为Fe2O3•xH2O,在加热时会分步反应, 首先失去结晶水,其反应可表示为Fe2O3•nH2O=Fe2O3+nH2O浓硫酸可以吸水,碱石灰可以吸收水和二氧化碳。
【提出问题】铁锈(Fe2O3•nH2O)中n的值等于多少呢?
【问题探究】小明发现实验室中有一保管不善的铁粉,大部分已经结块成红褐色,为了探究铁锈(Fe2O3•nH2O)的组成,称取27.0g这种铁粉样品,按如图2所示装置进行实验。

(1)实验前应先
(2)为了保证实验安全,实验开始时应先
(3)A中的现象是
(4)请指出该装置中有一处明显不足
【数据处理】如图是加热时间和A中固体质量关系图象,下表是B、C中质量不再变化时B中浓硫酸、C中碱石灰装置质量变化情况。
反应前(g) | 反应后(g) | |
B | 100 | 105.4 |
C | 150 | 163.2 |

(5)铁锈(Fe2O3•nH2O)中n的值是
(6)写出T3-T4时间段发生反应的化学方程式
(7)计算原样品中单质铁的质量分数是
您最近一年使用:0次
综合应用题
|
困难
(0.15)
解题方法
【推荐3】铁制品在生活中有着广泛的应用。
Ⅰ、铁的冶炼,竖炉炼铁的工艺流程如图1所示。
(1)图1中CH4的作用除了提供能量还有_____________ 。
(2)写出“还原反应室”中炼铁的一个反应的化学方程式_____________ 。
(3)CH4与高温尾气中的CO2或H2O都能反应生成CO和H2,则16gCH4在催化反应室中完全反应后,理论上得到H2的质量(m)范围是:4≤m≤___________ 。

(4)利用Fe-C混合物(铁屑和活性炭)处理舍有Cu(NO3)2,Pb(NO3)2和Zn(NO3)2的化工废水。在同条件下,含铁量不同的Fe-C混合物对不同离子的去除率,结果如图2所示。
①含Fe量为100%时,水中的Cu2+、Pb2+能被除去、而Zn2+不能被除去,其原因是___________ 。
②含Fe量为0%时,也能除去水中少量的重金属离子,利用了活性炭的__________ 。
Ⅱ、铁的应用和防护
(5)某麦片中含微量Fe粉,食用后Fe粉与胃酸反应,反应的化学方程式为__________ 。
(6)冬季取暖人们常用到暖宝宝,其热量来源于铁的缓慢氧化。已知暖宝宝的主要成分为Fe粉、C粉和少量NaCl,暖宝宝反应的主要原理是铁粉与氧气、水共同作用生成氢氧化铁,写出该反应的化学方程式:________________ ,NaCl的作用是__________ 。
Ⅲ、铁及其化合物的实验
(一)硫酸亚铁铵晶体(俗称摩尔盐)化学式为 xFeSO4·y(NH4)2 SO4·zH2O,是一种重要的化工原料,用途十分广泛。某同学制备硫酸亚铁铵晶体并设计实验测定其组成。

(7)步骤②中一系列操作包括:蒸发浓缩、__________ 、过滤、洗涤等。
(8)步骤③中中使用乙醇汽油洗涤可以快速晾干。这样做的优点是___________ 。
A 避免用水洗涤所造成的晶体损耗
B 酒精易挥发,可低温晾干晶体
(二)硫酸亚铁铵晶体的组成及热分解实验
兴趣小组称取此晶体样品78.4g,在科研人员的指导下用下图装置进行热分解实验。

【查阅资料】①硫酸亚铁铵晶体在200℃完全失去结晶水,剩余物在500℃完全分解为氧化铁、SO2、SO3、NH3和H2O。碱石灰不吸收NH3。
②1400℃后氧化铁隔绝空气能续继分解生成铁的某种氧化物。
(9)加热前后及过程中均通入N2,200℃停止加热后继续通N2的目的是防止倒吸和_____________ 。
(10)控制温度在不同的范围对A中样品加热,测得装置B和C中的质量变化如下表。并测得装置A剩余固体质量随温度的变化如下图所示。

①根据数据,硫酸亚铁铵晶体中,x:y:z=_______________
②写出B点的化学式_________________ 。
③写出E到F段发生反应的化学方程式________________ 。
Ⅰ、铁的冶炼,竖炉炼铁的工艺流程如图1所示。
(1)图1中CH4的作用除了提供能量还有
(2)写出“还原反应室”中炼铁的一个反应的化学方程式
(3)CH4与高温尾气中的CO2或H2O都能反应生成CO和H2,则16gCH4在催化反应室中完全反应后,理论上得到H2的质量(m)范围是:4≤m≤

(4)利用Fe-C混合物(铁屑和活性炭)处理舍有Cu(NO3)2,Pb(NO3)2和Zn(NO3)2的化工废水。在同条件下,含铁量不同的Fe-C混合物对不同离子的去除率,结果如图2所示。
①含Fe量为100%时,水中的Cu2+、Pb2+能被除去、而Zn2+不能被除去,其原因是
②含Fe量为0%时,也能除去水中少量的重金属离子,利用了活性炭的
Ⅱ、铁的应用和防护
(5)某麦片中含微量Fe粉,食用后Fe粉与胃酸反应,反应的化学方程式为
(6)冬季取暖人们常用到暖宝宝,其热量来源于铁的缓慢氧化。已知暖宝宝的主要成分为Fe粉、C粉和少量NaCl,暖宝宝反应的主要原理是铁粉与氧气、水共同作用生成氢氧化铁,写出该反应的化学方程式:
Ⅲ、铁及其化合物的实验
(一)硫酸亚铁铵晶体(俗称摩尔盐)化学式为 xFeSO4·y(NH4)2 SO4·zH2O,是一种重要的化工原料,用途十分广泛。某同学制备硫酸亚铁铵晶体并设计实验测定其组成。

(7)步骤②中一系列操作包括:蒸发浓缩、
(8)步骤③中中使用乙醇汽油洗涤可以快速晾干。这样做的优点是
A 避免用水洗涤所造成的晶体损耗
B 酒精易挥发,可低温晾干晶体
(二)硫酸亚铁铵晶体的组成及热分解实验
兴趣小组称取此晶体样品78.4g,在科研人员的指导下用下图装置进行热分解实验。

【查阅资料】①硫酸亚铁铵晶体在200℃完全失去结晶水,剩余物在500℃完全分解为氧化铁、SO2、SO3、NH3和H2O。碱石灰不吸收NH3。
②1400℃后氧化铁隔绝空气能续继分解生成铁的某种氧化物。
(9)加热前后及过程中均通入N2,200℃停止加热后继续通N2的目的是防止倒吸和
(10)控制温度在不同的范围对A中样品加热,测得装置B和C中的质量变化如下表。并测得装置A剩余固体质量随温度的变化如下图所示。
| 温度/℃ | 室温 | 200 | 500 |
| B装置/g | 200.00 | 221.6 | 255.60 |
| C装置/g | 100.00 | 100.00 | 106.80 |

①根据数据,硫酸亚铁铵晶体中,x:y:z=
②写出B点的化学式
③写出E到F段发生反应的化学方程式
您最近一年使用:0次
综合应用题
|
困难
(0.15)
解题方法
【推荐1】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡与Cl2(黄绿色气体,有毒)反应制备SnCl4,某小组拟设计实验制备无水四氯化锡。
Ⅰ、查阅资料,得知:
2KMnO4+16HCl=2KCl + 2MnCl2 +5Cl2↑ +8H2O
Ⅱ、设计实验,装置如图

回答下列问题:
(1)A导管的作用______ ,Ⅱ中饱和NaCl的作用______ 。
(2)装置Ⅳ中反应的化学方程式______ 。
(3)装置Ⅴ中冷水的作用______ ,装置Ⅵ的作用是______ 。
(4)为防止产品中带入副产物 SnCl2,要控制反应的温度范围在______ 。
(5)SnCl4遇水蒸气剧烈反应的化学方程式______ 。
Ⅲ、最后进行产品纯度测定:
(6)取wg SnCl4产品用足量蒸馏水吸收得到吸收液250mL。准确量取 25.00mL吸收液于锥形瓶中,恰好与mg质量分数为c%的AgNO3溶液反应(杂质不参与反应,SnCl4、AgNO3的相对分子质量分别为261、170)。利用上述数据计算产品纯度为______ (用含 w、c、m的代数式表示)。
Ⅰ、查阅资料,得知:
| 性质 物质 | 物理性质 | 化学性质 |
| Sn | 熔点:232℃ | |
| SnCl2 | 熔点:246℃,沸点:652℃ | |
| SnCl4 | 熔点:-33℃,沸点:114℃ | 遇水蒸气剧烈反应,一种产物是 ,另一种产物在空气中产生白雾 ,另一种产物在空气中产生白雾 |
Ⅱ、设计实验,装置如图

回答下列问题:
(1)A导管的作用
(2)装置Ⅳ中反应的化学方程式
(3)装置Ⅴ中冷水的作用
(4)为防止产品中带入副产物 SnCl2,要控制反应的温度范围在
(5)SnCl4遇水蒸气剧烈反应的化学方程式
Ⅲ、最后进行产品纯度测定:
(6)取wg SnCl4产品用足量蒸馏水吸收得到吸收液250mL。准确量取 25.00mL吸收液于锥形瓶中,恰好与mg质量分数为c%的AgNO3溶液反应(杂质不参与反应,SnCl4、AgNO3的相对分子质量分别为261、170)。利用上述数据计算产品纯度为
您最近一年使用:0次
【推荐2】某研究性小组在实验室中模拟炼铁化学原理的实验。

I.定性探究
在一定温度下,该小组同学用一氧化碳还原纯净的氧化铁(实验装置如图),从环保角度看,该小组设计的实验装置有不足之处,你认为该如何改进?_____ ,观察到玻璃管内固体由红色全部变为黑色。
小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家分头查阅资料。
【查阅资料】
(1)一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关。
(2)一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁。
(3)
【实验与猜想】
(1)该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体全部能被吸引,则该黑色固体中不可能含有_____ 。
(2)进行猜想:黑色固体可能
a.全部为铁 b._____ c._____
Ⅱ.定量探究
取上述研磨后的黑色固体20g,设计如下实验:

(1)小明同学的猜想_____ (填“是”或“否”)成立。
(2)通过计算,确定20g黑色固体的成分及质量_____ (请写出计算过程)。
【继续实验】
若要从以上探究所得FeSO4、CuSO4的混合溶液中回收铜和硫酸亚铁晶体,可设计如下实验方案:

(1)步骤①中,金属X是_____ ;
(2)步骤②中,加入过量稀硫酸的目的是_____ 。发生反应的化学方程式为_____ 。

I.定性探究
在一定温度下,该小组同学用一氧化碳还原纯净的氧化铁(实验装置如图),从环保角度看,该小组设计的实验装置有不足之处,你认为该如何改进?
小明同学认为该黑色固体全部是铁,但小华同学提出了质疑,于是大家分头查阅资料。
【查阅资料】
(1)一氧化碳还原氧化铁的固体产物的成分与反应温度、反应时间等因素有关。
(2)一氧化碳还原氧化铁的实验过程中固体产物可能有四氧化三铁、氧化亚铁、铁。
(3)
| 性质 | 四氧化三铁 | 氧化亚铁 | 铁粉 |
| 颜色 | 黑色 | 黑色 | 黑色 |
| 能否被磁铁吸引 | 能 | 不能 | 能 |
(1)该小组同学将反应后的黑色固体研磨后,再用磁铁吸引,发现黑色固体全部能被吸引,则该黑色固体中不可能含有
(2)进行猜想:黑色固体可能
a.全部为铁 b.
Ⅱ.定量探究
取上述研磨后的黑色固体20g,设计如下实验:

(1)小明同学的猜想
(2)通过计算,确定20g黑色固体的成分及质量
【继续实验】
若要从以上探究所得FeSO4、CuSO4的混合溶液中回收铜和硫酸亚铁晶体,可设计如下实验方案:

(1)步骤①中,金属X是
(2)步骤②中,加入过量稀硫酸的目的是
您最近一年使用:0次



