如图是某反应的微观示意图。

(1)表中的四种物质中,属于氧化物的是_____ ,属于单质的是______ ,此图说明化学反应前后发生改变的微粒是______ (填“分子”或“原子”)。
(2)它们在反应前后的质量如下表所示,求b的值(写出计算过程)。
(3)请在下表中用虚线绘制出各物质反应后质量。


(1)表中的四种物质中,属于氧化物的是
(2)它们在反应前后的质量如下表所示,求b的值(写出计算过程)。
| 物质序号 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 88 | 100 | 2 | 0 |
| 反应后质量/g | 0 | a | b | c |

更新时间:2023-02-25 10:22:59
|
相似题推荐
综合应用题
|
较难
(0.4)
【推荐1】在生产生活中,金属锰及其化合物用途广泛。
(一)对金属锰及其化合物的认识
(1)植物生长需要微量的锰,这里的锰是指 (选填序号)。
(2)地铁列车的钢轨材料是高锰钢(主要成分铁、锰、碳),高锰钢属于________ 选填“纯净物”或“混合物”)。车身作喷漆处理既美观又防锈,其防锈原理是______ 。
(3)华为手机使用的是锂电池,锂电池质量轻、容量大,其反应原理是锂与二氧化锰反应生成亚锰酸锂(LiMnO2),该反应的化学方程式是______ 。
(4)菱锰矿(主要成分是MnCO3,含少量FeCO3),向一定量矿石中加入稀盐酸,观察到有大量气泡产生,且反应前后金属元素的化合价保持不变,推断反应后溶液中含有的金属阳离子主要是______ (填离子符号)。
(二)碳酸锰的制备
MnCO3是一种高性能磁性材料。以软锰矿(主要成分为MnO2)为原料制备MnCO3的主要流程如下。已知:MnCO3难溶于水,在100℃时开始分解。

(5)原料软锰矿在使用之前通常需粉碎,其目的是_______ 。
(6)已知 X 是一种常见的无色液体,则反应②的化学方程式为_______ 。
(7)反应②中加入NH4HCO3溶液时,往往需要控制温度在30~35℃,温度不宜过高的原因是_______ (用化学方程式表示)。
(8)产品 MnCO3(Ⅱ)比MnCO3(Ⅰ)更纯净,原因是产品MnCO3(Ⅰ)经过洗涤、烘干后,表面附着的水及_______ 等杂质已被除去。
(9)为了获得纯净的MnCO3,烘干时需要控制的条件是_______ 。
(三)碳酸锰热分解产物的研究
MnCO3及锰的氧化物加热分解的温度如下。
MnCO3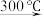 MnO2
MnO2 MnaOb
MnaOb MnO
MnO
称取4.60gMnCO3样品置于装置A中,进行热分解实验。控制不同的温度对样品加热,测得剩余固体质量随温度的变化如图2所示。

(10)通入空气,焙烧MnCO3到300℃时,观察到装置B中澄清石灰水变浑浊,写出装置A中反应的化学方程式为_______ 。
(11)加热至300-900℃时,锰的氧化物分解会分解产生一种常见气体,该气体为_______ 。
(12)当加热到800℃时,N点固体的成分是_______ ,对应物质的质量比为_______ 。
(一)对金属锰及其化合物的认识
(1)植物生长需要微量的锰,这里的锰是指 (选填序号)。
| A.原子 | B.元素 | C.单质 |
(3)华为手机使用的是锂电池,锂电池质量轻、容量大,其反应原理是锂与二氧化锰反应生成亚锰酸锂(LiMnO2),该反应的化学方程式是
(4)菱锰矿(主要成分是MnCO3,含少量FeCO3),向一定量矿石中加入稀盐酸,观察到有大量气泡产生,且反应前后金属元素的化合价保持不变,推断反应后溶液中含有的金属阳离子主要是
(二)碳酸锰的制备
MnCO3是一种高性能磁性材料。以软锰矿(主要成分为MnO2)为原料制备MnCO3的主要流程如下。已知:MnCO3难溶于水,在100℃时开始分解。

(5)原料软锰矿在使用之前通常需粉碎,其目的是
(6)已知 X 是一种常见的无色液体,则反应②的化学方程式为
(7)反应②中加入NH4HCO3溶液时,往往需要控制温度在30~35℃,温度不宜过高的原因是
(8)产品 MnCO3(Ⅱ)比MnCO3(Ⅰ)更纯净,原因是产品MnCO3(Ⅰ)经过洗涤、烘干后,表面附着的水及
(9)为了获得纯净的MnCO3,烘干时需要控制的条件是
(三)碳酸锰热分解产物的研究
MnCO3及锰的氧化物加热分解的温度如下。
MnCO3
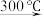 MnO2
MnO2 MnaOb
MnaOb MnO
MnO称取4.60gMnCO3样品置于装置A中,进行热分解实验。控制不同的温度对样品加热,测得剩余固体质量随温度的变化如图2所示。

(10)通入空气,焙烧MnCO3到300℃时,观察到装置B中澄清石灰水变浑浊,写出装置A中反应的化学方程式为
(11)加热至300-900℃时,锰的氧化物分解会分解产生一种常见气体,该气体为
(12)当加热到800℃时,N点固体的成分是
您最近一年使用:0次
综合应用题
|
较难
(0.4)
名校
【推荐2】以下是某同学在学习质量守恒定律时记的学习笔记,请你帮他一起整理完成:
(1)在化学变化中,下列说法正确的是( )
①原子的种类、元素的种类、分子的种类均不变
②原子的数目、分子的数目均不变
③原子的质量、元素的质量、物质的总质量均不变
④原子的种类、数量、质量均不变
A ①②
B ①③
C ③④
D ②④
(2)某纯净物X燃烧的化学方程式为: ,则X的化学式是
,则X的化学式是( )
A CH2O B C2H4 C CH4O D CH4
(3)在一个密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下发生反应,一段时间后,测得有关数据如下表,则关于此反应,认识不正确的是( )
A 该反应的基本化学反应类型为化合反应
B 反应后甲物质的质量值x=15
C 此反应中乙物质和丁物质的质量比为5:4
D 物质丙一定是反应的催化剂
(4)3.0g某纯净物完全燃烧后生成4.4g二氧化碳和1.8g水,则对该物质相关判断正确的是( )
A 该物质只含碳、氢元素
B 该物质一定含有碳、氢元素,可能含有氧元素
C 该物质由碳、氢、氧元素组成
D 该物质分子中碳原子和氢原子的个数比为1:2
(5)如图为某化学反应的微观模拟示意图,下列有关该反应的说法中,正确的是( )

A 四示中x的值为4
B 该反应中甲丁是化合物,乙丙是单质
C 参加反应的甲、乙两物质的质量比为17:24
D 反应前后氮元素的化合价没有发生改变
(1)在化学变化中,下列说法正确的是
①原子的种类、元素的种类、分子的种类均不变
②原子的数目、分子的数目均不变
③原子的质量、元素的质量、物质的总质量均不变
④原子的种类、数量、质量均不变
A ①②
B ①③
C ③④
D ②④
(2)某纯净物X燃烧的化学方程式为:
 ,则X的化学式是
,则X的化学式是A CH2O B C2H4 C CH4O D CH4
(3)在一个密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下发生反应,一段时间后,测得有关数据如下表,则关于此反应,认识不正确的是
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 20 | 3 | 2 | 20 |
| 反应后质量/g | x | 28 | 2 | 0 |
A 该反应的基本化学反应类型为化合反应
B 反应后甲物质的质量值x=15
C 此反应中乙物质和丁物质的质量比为5:4
D 物质丙一定是反应的催化剂
(4)3.0g某纯净物完全燃烧后生成4.4g二氧化碳和1.8g水,则对该物质相关判断正确的是
A 该物质只含碳、氢元素
B 该物质一定含有碳、氢元素,可能含有氧元素
C 该物质由碳、氢、氧元素组成
D 该物质分子中碳原子和氢原子的个数比为1:2
(5)如图为某化学反应的微观模拟示意图,下列有关该反应的说法中,正确的是

A 四示中x的值为4
B 该反应中甲丁是化合物,乙丙是单质
C 参加反应的甲、乙两物质的质量比为17:24
D 反应前后氮元素的化合价没有发生改变
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐3】世界上每年因锈蚀而报废的金属设备和材料高达产量的20%~40%。
(1)某实验小组对铁的锈蚀通过如图1实验可知,温度越高,铁钉生锈速率越________________ (填“慢”或“快”),在________________ (填“稀醋酸”、“水”或“稀氨水”)中铁钉生锈速率较快。
(2)实验二:为探究铁锈的成分,利用如图2所示装置(夹持仪器已省路)进行实验(每步反应和吸收均完全)。
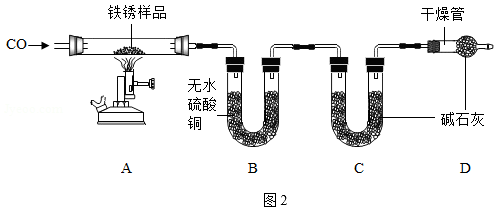
【查阅资料】无水硫酸铜吸水会由白色变为蓝色,碱石灰既能吸水,也能吸收CO2。
【进行实验】
①指出如图所示实验装置的一个明显缺陷__________ 。
②加热前,先通一段时间CO的目的是___________ 。
③将一定质量铁锈样品加热,样品逐渐变黑,无水硫酸铜逐渐变蓝,说明铁锈中一定含有______________ 元素。
【实验记录】
④根据上表数据可以确定铁锈的成分。若用FexOy﹒nH2O表示,当x:y=2:3时,n=______________ 。
⑤若缺少装置D,则x:y的值将_______________ (填“偏大”、“偏小”或“无影响”)。
⑥泉泉欲通过类比上述实验,使用如图所示装置探究镁条在空气中生锈的条件,已知镁条生锈的产物为碱式碳酸镁【Mg3(OH)2(CO3)2】,则试管内可选用的物质有:①O2②水③CO2④O2和CO2⑤CO2和水⑥O2和水⑦O2、CO2和水
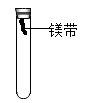
⑦至少需要选择___________ (填序号)做对照实验,才能达到探究镁条生锈的条件。
⑧写出镁条在空气中生锈的化学方程式_______________ 。
⑨写出稀硫酸和铁反应的方程式______________ 。
(1)某实验小组对铁的锈蚀通过如图1实验可知,温度越高,铁钉生锈速率越
| 实验图示 | 1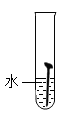 | 2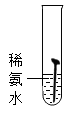 | 3 | 4 | 5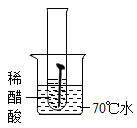 |
| 生锈时间 | 8min | 较长时间不生锈 | 5min | 3min | 1min |

【查阅资料】无水硫酸铜吸水会由白色变为蓝色,碱石灰既能吸水,也能吸收CO2。
【进行实验】
①指出如图所示实验装置的一个明显缺陷
②加热前,先通一段时间CO的目的是
③将一定质量铁锈样品加热,样品逐渐变黑,无水硫酸铜逐渐变蓝,说明铁锈中一定含有
| 铁锈样品的质量/g | 装置B的质量/g | 装置C的质量/g | |
| 反应前 | 23.2 | 232.4 | 198.2 |
| 反应后 | / | 239.6 | 211.4 |
④根据上表数据可以确定铁锈的成分。若用FexOy﹒nH2O表示,当x:y=2:3时,n=
⑤若缺少装置D,则x:y的值将
⑥泉泉欲通过类比上述实验,使用如图所示装置探究镁条在空气中生锈的条件,已知镁条生锈的产物为碱式碳酸镁【Mg3(OH)2(CO3)2】,则试管内可选用的物质有:①O2②水③CO2④O2和CO2⑤CO2和水⑥O2和水⑦O2、CO2和水

⑦至少需要选择
⑧写出镁条在空气中生锈的化学方程式
⑨写出稀硫酸和铁反应的方程式
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐1】化学是一门以实验为基础的科学,化学的很多重大发现和研究成果都是通过实验得到的。
(1)下列对实验现象或结论的叙述正确的是 (填序号)。
(2)水是生命之源,生活中离不开水。

①如图所示的电解水实验,试管A与试管B中气体的质量比为_________ ,发生反应的化学方程式是_________ 。
②生活中如何鉴别硬水与软水________ ?
(3)将一定量的锌、铝放入硝酸银溶液中充分反应,过滤,向滤渣中加入稀盐酸有气泡冒出。写出向滤渣中滴加稀盐酸时可能发生反应的化学方程式________ (写出一个即可)。
(4)滤液的质量________ (填“>”“=”或“<”)硝酸银溶液的质量。
(5)实验室制取干燥的氢气,所选用装置的连接顺序为_________ (填端口字母)。

(6)某兴趣小组用过氧化氢溶液和二氧化锰来制取氧气。实验过程中测得不同时刻装置和药品总质量随时间变化的数据如表所示。请计算参加反应的过氧化氢的质量是多少克?
(1)下列对实验现象或结论的叙述正确的是 (填序号)。
| A.硫在空气中燃烧发出明亮的蓝紫色火焰 |
| B.红磷在空气中燃烧产生大量烟雾 |
| C.铁与稀盐酸反应生成氯化铁和氢气 |
| D.镁条在空气中燃烧发出耀眼白光 |
(2)水是生命之源,生活中离不开水。

①如图所示的电解水实验,试管A与试管B中气体的质量比为
②生活中如何鉴别硬水与软水
(3)将一定量的锌、铝放入硝酸银溶液中充分反应,过滤,向滤渣中加入稀盐酸有气泡冒出。写出向滤渣中滴加稀盐酸时可能发生反应的化学方程式
(4)滤液的质量
(5)实验室制取干燥的氢气,所选用装置的连接顺序为

(6)某兴趣小组用过氧化氢溶液和二氧化锰来制取氧气。实验过程中测得不同时刻装置和药品总质量随时间变化的数据如表所示。请计算参加反应的过氧化氢的质量是多少克?
| 时刻 | t0 | t1 | t2 | t3 |
| 装置和药品总质量/g | 243.0 | 242.2 | 241.4 | 241.4 |
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐2】人类生活离不开金属。
(1)铁是生活中常用的金属。下图是某“取暖片”外包装的图片。该“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,其发热是利用铁生锈时会放热。

①发热剂需接触到空气才会发热,原因是铁要与_______ 等物质共同作用才会生锈。生活中防止铁生锈的方法________ .
②推测发热剂成分中氯化钠的作用是_________ 。目前世界上产量最高的金属是铁,炼铁的原理是利用一氧化碳还原氧化铁,请写出该反应的化学方程式_________ .
(2)将一定质量的锌加入硝酸镁、硝酸铜、硝酸银的混合溶液中,充分反应后过滤,得到滤渣和滤液,下列说法不正确的是________ .
①滤渣中一定有银,可能有铜、锌、镁
②若滤渣中有铜,则滤液中一定有硝酸镁、硝酸锌,可能有硝酸铜,一定没有硝酸银
③若向滤液中加入稀盐酸,无现象,则滤渣中可能有锌和铜,一定有银
④若向滤渣中加入稀盐酸,无气泡产生,则滤液组成有3种情况
(3)现有一包由5.6g铁、7.2g镁、1.4g银的混合粉末加到一定量的硝酸铜溶液中。实验结束后,测得剩余固体中含有三种物质,则剩余固体的质量可能是_______.
(1)铁是生活中常用的金属。下图是某“取暖片”外包装的图片。该“取暖片”中发热剂主要成分有铁粉、活性炭、氯化钠、水等,其发热是利用铁生锈时会放热。

①发热剂需接触到空气才会发热,原因是铁要与
②推测发热剂成分中氯化钠的作用是
(2)将一定质量的锌加入硝酸镁、硝酸铜、硝酸银的混合溶液中,充分反应后过滤,得到滤渣和滤液,下列说法不正确的是
①滤渣中一定有银,可能有铜、锌、镁
②若滤渣中有铜,则滤液中一定有硝酸镁、硝酸锌,可能有硝酸铜,一定没有硝酸银
③若向滤液中加入稀盐酸,无现象,则滤渣中可能有锌和铜,一定有银
④若向滤渣中加入稀盐酸,无气泡产生,则滤液组成有3种情况
(3)现有一包由5.6g铁、7.2g镁、1.4g银的混合粉末加到一定量的硝酸铜溶液中。实验结束后,测得剩余固体中含有三种物质,则剩余固体的质量可能是_______.
| A.240.8g | B.25.8g | C.26.8g | D.27.8g |
您最近一年使用:0次
综合应用题
|
较难
(0.4)
名校
解题方法
【推荐3】某一化学兴趣小组,小青和小竹两位同学在实验室各自完成了一个自己感兴趣的实验。小青的实验为:碳和氧化铜混合高温加热;小竹的实验为:用氯酸钾和二氧化锰混合加热至不再产生气体。实验完成后,两位同学将反应后的剩余物质倒入同一废液缸,得到固体混合物A。为了确定固体混合物A的成分,两位同学设计了如下实验方案,请回答:
【资料】二氧化锰不与稀盐酸反应

(1)上述实验中的白色沉淀的化学式为_________ 。
(2)黑色固体的成分是_________ 。
(3)小竹同学分析完上述实验方案后发现上述实验方案并不能完全确定混合物A的成分,请你在上述实验方案的基础上稍加改动步骤二和步骤三,从而确定混合物A的成分。实验改进方案是_______________ (不能使用上述实验方案未涉及的其他物质,不要画图,请用文字简单描述)。
(4)碳和氧化铜高温条件下制取铜,若需要制取64g铜,理论上至少需要_________ g氧化铜。
【资料】二氧化锰不与稀盐酸反应

(1)上述实验中的白色沉淀的化学式为
(2)黑色固体的成分是
(3)小竹同学分析完上述实验方案后发现上述实验方案并不能完全确定混合物A的成分,请你在上述实验方案的基础上稍加改动步骤二和步骤三,从而确定混合物A的成分。实验改进方案是
(4)碳和氧化铜高温条件下制取铜,若需要制取64g铜,理论上至少需要
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐1】某小组同学调查了市面上几种家用清洁剂的功能和有效成分,结果如下表。
(1)这三种清洁剂的有效成分中属于氧化物的是______ (填化学式);
(2)“漂白水”的有效成分是NaClO,能与HCl发生化学反应产生有毒的氯气(Cl2),化学方程式为______ 。所以漂白水和洁厕灵不能混合使用。
(3)该小组同学在实验室用红色布条探究“彩漂液”有效成分H2O2的漂白性,实验方案如下表所示。
资料:10%表示浓度,10%双氧水表示每100g双氧水中含有H2O2的质量为10g。
①通过以上实验得出结论:影响双氧水漂白性的因素除NaOH溶液外,还有______ 和______ 。
②本实验探究利用的科学方法是______ (填“控制变量法”,“假设实验法”或“模型研究法”)。
③欲进一步探究NaOH溶液的用量对双氧水的漂白性的影响,可补充实验:另取一条红色布条,______ (写出主要实验操作),观察实验现象。
(4)工业上常将干燥的氯气通入NaOH溶液中制得漂白水,反应的化学方程式是:______ ;
(5)若要制出NaClO含量16.9%的漂白水500kg,需要氢氧化钠多少千克?
| 清洁剂 | 洁厕灵 | 彩漂液 | 漂白水 |
| 功能 | 清除污垢,除异味 | 漂洗衣物,使色彩鲜艳 | 漂除衣物污渍 |
| 有效成分 | HCl | H2O2 | NaClO |
(1)这三种清洁剂的有效成分中属于氧化物的是
(2)“漂白水”的有效成分是NaClO,能与HCl发生化学反应产生有毒的氯气(Cl2),化学方程式为
(3)该小组同学在实验室用红色布条探究“彩漂液”有效成分H2O2的漂白性,实验方案如下表所示。
资料:10%表示浓度,10%双氧水表示每100g双氧水中含有H2O2的质量为10g。
| 实验Ⅰ | 实验Ⅱ | 实验Ⅲ | 实验Ⅳ |
|
|
|
|
| 20分钟后布条无明显变化 | 20分钟后布条颜色稍变浅 | 20分钟后布条颜色明显变浅 | 1分钟后布条红色褪去 |
②本实验探究利用的科学方法是
③欲进一步探究NaOH溶液的用量对双氧水的漂白性的影响,可补充实验:另取一条红色布条,
(4)工业上常将干燥的氯气通入NaOH溶液中制得漂白水,反应的化学方程式是:
(5)若要制出NaClO含量16.9%的漂白水500kg,需要氢氧化钠多少千克?
您最近一年使用:0次
综合应用题
|
较难
(0.4)
名校
解题方法
【推荐2】生活中常用的过氧乙酸和过氧化氢溶液消毒剂及其使用注意事项:见光或受热易分解,有腐蚀性、有灼伤危险。


(1)下列有关上述消毒剂的分析,错误的是_______。
(2)某兴趣小组打算用如图1所示的整瓶溶液配制溶质质量分数为10%的过氧化氢溶液,需加水___ mL。在配制过程中,他们发现试剂瓶内壁附着不少气泡,由此推断该瓶过氧化氢溶液的溶质质量分数小于30%。依据是_____ 。他们使用压强传感器等设备,检测密闭容器中不同温度下过氧化氢分解时压强的变化如图2,可知,其他条件一定时,温度越高,过氧化氢的分解速率____ (填“越快”“越慢”或“不变”)。
(3)利用化学方程式计算,制取4.8g氧气,至少需要过氧化氢的质量是多少?


(1)下列有关上述消毒剂的分析,错误的是_______。
| A.CH3COOOH和H2O2都是氧化物 |
| B.都应放置于暗处密封保存 |
| C.使用时都要谨防溅到皮肤上 |
| D.H2O2中氧元素的化合价为-1价 |
(3)利用化学方程式计算,制取4.8g氧气,至少需要过氧化氢的质量是多少?
您最近一年使用:0次
【推荐1】人类生命活动离不开水。今年“中国水周”的活动主题为“推进地下水超采综合治理,复苏河湖生态环境”。某天然水净化为自来水的主要流程如图1所示。回答下列问题:

(1)在“沉淀池”中加入明矾的目的是____ 。“吸附池”中常用_____ (填物质名称)吸附一些可溶性杂质,除去色素和异味。
(2)“消毒池”中可用高铁酸钠(Na2FeO4)作消毒剂。高铁酸钠中铁元素的化合价为_____ ;
(3)若用图2所示装置来净化天然水,其所起的作用是 (选填序号)。
(4)水是生命体生存所必需的物质,请写出一条爱护水资源的建议____________ 。
(5)图3是电解水的微观过程,该过程中没有发生变化的微粒是__________ (写粒子符号)。
(6)如图4为电解水实验的示意图,则b试管中产生的气体是______ 。
(7)“预习单”上有许多有趣好玩的家庭小实验,相信同学们在家里做过很多。假如我们在家里要进行“电解水家庭小实验”,请利用你家里或者身边的物品,你觉得,应该需要哪些物品和器材,如何组装,就能在家里对水进行电解?请在答题卡上画出简图并辅以适当的文字加以说明。

(1)在“沉淀池”中加入明矾的目的是
(2)“消毒池”中可用高铁酸钠(Na2FeO4)作消毒剂。高铁酸钠中铁元素的化合价为
(3)若用图2所示装置来净化天然水,其所起的作用是 (选填序号)。
| A.能杀菌消毒 | B.能得到纯水 | C.能把硬水变为软水 | D.能使天然水变澄清 |
(5)图3是电解水的微观过程,该过程中没有发生变化的微粒是
(6)如图4为电解水实验的示意图,则b试管中产生的气体是
(7)“预习单”上有许多有趣好玩的家庭小实验,相信同学们在家里做过很多。假如我们在家里要进行“电解水家庭小实验”,请利用你家里或者身边的物品,你觉得,应该需要哪些物品和器材,如何组装,就能在家里对水进行电解?请在答题卡上画出简图并辅以适当的文字加以说明。
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐2】“宏微符结合”是化学学科的思维特征之一。

(1)用化学符号或化学用语填空:
①已知醋酸钠的化学式为CH3COONa,则醋酸钙的化学式为___________ 。
②如图为锶原子的结构示意图,请写出氯化锶的化学式:______ 。
③如图为CO2与足量NaOH溶液反应示意图。图1为松开橡皮塞前的状态,图2为松开橡皮塞一段时间后的状态。请画出图2试管中A区和B区的主要微观粒子组成示意图,并进行必要的标注______ (水分子不用画出)。

(2)下图为铁元素的化合价价-物质类别图。

①X的物质类别是________ 。
②铁和稀硫酸反应生成的含铁化合物属于上图中的________ (填序号)。
③某同学想用物质a制取物质b,设计了以下实验:

物质X在通入氧气和加热的条件下,与稀硫酸反应的化学反应方程式为________ 。溶液乙中的溶质一定有_________ (填化学式)。

(1)用化学符号或化学用语填空:
①已知醋酸钠的化学式为CH3COONa,则醋酸钙的化学式为
②如图为锶原子的结构示意图,请写出氯化锶的化学式:
③如图为CO2与足量NaOH溶液反应示意图。图1为松开橡皮塞前的状态,图2为松开橡皮塞一段时间后的状态。请画出图2试管中A区和B区的主要微观粒子组成示意图,并进行必要的标注

(2)下图为铁元素的化合价价-物质类别图。

①X的物质类别是
②铁和稀硫酸反应生成的含铁化合物属于上图中的
③某同学想用物质a制取物质b,设计了以下实验:

物质X在通入氧气和加热的条件下,与稀硫酸反应的化学反应方程式为
您最近一年使用:0次
综合应用题
|
较难
(0.4)
解题方法
【推荐3】我国要在2060年前实现“碳中和”的目标,展现了我国的大国责任与担当。为实现目标,请您参与以下分析:
(1)“碳”产生:产生二氧化碳的途径主要是含碳物质的变化,因此:
①应提倡使用_____ 等清洁能源(写一种)。
②天然气的燃烧也会产生二氧化碳,写出该反应的化学方程式_____ 。
(2)“碳”封存:指从大气中分离出二氧化碳,可将其压缩、液化储存,其原因是_____ 。还可利用庞大的水体使海洋成为封存 的容器,用化学方程式解释这种方法的原理
的容器,用化学方程式解释这种方法的原理_____ 。
(3)“碳”转化:科学家研究将二氧化碳按照如下示意图进行转化:

①反应过程中化合价发生变化的元素是_____ 。
②参加反应的氢气和二氧化碳的质量比_____ 。
③写出反应的化学方程式_____ 。
(4)为实现目标,工业上用氢氧化钙实现“碳捕集”,某石灰水中含有氢氧化钙 ,要使该石灰水中的氢氧化钙全部转化为碳酸钙沉淀,能够吸收二氧化碳的质量是多少?
,要使该石灰水中的氢氧化钙全部转化为碳酸钙沉淀,能够吸收二氧化碳的质量是多少?
(1)“碳”产生:产生二氧化碳的途径主要是含碳物质的变化,因此:
①应提倡使用
②天然气的燃烧也会产生二氧化碳,写出该反应的化学方程式
(2)“碳”封存:指从大气中分离出二氧化碳,可将其压缩、液化储存,其原因是
 的容器,用化学方程式解释这种方法的原理
的容器,用化学方程式解释这种方法的原理(3)“碳”转化:科学家研究将二氧化碳按照如下示意图进行转化:

①反应过程中化合价发生变化的元素是
②参加反应的氢气和二氧化碳的质量比
③写出反应的化学方程式
(4)为实现目标,工业上用氢氧化钙实现“碳捕集”,某石灰水中含有氢氧化钙
 ,要使该石灰水中的氢氧化钙全部转化为碳酸钙沉淀,能够吸收二氧化碳的质量是多少?
,要使该石灰水中的氢氧化钙全部转化为碳酸钙沉淀,能够吸收二氧化碳的质量是多少?
您最近一年使用:0次







