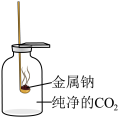
已知可燃物在O2燃烧,O2的作用是助燃剂,除O2外 ,CO2在一定条件下也可以作助燃剂。某校化学学习小组对Na在CO2中反应的产物进行探究。
(1)I【提出猜想】1 产物是Na2O和C
2 产物是___________ 和C
3 产物是Na2O、Na2CO3和C
Ⅱ【查阅资料】1.Mg在CO2中燃烧的产物是MgO和C;
2.Na2O遇H2O 迅速反应生成NaOH,Na2O与CO2反应生成Na₂CO3。
II【实验探究】
(2)实验步骤及现象如下表:
(3)IV【实验结论】根据实验现象,你认为猜想___________ 正确(填序号),Na在CO2中燃烧的化学方程式为___________
V【反思拓展】
(4)通过本实验探究,你认为燃烧是否一定要有氧气___________ (填“是”或者“否”)。
VI【学以致用】
(5)某校化学试剂保管室(有钠、钾、镁等活泼金属单质)失火,你作为化学爱好者,建议消防员最好选用以下哪种物质灭火___________
(1)I【提出猜想】1 产物是Na2O和C
2 产物是
3 产物是Na2O、Na2CO3和C
Ⅱ【查阅资料】1.Mg在CO2中燃烧的产物是MgO和C;
2.Na2O遇H2O 迅速反应生成NaOH,Na2O与CO2反应生成Na₂CO3。
II【实验探究】
(2)实验步骤及现象如下表:
| 操作 | 现象 | 结论 |
|
| 金属Na能在CO2中燃烧 |
| ①试管中产生白色沉淀 ② | 产物中有 产物中无 |
| 步骤3.取步骤1中产生的黑色固体,点燃,生成的气体通入澄清石灰水。 |
| 产物中有C |
(3)IV【实验结论】根据实验现象,你认为猜想
V【反思拓展】
(4)通过本实验探究,你认为燃烧是否一定要有氧气
VI【学以致用】
(5)某校化学试剂保管室(有钠、钾、镁等活泼金属单质)失火,你作为化学爱好者,建议消防员最好选用以下哪种物质灭火___________
| A.干燥的河沙 | B.二氧化碳灭火器 | C.干粉灭火器 | D.高压水枪中的水 |
更新时间:2024-05-14 21:26:22
|
相似题推荐
科学探究题
|
较难
(0.4)
名校
【推荐1】某化学兴趣小组的同学对酸、碱和盐的性质进行探究,实验如图,回答下列问题。

【实验猜想】
(1)实验一反应后成分的确定
猜想一:氯化钙。猜想二:氯化钙与氯化氢。猜想三__________________ 。
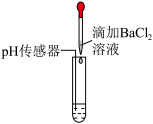
【实验验证】 取 实验一反应后的溶液于烧杯,将实验二的溶液
实验一反应后的溶液于烧杯,将实验二的溶液 实验二中
实验二中 的溶质质量分数为
的溶质质量分数为 逐滴滴入烧杯中,用
逐滴滴入烧杯中,用 传感器测定滴加过程中溶液的
传感器测定滴加过程中溶液的 ,实验结果如图所示。
,实验结果如图所示。

【实验结论】
(2)分析数据,可以确定猜想______ 成立。
(3) 点后曲线平缓阶段,b点溶液中的溶质
点后曲线平缓阶段,b点溶液中的溶质___________
(4) 点时,溶液呈
点时,溶液呈 ______ 色。说明将反应一中所有钙离子除去,所需 的
的 溶液的体积
溶液的体积 ______  。
。 填“大于”“等于”或“小于”
填“大于”“等于”或“小于”

【实验猜想】
(1)实验一反应后成分的确定
猜想一:氯化钙。猜想二:氯化钙与氯化氢。猜想三
【实验验证】 取
 实验一反应后的溶液于烧杯,将实验二的溶液
实验一反应后的溶液于烧杯,将实验二的溶液 实验二中
实验二中 的溶质质量分数为
的溶质质量分数为 逐滴滴入烧杯中,用
逐滴滴入烧杯中,用 传感器测定滴加过程中溶液的
传感器测定滴加过程中溶液的 ,实验结果如图所示。
,实验结果如图所示。
【实验结论】
(2)分析数据,可以确定猜想
(3)
 点后曲线平缓阶段,b点溶液中的溶质
点后曲线平缓阶段,b点溶液中的溶质(4)
 点时,溶液呈
点时,溶液呈  的
的 溶液的体积
溶液的体积  。
。 填“大于”“等于”或“小于”
填“大于”“等于”或“小于”
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐2】对于现象不明显的化学反应,实验设计中常通过放大、转化等方式使化学反应现象显现出来,更可以通过现代技术手段进行数据测定,实现反应过程的“可视化”。
【实验探究1】证明稀盐酸与NaOH溶液能发生化学反应
方案一:将盐酸滴入NaOH溶液的过程中,用pH传感器探究反应过程。当pH≤7即可确定二者发生了化学反应。实验测得其图像如图所示。
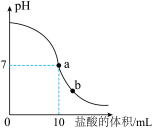
(1)b点表示溶液中的溶质是_______ 。
(2)强调“pH≤7时”而不是“pH减小”作为判断的理由是________ 。
方案二:向盛有10mL5%氢氧化钠溶液的烧杯中,逐滴匀速加入稀盐酸。并用温度传感器测量反应过程中溶液的温度变化情况,发现温度升高明显 。
【提出问题】
氢氧化钠溶液和盐酸混合时,溶液温度升高是否能得出该反应放热的结论?为此,需补做下列两个实验。
(1)向10mL5%的氢氧化钠溶液中逐滴加入________ ,边加边搅拌,并用温度传感器测定实验过程中温度的变化。
(2)将实验(1)中的氢氧化钠溶液替换为同浓度的盐酸,并再次进行实验。实验所得图像分别如图1、图2:
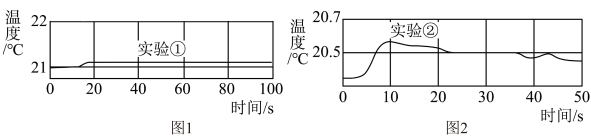
由图可知,盐酸、氢氧化钠溶液稀释时均______ (填“放热”或“吸热”),但它们稀释时温度的变化量远_____ (填“大于”或“小于”)两溶液混合时温度的变化量。
【实验结论】氢氧化钠溶液和盐酸的反应是放热反应。
【实验探究2】用电导率传感器测氢氧化钠溶液中滴加稀盐酸的电导率变化(如图)。
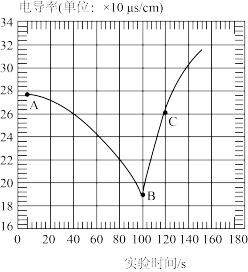
【查阅资料】
①电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小。
②相同温度下同种溶液电导率越大离子浓度越大。
【分析与讨论】
(1)AB段曲线下降的原因是________ 。
(2)如图表示该反应过程中烧杯中不同时间点的微观粒子示意图,按时间先后排列的顺序为______ (填字母)。
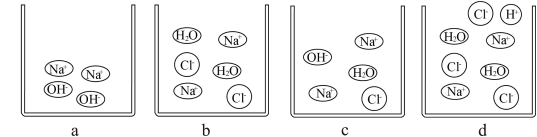
【实验探究3】稀盐酸的溶质质量分数的测定
课外活动小组用如图所示装置将稀盐酸滴入20mL溶质质量分数为5%的NaOH溶液中,溶液的温度和pH随稀盐酸体积(V)的变化曲线如下图所示。
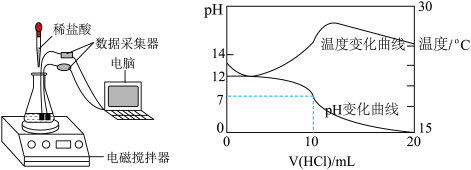
(1)通过该实验给出的判断,其中正确的是________ 。
a.进行该实验时环境温度约为22-23℃
b.溶液由碱性转变为中性,再转变为酸性且酸性不断减弱
c.该实验表明化学能可转化为热能
(2)计算实验中所用稀盐酸的溶质质量分数_______ (写出计算过程,结果保留1位小数,假设几种溶液密度均约为1g/mL)。
【实验探究1】证明稀盐酸与NaOH溶液能发生化学反应
方案一:将盐酸滴入NaOH溶液的过程中,用pH传感器探究反应过程。当pH≤7即可确定二者发生了化学反应。实验测得其图像如图所示。

(1)b点表示溶液中的溶质是
(2)强调“pH≤7时”而不是“pH减小”作为判断的理由是
方案二:向盛有10mL5%氢氧化钠溶液的烧杯中,逐滴匀速加入稀盐酸。并用温度传感器测量反应过程中溶液的温度变化情况,发现温度升高
【提出问题】
氢氧化钠溶液和盐酸混合时,溶液温度升高是否能得出该反应放热的结论?为此,需补做下列两个实验。
(1)向10mL5%的氢氧化钠溶液中逐滴加入
(2)将实验(1)中的氢氧化钠溶液替换为同浓度的盐酸,并再次进行实验。实验所得图像分别如图1、图2:

由图可知,盐酸、氢氧化钠溶液稀释时均
【实验结论】氢氧化钠溶液和盐酸的反应是放热反应。
【实验探究2】用电导率传感器测氢氧化钠溶液中滴加稀盐酸的电导率变化(如图)。

【查阅资料】
①电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小。
②相同温度下同种溶液电导率越大离子浓度越大。
【分析与讨论】
(1)AB段曲线下降的原因是
(2)如图表示该反应过程中烧杯中不同时间点的微观粒子示意图,按时间先后排列的顺序为

【实验探究3】稀盐酸的溶质质量分数的测定
课外活动小组用如图所示装置将稀盐酸滴入20mL溶质质量分数为5%的NaOH溶液中,溶液的温度和pH随稀盐酸体积(V)的变化曲线如下图所示。

(1)通过该实验给出的判断,其中正确的是
a.进行该实验时环境温度约为22-23℃
b.溶液由碱性转变为中性,再转变为酸性且酸性不断减弱
c.该实验表明化学能可转化为热能
(2)计算实验中所用稀盐酸的溶质质量分数
您最近一年使用:0次
科学探究题
|
较难
(0.4)
名校
【推荐3】学习小组在进行镁带与酸反应的实验时,发现足量镁带与稀盐酸反应后出现了灰白色沉淀,而与稀硫酸反应后,未有此现象,化学小组对这一异常现象开展探究。
【探究一】:探究灰白色沉淀中是否含有过量的镁或反应生成的氯化镁。
(1)①取灰白色固体样品,加入______ ,无气泡产生,灰白色固体不含镁。
②取等质量的灰白色固体和 MgCl2晶体分别放入同温、等量水中,灰白色固体不溶解而 MgCl2晶体全部______ ,灰白色固体不含 MgCl2。
【探究二】:探究灰白色固体产生的原因。

用如图 1 所示装置(平底烧瓶已固定)分别进行镁带与稀盐酸、稀硫酸反应的实验,其中镁带与稀盐酸反应的实验现象如表所示。
足量镁带和稀盐酸反应的实验现象:
(2)实验时,使镁条与稀盐酸、稀硫酸反应的操作是______ 。
(3)根据实验现象推测:①产生灰白色沉淀需______ (填“酸性”、“碱性”或“中性”)条件;②灰白色沉淀产生和______ (填离子符号)有关。
(4)为证实灰白色沉淀中含有 ,小赵同学设计了如下实验:过滤,取少量灰白色沉淀,加入足量稀硝酸使其完全溶解,继续滴加
,小赵同学设计了如下实验:过滤,取少量灰白色沉淀,加入足量稀硝酸使其完全溶解,继续滴加______ ,出现白色沉淀,他得出结论:灰白色沉淀中含有 ,
,
【结论】:镁与稀盐酸反应产生灰白色沉淀与溶液中的氯离子有关。
(5)图 2 是两个实验反应过程中烧瓶内压强的变化情况。根据图示可得出:实验中盐酸生成的氢气体积______ 稀硫酸反应生成的氢气体积(填“>、=、<”);反应结束后,烧瓶内压强减少的原因是______ 。
(6)资料显示:灰白色沉淀为碱式氯化镁,它存在多种组成,受热后分解生成 MgO、H2O 和 HCl,为进一步探究灰白色沉淀 Mg2(OH)xCly • nH2O 组成,小组同学设计如下实验。
【实验步骤】
①组装仪器,______ ;
②取 20.65g Mg2(OH)xCly • nH2O 于 A 中,按图示装入其他药品(均足量);
③打开止水夹,缓缓通入一段时间 N2后,关闭止水夹;
④称量 C 质量并记录数据为 120.0 g;
⑤点燃酒精灯加热至 A 中固体完全分解,继续通入一段时间 N2;
⑥称量 C 质量并记录数据为 123.65 g,称量 A 中残留固体质量并记录数据为 8.0 g;
⑦数据处理。

【交流讨论】
(7)步骤 5 通 N2的目的是______ 。
(8)D 的作用是______ 。
(9)根据计算结果,请完整写出该碱式氯化镁的化学式______ 。
【探究一】:探究灰白色沉淀中是否含有过量的镁或反应生成的氯化镁。
(1)①取灰白色固体样品,加入
②取等质量的灰白色固体和 MgCl2晶体分别放入同温、等量水中,灰白色固体不溶解而 MgCl2晶体全部
【探究二】:探究灰白色固体产生的原因。

用如图 1 所示装置(平底烧瓶已固定)分别进行镁带与稀盐酸、稀硫酸反应的实验,其中镁带与稀盐酸反应的实验现象如表所示。
足量镁带和稀盐酸反应的实验现象:
| 时间/min | 2 | 4 | 6 | 8 | 12 | 16 | 18 | 20 | 放置过夜 |
| 溶液 pH | 5.8 | 7.4 | 8.0 | 8.6 | 9.3 | 9.8 | 10.0 | 10.0 | 10.2 |
| 实验现象 | 大量气泡、无沉淀生成 | 镁带慢慢溶解,气泡量减少,烧杯底部灰白色沉淀逐渐增加 | |||||||
(3)根据实验现象推测:①产生灰白色沉淀需
(4)为证实灰白色沉淀中含有
 ,小赵同学设计了如下实验:过滤,取少量灰白色沉淀,加入足量稀硝酸使其完全溶解,继续滴加
,小赵同学设计了如下实验:过滤,取少量灰白色沉淀,加入足量稀硝酸使其完全溶解,继续滴加 ,
,【结论】:镁与稀盐酸反应产生灰白色沉淀与溶液中的氯离子有关。
(5)图 2 是两个实验反应过程中烧瓶内压强的变化情况。根据图示可得出:实验中盐酸生成的氢气体积
(6)资料显示:灰白色沉淀为碱式氯化镁,它存在多种组成,受热后分解生成 MgO、H2O 和 HCl,为进一步探究灰白色沉淀 Mg2(OH)xCly • nH2O 组成,小组同学设计如下实验。
【实验步骤】
①组装仪器,
②取 20.65g Mg2(OH)xCly • nH2O 于 A 中,按图示装入其他药品(均足量);
③打开止水夹,缓缓通入一段时间 N2后,关闭止水夹;
④称量 C 质量并记录数据为 120.0 g;
⑤点燃酒精灯加热至 A 中固体完全分解,继续通入一段时间 N2;
⑥称量 C 质量并记录数据为 123.65 g,称量 A 中残留固体质量并记录数据为 8.0 g;
⑦数据处理。

【交流讨论】
(7)步骤 5 通 N2的目的是
(8)D 的作用是
(9)根据计算结果,请完整写出该碱式氯化镁的化学式
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐1】小明在实验室中把硫酸铜晶体放入水中,水就变成蓝色。旁边的小刚问:“这是什么原因呢?”小明和小刚讨论了一下,提出了三个假设:
(1)可能是硫酸铜中的铜离子和硫酸根离子共同使水呈蓝色;
(2)可能是硫酸铜中的硫酸根离子使水呈蓝色;
还有一个可能的假设,请你替小明和小刚提出:_____ 。
小明查阅了资料,了解到硫酸溶液中也含有硫酸根离子,他和小刚在实验室内走了一圈找到盛硫酸溶液的试剂瓶,发现硫酸是无色的。于是,他们得出了一个结论。你能得出什么结论呢?_____ 。
小刚也查阅了一份资料,了解到氯化铜溶液、硝酸铜溶液中均含有铜离子,氯化钠溶液中含有氯离子,硝酸钠溶液含有硝酸根离子。他于是马上到实验室观察氯化钠、硝酸钠、氯化铜硝酸铜溶液的颜色,发现_____ 溶液的颜色出现蓝色,则可以得出结论:铜离子使硫酸铜溶液呈现蓝色。
(1)可能是硫酸铜中的铜离子和硫酸根离子共同使水呈蓝色;
(2)可能是硫酸铜中的硫酸根离子使水呈蓝色;
还有一个可能的假设,请你替小明和小刚提出:
小明查阅了资料,了解到硫酸溶液中也含有硫酸根离子,他和小刚在实验室内走了一圈找到盛硫酸溶液的试剂瓶,发现硫酸是无色的。于是,他们得出了一个结论。你能得出什么结论呢?
小刚也查阅了一份资料,了解到氯化铜溶液、硝酸铜溶液中均含有铜离子,氯化钠溶液中含有氯离子,硝酸钠溶液含有硝酸根离子。他于是马上到实验室观察氯化钠、硝酸钠、氯化铜硝酸铜溶液的颜色,发现
您最近一年使用:0次
科学探究题
|
较难
(0.4)
名校
解题方法
【推荐2】化学兴趣小组用如图的两个实验探究酸、碱、盐之间的化学反应。___________ ;乙实验时,观察到的现象是___________ 。
(2)某同学把甲、乙反应后的溶液倒入同一烧杯中,发现溶液显红色,决定继续对烧杯内溶液中溶质的成分进行探究。
【提出问题】反应后所得溶液中溶质的成分是什么?
【查阅资料】Na2SO4、BaCl2溶液呈中性。
【提出猜想】
①烧杯内溶液中的溶质成分可能有:
猜想Ⅰ:Na2CO3、Na2SO4;
猜想Ⅱ:___________
猜想Ⅲ:NaOH、Na2SO4、Na2CO3
【实验探究】
【实验结论】
②根据操作a的现象可知,猜想___________ 不成立。若操作b的现象A为“白色沉淀不溶解”,则猜想___________ 成立;若现象A为“白色沉淀部分溶解并产生气泡”,则猜想___________ 成立,沉淀部分溶解的反应方程式为___________ 。
【拓展反思】
③该同学认为,若操作a的现象为“溶液红色褪去”,则不需要进行操作b即可得出结论。他的理由是___________ 。

(2)某同学把甲、乙反应后的溶液倒入同一烧杯中,发现溶液显红色,决定继续对烧杯内溶液中溶质的成分进行探究。
【提出问题】反应后所得溶液中溶质的成分是什么?
【查阅资料】Na2SO4、BaCl2溶液呈中性。
【提出猜想】
①烧杯内溶液中的溶质成分可能有:
猜想Ⅰ:Na2CO3、Na2SO4;
猜想Ⅱ:
猜想Ⅲ:NaOH、Na2SO4、Na2CO3
【实验探究】
| 实验操作 | 实验现象 |
| a.取烧杯中的溶液于试管中,加入过量BaC12溶液 | 溶液红色不褪去:产生白色沉淀 |
| b.再向试管中加入足量的稀硝酸 | 溶液红色褪去;出现现象A |
②根据操作a的现象可知,猜想
【拓展反思】
③该同学认为,若操作a的现象为“溶液红色褪去”,则不需要进行操作b即可得出结论。他的理由是
您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐3】有一种淡黄色粉末可制备消毒杀菌剂。
【探究一】兴趣小组对其成分进行了探究。
【提出问题】淡黄色固体是什么?
【查阅资料】(1)硫粉是一种淡黄色固体,难溶于水,燃烧生成刺激性气味的有毒气体。
(2)过氧化钠(Na2O2)是一种淡黄色固体,能与水反应放出气体。
(3)【设计实验】方案一:取少量该固体粉末于试管中,加5mL水,振荡并观察现象。
方案二:在燃烧匙里放少量该固体,在酒精灯上加热,观察现象。经讨论,兴趣小组决定采用方案一,其理由是______________ (填序号)
A 操作简单 B 防止实验污染 C 节约能源
【实验验证】用如图装置实验,将淡黄色粉末加入试管中。
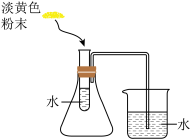
①若淡黄色粉末为硫粉,则________ (选填“有”或“无”)现象。
②若淡黄色粉末为过氧化钠,可观察到试管中的现象是__________ ,烧杯中的导管口也出现气泡,说明______________ 。
【实验结论】实验确定该淡黄色粉末是过氧化钠。
【探究二】某实验小组对“载人宇宙飞船或潜水艇中一般都要安装盛放过氧化钠(Na2O2)颗粒的装置“感到非常好奇,设计实验进行探究。
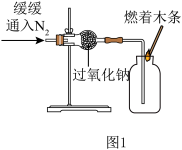
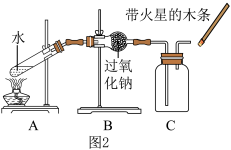
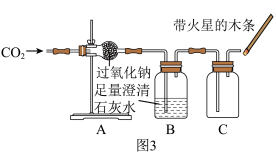
【提出问题】过氧化钠是否为一种制氧剂?与人呼出的哪种气体发生反应?
【查阅资料】人呼出的气体中主要成分是N2、O2、CO2和水蒸气等。
【提出猜想】过氧化钠与人呼出的N2、水蒸气、CO2都可以反应并生成氧气。
【进行实验】实验I::验证过氧化钠与氮气反应并生成氧气。(如图1所示装置)
实验现象及结论:观察到________ 的现象,结论是过氧化钠与氮气没有发生反应。
实验Ⅱ:验证过氧化钠与水蒸气反应并生成氧气。(如图2所示装置)
(1)A装置的试管中发生的变化属于________ 填“物理”或“化学”)变化。
(2)实验现象及结论:带火星的木条复燃;结论是过氧化钠与水蒸气发生反应并生成氧气。
实验Ⅲ:验证过氧化钠与二氧化碳反应并生成氧气。(如图3所示装置)
(1)足量澄清石灰水的作用是____________ 。
(2)已知过氧化钠与二氧化碳反应除了生成氧气以外,还生成碳酸钠。请写出该反应的表达式:______ 。
【探究一】兴趣小组对其成分进行了探究。
【提出问题】淡黄色固体是什么?
【查阅资料】(1)硫粉是一种淡黄色固体,难溶于水,燃烧生成刺激性气味的有毒气体。
(2)过氧化钠(Na2O2)是一种淡黄色固体,能与水反应放出气体。
(3)【设计实验】方案一:取少量该固体粉末于试管中,加5mL水,振荡并观察现象。
方案二:在燃烧匙里放少量该固体,在酒精灯上加热,观察现象。经讨论,兴趣小组决定采用方案一,其理由是
A 操作简单 B 防止实验污染 C 节约能源
【实验验证】用如图装置实验,将淡黄色粉末加入试管中。

①若淡黄色粉末为硫粉,则
②若淡黄色粉末为过氧化钠,可观察到试管中的现象是
【实验结论】实验确定该淡黄色粉末是过氧化钠。
【探究二】某实验小组对“载人宇宙飞船或潜水艇中一般都要安装盛放过氧化钠(Na2O2)颗粒的装置“感到非常好奇,设计实验进行探究。



【提出问题】过氧化钠是否为一种制氧剂?与人呼出的哪种气体发生反应?
【查阅资料】人呼出的气体中主要成分是N2、O2、CO2和水蒸气等。
【提出猜想】过氧化钠与人呼出的N2、水蒸气、CO2都可以反应并生成氧气。
【进行实验】实验I::验证过氧化钠与氮气反应并生成氧气。(如图1所示装置)
实验现象及结论:观察到
实验Ⅱ:验证过氧化钠与水蒸气反应并生成氧气。(如图2所示装置)
(1)A装置的试管中发生的变化属于
(2)实验现象及结论:带火星的木条复燃;结论是过氧化钠与水蒸气发生反应并生成氧气。
实验Ⅲ:验证过氧化钠与二氧化碳反应并生成氧气。(如图3所示装置)
(1)足量澄清石灰水的作用是
(2)已知过氧化钠与二氧化碳反应除了生成氧气以外,还生成碳酸钠。请写出该反应的表达式:
您最近一年使用:0次
【推荐1】化学课上同学们进行硫酸铜溶液和氢氧化钠溶液反应的实验,发现加入溶液的顺序不同,产生的现象不同,加热反应后的混合物现象也不同,如下图:
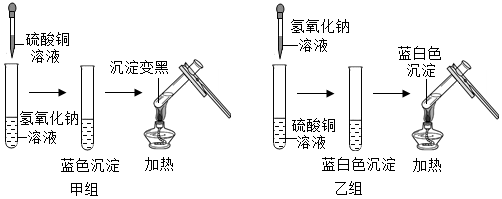
【甲组】氢氧化钠与硫酸铜反应的化学方程式为______ 。已知蓝色沉淀受热分解后生成两种常见的氧化物,则黑色物质是______ 。
【乙组】为寻找实验中没有产生黑色物质的原因,他们进行了以下实验探究:
【查阅资料】在酸性条件下,氢氧化钠与硫酸铜在溶液中可发生如下反应: ,生成的碱式硫酸铜是不溶于水的蓝白色固体,加热不易发生分解。
,生成的碱式硫酸铜是不溶于水的蓝白色固体,加热不易发生分解。
【提出猜想】根据资料分析,同学们针对试管中溶液呈酸性的原因作出以下猜想:
猜想Ⅰ:硫酸铜溶液呈酸性;猜想Ⅱ:生成的硫酸钠使溶液呈酸性。
【实验与结论】实验①:用玻璃棒蘸取硫酸铜溶液滴在pH试纸上,显色后与______ 对照,得出其pH______ (填“>”、“<”或“=”)7,说明硫酸铜溶液呈酸性,猜想I成立。
实验②:向盛有硫酸钠溶液的试管中滴加______ ,观察到______ ,说明硫酸钠溶液呈中性,猜想Ⅱ不成立。
【交流与反思】(1)乙组同学认真分析甲组实验后,一致认为不需要通过实验就能判断猜想Ⅱ不成立,理由是______ 。
(2)硫酸铜溶液显酸性,推测硫酸铜溶液中存在的阳离子有______ (填离子符号)。
(3)在化学反应中,相同的反应物因其质量比不同可能会导致生成物不同,请另举一例:______ 。

【甲组】氢氧化钠与硫酸铜反应的化学方程式为
【乙组】为寻找实验中没有产生黑色物质的原因,他们进行了以下实验探究:
【查阅资料】在酸性条件下,氢氧化钠与硫酸铜在溶液中可发生如下反应:
 ,生成的碱式硫酸铜是不溶于水的蓝白色固体,加热不易发生分解。
,生成的碱式硫酸铜是不溶于水的蓝白色固体,加热不易发生分解。【提出猜想】根据资料分析,同学们针对试管中溶液呈酸性的原因作出以下猜想:
猜想Ⅰ:硫酸铜溶液呈酸性;猜想Ⅱ:生成的硫酸钠使溶液呈酸性。
【实验与结论】实验①:用玻璃棒蘸取硫酸铜溶液滴在pH试纸上,显色后与
实验②:向盛有硫酸钠溶液的试管中滴加
【交流与反思】(1)乙组同学认真分析甲组实验后,一致认为不需要通过实验就能判断猜想Ⅱ不成立,理由是
(2)硫酸铜溶液显酸性,推测硫酸铜溶液中存在的阳离子有
(3)在化学反应中,相同的反应物因其质量比不同可能会导致生成物不同,请另举一例:
您最近一年使用:0次
科学探究题
|
较难
(0.4)
名校
解题方法
【推荐2】铬(Cr)是重要的金属材料,越来越受到人们的关注。某化学兴趣小组对Cr、Al、Cu的金属活动性顺序进行探究,过程如下:
【提出假设】
(1)由已学知识,已知其中两种金属的活动性顺序,现对三种金属的活动性顺序提出三种可能的假设:
a.Al>Cr>Cu b.Cr>Al>Cu c._____ 。
【设计实验】同温下,取大小相同的打磨过的金属薄片,分别投入到等体积等浓度的足量稀盐酸中,观察现象,记录如下:
【控制实验条件】
(2)打磨三种金属目的是除去表面氧化膜,其发生的是___ 变化(填“物理”或化学)
【得出结论】
(3)原假设中正确的是_____ (填“a”“b”或“c”)。写出铬与盐酸反应的化学方程式(铬与盐酸反应后显+2价):_____ 。
【结论应用】
(4)根据探究结果,为验证Cr、Al、Cu的金属活动性顺序,还可设计如图所示的实验操作。其中可以达到实验目的是_____ (填字母)。

【提出假设】
(1)由已学知识,已知其中两种金属的活动性顺序,现对三种金属的活动性顺序提出三种可能的假设:
a.Al>Cr>Cu b.Cr>Al>Cu c.
【设计实验】同温下,取大小相同的打磨过的金属薄片,分别投入到等体积等浓度的足量稀盐酸中,观察现象,记录如下:
| 金属 | Cr | Al | Cu |
| 与盐酸 反应现象 | 气泡产生缓慢, 金属逐渐溶解 | 气泡产生剧烈, 金属迅速溶解 | 无气泡产生, 金属无变化 |
(2)打磨三种金属目的是除去表面氧化膜,其发生的是
【得出结论】
(3)原假设中正确的是
【结论应用】
(4)根据探究结果,为验证Cr、Al、Cu的金属活动性顺序,还可设计如图所示的实验操作。其中可以达到实验目的是

您最近一年使用:0次
科学探究题
|
较难
(0.4)
解题方法
【推荐3】某化学兴趣小组的同学在探究复分解反应时,做了下面的实验。在下列四组物质中分别滴加碳酸钠溶液,请根据实验回答下列问题:
(1)这四组物质不能与碳酸钠发生化学反应的是______ 组。
(2)某小组同学在进行氯化钙溶液与碳酸钠反应的实验时,对物质是否恰好完全反应,。反应后溶液中的溶质的成分产生疑问,进行了以下探究。
【提出问题】该溶液中的溶质成分是什么?
【清想与假设】
猜想①:只有NaCl;
猜想②:有______ 。
猜想③:有NaCl、CaCl2。
猜想④:有NaCl、CaCl2、Na2CO3
经过讨论,同学们直接得出猜想______ 是不正确的,为了验证其余哪种猜想是正确的,同学们又做了以下实验:
【设计与实验】
【实验反思】若B组氯化钙溶液与碳酸钠溶液恰好完全反应时生产了10克白色沉淀,则原溶液中氯化钙的质量为______ 克。(可能需要用到的相对原质量:C-12 O-16 C1-35.5 Ca-40)
| 物质 | 稀盐酸溶液 | 氯化钙溶液 | 硝酸钾溶液 | 氯化钡溶液 |
| 碳酸钠溶液 | A组 | B组 | C组 | D组 |
(2)某小组同学在进行氯化钙溶液与碳酸钠反应的实验时,对物质是否恰好完全反应,。反应后溶液中的溶质的成分产生疑问,进行了以下探究。
【提出问题】该溶液中的溶质成分是什么?
【清想与假设】
猜想①:只有NaCl;
猜想②:有
猜想③:有NaCl、CaCl2。
猜想④:有NaCl、CaCl2、Na2CO3
经过讨论,同学们直接得出猜想
【设计与实验】
| 实验操作 | 实验现象 | 实验结论 |
| 步骤一:取少量反应后的溶液于试管中,滴加酚酞溶液 | 猜想②不正确 | |
| 步骤二:再另取少量反应后的溶液于另一支试管中,加入适量的 | 产生白色沉淀 | 猜想③正确 |
您最近一年使用:0次