工业上制备K2SO4晶体的一种工艺流程如图:_______ 的主要成分,上述流程中可循环使用的物质有_______ (填化学式)。
(2)反应2中发生反应的化学方程式为_______ (生成物的化学计量数均为1)。
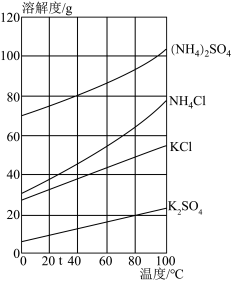
(3)通过分析四种物质的溶解度曲线,请解释反应3中能得到K2SO4晶体的原因是:_______ 。
(4)不用水而用饱和K2SO4溶液洗涤反应3所得晶体的原因是_______ ,为检验硫酸钾晶体是否洗涤干净,可取最后一次洗涤液,先加入_______ (填序号),振荡、静置,再向上层清液中滴加AgNO3溶液,观察现象即可判断。
A.过量的BaCl2溶液 B.过量的Ba(NO3)2溶液
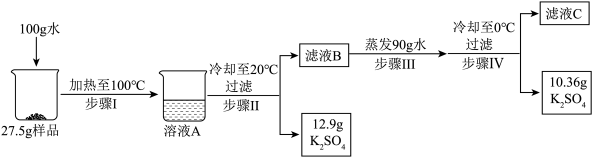
(5)某K2SO4样品中混有NaCl杂质,可利用溶解度差异进行提纯。称取27.5g样品进行实验,过程如图(步骤Ⅰ加热至100℃时不考虑水分蒸发):
溶解度(g)
①100℃时,NaCl的溶解度为_______ g;20℃时,10g水中最多溶解K2SO4_______ g。
②滤液B中,K2SO4_______ (选填“达到”或“末达到”)饱和状态。
③27.5g样品中NaCl的质量是_______ g。
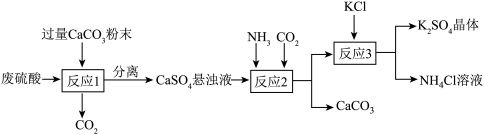
(2)反应2中发生反应的化学方程式为
(3)通过分析四种物质的溶解度曲线,请解释反应3中能得到K2SO4晶体的原因是:
(4)不用水而用饱和K2SO4溶液洗涤反应3所得晶体的原因是
A.过量的BaCl2溶液 B.过量的Ba(NO3)2溶液
(5)某K2SO4样品中混有NaCl杂质,可利用溶解度差异进行提纯。称取27.5g样品进行实验,过程如图(步骤Ⅰ加热至100℃时不考虑水分蒸发):
溶解度(g)
| 温度(℃) | 0 | 20 | 60 | 100 |
| NaCl | 35.7 | 36.0 | 37.1 | 39.2 |
| K2SO4 | 7.4 | 11.1 | 18.2 | 24.1 |
②滤液B中,K2SO4
③27.5g样品中NaCl的质量是
更新时间:2024-05-16 11:20:36
|
相似题推荐
填空与简答-填空题
|
较难
(0.4)
解题方法
【推荐1】某化学小组在实验室中进行酸、碱、盐化学性质的实验:
〖进行实验〗
实验一:
(1)取一根表面生锈的铁钉放于一只试管中(铁锈的主要成分是三氧化二铁),逐滴滴入稀盐酸,并轻轻振荡,观察到:铁钉表面的铁锈渐渐消失,变得光亮,溶液变为黄色。发生的化学反应方程式为_____________ 。
(2)铁钉光亮后取出,放于另一只试管中,继续滴加稀盐酸,观察到的现象是:____________ 。
实验二:
(1)另取一支试管加入约两毫升硫酸铜溶液,再加入一些氢氧化钠溶液,然后加入适量的稀硫酸,这个过程观察到的现象是:_____________ 。
(2)最后向试管中滴加适量氯化钡溶液,产生白色沉淀,写出产生白色沉淀的化学方程式(一个即可):______________ 。
〖实验总结〗
化学小组的同学根据以上二个实验对酸、碱、盐化学性质进行了总结,以下结论与以上实验无关的是:_____________ 。
A.酸能与某些金属反应
B.酸能与某些金属氧化物反应
C.某些盐之间可以发生反应
D.碱能与某些盐反应
E.酸能与碱反应
F.酸能与某些盐反应
G.盐能与某些金属反应
〖处理药品〗
实验结束后,将实验一、实验二试管中的废液全部倒入一只空烧杯中,混合后,加入适量的氢氧化钠溶液处理,经处理后溶液中一定存在的溶质是___________ 。
〖进行实验〗
实验一:
(1)取一根表面生锈的铁钉放于一只试管中(铁锈的主要成分是三氧化二铁),逐滴滴入稀盐酸,并轻轻振荡,观察到:铁钉表面的铁锈渐渐消失,变得光亮,溶液变为黄色。发生的化学反应方程式为
(2)铁钉光亮后取出,放于另一只试管中,继续滴加稀盐酸,观察到的现象是:
实验二:
(1)另取一支试管加入约两毫升硫酸铜溶液,再加入一些氢氧化钠溶液,然后加入适量的稀硫酸,这个过程观察到的现象是:
(2)最后向试管中滴加适量氯化钡溶液,产生白色沉淀,写出产生白色沉淀的化学方程式(一个即可):
〖实验总结〗
化学小组的同学根据以上二个实验对酸、碱、盐化学性质进行了总结,以下结论与以上实验无关的是:
A.酸能与某些金属反应
B.酸能与某些金属氧化物反应
C.某些盐之间可以发生反应
D.碱能与某些盐反应
E.酸能与碱反应
F.酸能与某些盐反应
G.盐能与某些金属反应
〖处理药品〗
实验结束后,将实验一、实验二试管中的废液全部倒入一只空烧杯中,混合后,加入适量的氢氧化钠溶液处理,经处理后溶液中一定存在的溶质是
您最近一年使用:0次
填空与简答-流程题
|
较难
(0.4)
【推荐2】某兴趣小组利用废镍材料(含有金属Ni及少量Fe、Ag)探究相关物质的性质并回收镍,设计流程如图(小部分产物略去)。
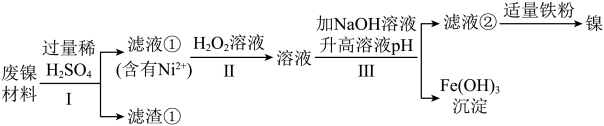
查阅资料:a.H2O2溶液可将Fe2+转化为Fe3+。
b.Fe3+ 、Ni2+转化为对应的氢氧化物沉淀时,溶液pH如图
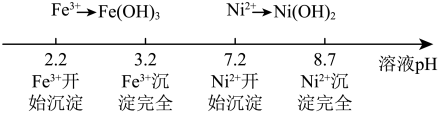
(1)步骤Ⅰ的操作为______ 。
(2)滤渣①的成分为______ 。
(3)单质Fe参与反应的化学方程式为______ 。(任写一个)
(4)滤液②中有Ni2+、无Fe3+,则滤液②pH可能为______ (填序号)。
A.pH=1 B.pH=2 C.pH=6 D.pH=10
(5)Ni、Fe、Ag三种金属的活动性由强到弱的顺序为______ 。

查阅资料:a.H2O2溶液可将Fe2+转化为Fe3+。
b.Fe3+ 、Ni2+转化为对应的氢氧化物沉淀时,溶液pH如图

(1)步骤Ⅰ的操作为
(2)滤渣①的成分为
(3)单质Fe参与反应的化学方程式为
(4)滤液②中有Ni2+、无Fe3+,则滤液②pH可能为
A.pH=1 B.pH=2 C.pH=6 D.pH=10
(5)Ni、Fe、Ag三种金属的活动性由强到弱的顺序为
您最近一年使用:0次
【推荐3】科学方法对化学学习起着事半功倍的作用。右图是某同学整理的铁及其化合物知识网络图。
(1)分类归纳是研究化学物质的重要方法。① 铁丝燃烧生成Fe3O4的过程中________ (选填”放出”或“吸收”)热量。
② 铁制品的锈蚀过程,实际上是铁与空气中的______ 等发生化学反应的过程。
③ 与FeSO4中铁元素化合价相同的铁氧化物的化学式是______ 。
(2)微观粒子模型化是研究化学变化的重要方法。
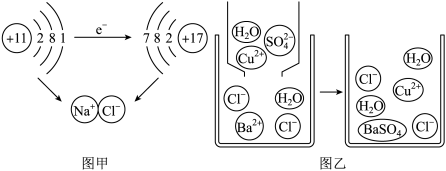
① 图甲是钠与氯气反应生成氯化钠的示意图。该图说明在化学反应过程中一定发生变化的是________ 。(填字母)
a.原子核 b.原子的最外层电子数 c.原子的电子层数
② 图乙是硫酸铜溶液与氯化钡溶液反应示意图。从粒子角度分析该化学反应能发生的原因是_________ 。
(3)控制变量、设计对比实验是实验探究的重要方法。
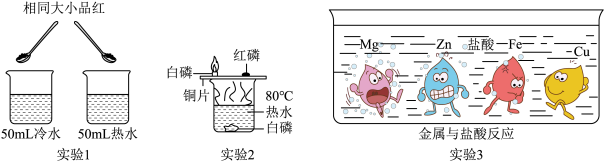
① 实验l 中同时向烧杯中加入一粒相同大小的品红,发现整杯水变红的时间热水比冷水短。这是因为__________ 。
② 实验2中使用铜片是为了对比__________ 不同。
③ 实验3是大小形状相同的Mg、Zn、Fe、Cu四种金属同时投入到盐酸中发生的现象,金属周围的黑点表示生成的气体。下列结论不正确的是__________ 。(填字母)
a.铜不能发生置换反应
b.四种金属中金属活动性最强的是Mg
c.等质量的锌和铁分别与足量的盐酸反应生成气体质量:Zn比Fe多
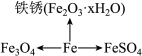
(1)分类归纳是研究化学物质的重要方法。① 铁丝燃烧生成Fe3O4的过程中
② 铁制品的锈蚀过程,实际上是铁与空气中的
③ 与FeSO4中铁元素化合价相同的铁氧化物的化学式是
(2)微观粒子模型化是研究化学变化的重要方法。

① 图甲是钠与氯气反应生成氯化钠的示意图。该图说明在化学反应过程中一定发生变化的是
a.原子核 b.原子的最外层电子数 c.原子的电子层数
② 图乙是硫酸铜溶液与氯化钡溶液反应示意图。从粒子角度分析该化学反应能发生的原因是
(3)控制变量、设计对比实验是实验探究的重要方法。

① 实验l 中同时向烧杯中加入一粒相同大小的品红,发现整杯水变红的时间热水比冷水短。这是因为
② 实验2中使用铜片是为了对比
③ 实验3是大小形状相同的Mg、Zn、Fe、Cu四种金属同时投入到盐酸中发生的现象,金属周围的黑点表示生成的气体。下列结论不正确的是
a.铜不能发生置换反应
b.四种金属中金属活动性最强的是Mg
c.等质量的锌和铁分别与足量的盐酸反应生成气体质量:Zn比Fe多
您最近一年使用:0次
【推荐1】根据NaC1和KNO3的溶解度表和溶解度曲线,回答下列问题:
(1)20℃时,KNO3的溶解度为____________ g。
(2)KNO3和NaCl两种物质的溶解度受温度影响较小的是_____________ 。
(3)按照下图进行实验,各步操作均已充分溶解,忽略实验过程中溶剂的挥发、下列说法正确的是
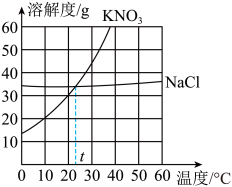
| 温度/℃ | 0 | 20 | 40 | |
| 溶解度/g | NaCl | 35.7 | 36.0 | 36.6 |
| KNO3 | 13.3 | 31.6 | 63.9 | |
(2)KNO3和NaCl两种物质的溶解度受温度影响较小的是
(3)按照下图进行实验,各步操作均已充分溶解,忽略实验过程中溶剂的挥发、下列说法正确的是

| A.烧杯a和b内,溶液中溶质的质量分数:a<b |
| B.烧杯a和d内,溶剂质量:a>d |
| C.烧杯c和f内,上层清液中溶质的质量分数:c=f |
| D.烧杯c和f内,剩余固体质量:c>f |
| E.烧杯b内,溶液中溶质的质量分数约为30.9% |
您最近一年使用:0次
填空与简答-填空题
|
较难
(0.4)
名校
解题方法
【推荐2】在t℃时,分别取甲、乙两种固体的溶液,恒温蒸发水分,得到蒸发水的质量(X)与析出晶体质量(Y)的关系如图所示(析出的晶体不含结晶水)。
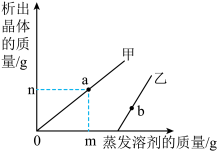
(1)t℃时,在0点乙的溶液是______ 溶液(填“饱和”或“不饱和”)。
(2)t℃时,甲、乙的溶解度大关系为,甲______ 乙(填“<”“>”或“=”)。
(3)下列说法正确的有______ (填序号)。
A.甲、乙两种物质的溶解度都随温度升高而变大,
B.根据m、n可计算出t℃时甲在水中的溶解度
C.t℃时用甲饱和溶液和水50g,配制一定浓度的稀溶液时,量取溶液时仰视读数,则会使溶液浓度偏大
D.b点的乙溶液质量分数大于a点甲溶液的溶质质量分数

(1)t℃时,在0点乙的溶液是
(2)t℃时,甲、乙的溶解度大关系为,甲
(3)下列说法正确的有
A.甲、乙两种物质的溶解度都随温度升高而变大,
B.根据m、n可计算出t℃时甲在水中的溶解度
C.t℃时用甲饱和溶液和水50g,配制一定浓度的稀溶液时,量取溶液时仰视读数,则会使溶液浓度偏大
D.b点的乙溶液质量分数大于a点甲溶液的溶质质量分数
您最近一年使用:0次
【推荐3】已知甲物质的溶解度与温度的关系如下表所示:
按如图步骤进行操作:
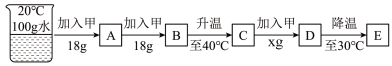
(1)甲的溶解度随温度的升高而______ (填“增大”或“减小”)。
(2)溶液A中的溶质质量______ (填“>”“=”或“<”)溶液B中的溶质质量。
(3)已知溶液D恰好饱和,则x=______ 。
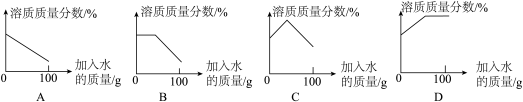
(4)向溶液E中逐渐加入共100g水,边加边搅拌,保持温度不变,下列图像符合相关量变化关系的是______ (填字母)。
| 溶解度/g | 10 | 20 | 30 | 40 |
| 温度/℃ | 10.0 | 18.0 | 36.0 | 56.0 |

(1)甲的溶解度随温度的升高而
(2)溶液A中的溶质质量
(3)已知溶液D恰好饱和,则x=
(4)向溶液E中逐渐加入共100g水,边加边搅拌,保持温度不变,下列图像符合相关量变化关系的是

您最近一年使用:0次
【推荐1】水和溶液在生产、生活中具有广泛的用途。
(1)水是生命之源。河水、湖水、井水等天然水属于________ (填“纯净物”或“混合物”),常用的净水方法有吸附、沉降、过滤、蒸馏等,其中净水程度最高的是________ ;检验某水样为硬水方法是________ 。
(2)如图是甲、乙、丙三种不含结晶水的固体物质的溶解度曲线,请回答下列问题:
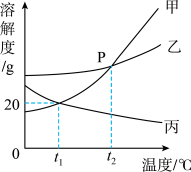
①t1℃时,将10克甲物质加入到25克水中,充分溶解后,所得溶液中溶质和溶剂的质量比是_____ (写出最简整数比)。
②t2℃时,甲溶液的溶质质量分数与丙溶液的溶质质量分数相比,前者和后者的关系是_______ (填字母)。
A.大于 B.等于 C.小于 D.无法确定
③将t2℃时等质量甲、乙、丙三种物质的饱和溶液降温到t1℃时,所得溶液的质量由大到小的顺序是__________ 。
(1)水是生命之源。河水、湖水、井水等天然水属于
(2)如图是甲、乙、丙三种不含结晶水的固体物质的溶解度曲线,请回答下列问题:

①t1℃时,将10克甲物质加入到25克水中,充分溶解后,所得溶液中溶质和溶剂的质量比是
②t2℃时,甲溶液的溶质质量分数与丙溶液的溶质质量分数相比,前者和后者的关系是
A.大于 B.等于 C.小于 D.无法确定
③将t2℃时等质量甲、乙、丙三种物质的饱和溶液降温到t1℃时,所得溶液的质量由大到小的顺序是
您最近一年使用:0次
【推荐2】水和溶液在生产生活中起着重要的作用。
(1)电解水实验可以得出水是由______ 组成的。
(2)天然水中含有许多杂质,现向水样中加入明矾搅拌溶解,静置一段时间后,进行过滤,过滤时需要用到的玻璃仪器有______ (填序号)。
①带铁圈的铁架台 ②酒精灯 ③漏斗 ④玻璃棒 ⑤量筒 ⑥烧杯 ⑦滤纸
(3)少量下列物质加入到水中,充分搅拌后,可以得到无色溶液的是______。
(4)Ⅰ、甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图。下列说法正确的是______。
(5)Ⅱ、硝酸钾在不同温度时的溶解度见下表:
下图A、B、C、D四个烧杯中分别盛有100g水,分别向其中加入110g、86g、64g、32g硝酸钾,充分溶解后得到40℃时的溶液。______ 中的液体是饱和溶液(选填字母)。
②表中的一组数据“20、32”的含义是______ 。
③将一瓶接近饱和的硝酸钾溶液变成饱和溶液的方法是______ (任写一种)。
④向B烧杯中加适量的水得到饱和溶液(保持40℃)的最大质量为______ g。
⑤A烧杯中溶液的溶质质量分数为______ 。
(1)电解水实验可以得出水是由
(2)天然水中含有许多杂质,现向水样中加入明矾搅拌溶解,静置一段时间后,进行过滤,过滤时需要用到的玻璃仪器有
①带铁圈的铁架台 ②酒精灯 ③漏斗 ④玻璃棒 ⑤量筒 ⑥烧杯 ⑦滤纸
(3)少量下列物质加入到水中,充分搅拌后,可以得到无色溶液的是______。
| A.植物油 | B.蔗糖 | C.乙醇 | D.高锰酸钾 |
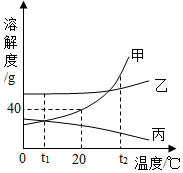
| A.t1℃时,三种物质的溶解度:乙>甲=丙 |
| B.20℃时,将30g甲放入50g水中,充分搅拌,所得溶液的质量是80g |
| C.分别将t2℃时三种物质的饱和溶液降温到t1℃,甲溶液中析出的晶体质量最大 |
| D.分别将t1℃时三种物质的饱和溶液升温到t2℃,溶液中溶质的质量分数:乙>甲>丙 |
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| 溶解度/g | 21 | 32 | 46 | 64 | 86 | 110 | 138 |
②表中的一组数据“20、32”的含义是
③将一瓶接近饱和的硝酸钾溶液变成饱和溶液的方法是
④向B烧杯中加适量的水得到饱和溶液(保持40℃)的最大质量为
⑤A烧杯中溶液的溶质质量分数为
您最近一年使用:0次
填空与简答-填空题
|
较难
(0.4)
名校
解题方法
【推荐3】图为固体M、N在不同温度下形成饱和溶液时,所需溶质和溶剂的质量关系。
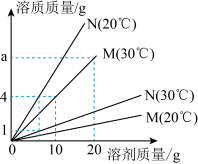
(1)a的值为________________ 。
(2)20℃时,10gM的饱和溶液中,含M___________ g(精确到0.1)。
(3)将等质量的M、N饱和溶液从30℃降温至20℃,所得溶液的溶质质量分数大小关系为M______ N(填>、<或=)。
(4)下列描述错误的是_________ (填序号)。
a.N的溶解度随温度升高而减小
b.20℃时,M、N的饱和溶液中溶质质量:M<N
c.向20g水中加入2gM,溶液质量一定为22g
d.30℃时,M的饱和溶液恒温蒸发10g水,析出晶体4g

(1)a的值为
(2)20℃时,10gM的饱和溶液中,含M
(3)将等质量的M、N饱和溶液从30℃降温至20℃,所得溶液的溶质质量分数大小关系为M
(4)下列描述错误的是
a.N的溶解度随温度升高而减小
b.20℃时,M、N的饱和溶液中溶质质量:M<N
c.向20g水中加入2gM,溶液质量一定为22g
d.30℃时,M的饱和溶液恒温蒸发10g水,析出晶体4g
您最近一年使用:0次
【推荐1】化学扑克是用卡片类扑克为载体,按照一定规则进行游戏的一种学习方式。请你和大家一起来玩化学扑克吧。
(1)对出规则:甲出一对表示相同物质的牌,其他玩家也必须跟进任何一张表示相同物质的牌。若甲出的牌为:“生石灰”、“CaO”。乙有如下五张牌:“氢氧化钠”、“氢氧化钙”、“火碱”、“NaOH”、“Ca(OH)2”,则乙有种符合对出规则的出牌组合___ ;
(2)单补规则:甲出一张牌作为反应物,乙必须跟出一张能与其反应的牌,当反应物凑齐后,后面的玩家才能跟出该反应的生成物。若甲出的牌为“CaCO3”,乙有如下四张牌:“氧气”、“盐酸”、“ NaOH”、“ CuO”,则乙应跟出的牌为___ ;丙有如下四张牌:“CO2”、“CaCl2”、“CO”、“H2O”,丙不能跟出的牌为___ ;
(3)串出规则:甲出一个化学方程式,其他玩家也必须跟进一个基本反应类型相同的化学方程式。若甲出“NaOH+HCl=NaCl+H2O”,则乙应出___ (填字母)。
(1)对出规则:甲出一对表示相同物质的牌,其他玩家也必须跟进任何一张表示相同物质的牌。若甲出的牌为:“生石灰”、“CaO”。乙有如下五张牌:“氢氧化钠”、“氢氧化钙”、“火碱”、“NaOH”、“Ca(OH)2”,则乙有种符合对出规则的出牌组合
(2)单补规则:甲出一张牌作为反应物,乙必须跟出一张能与其反应的牌,当反应物凑齐后,后面的玩家才能跟出该反应的生成物。若甲出的牌为“CaCO3”,乙有如下四张牌:“氧气”、“盐酸”、“ NaOH”、“ CuO”,则乙应跟出的牌为
(3)串出规则:甲出一个化学方程式,其他玩家也必须跟进一个基本反应类型相同的化学方程式。若甲出“NaOH+HCl=NaCl+H2O”,则乙应出
| A.NH3+HCl=NH4Cl | B.H2CO3=H2O+ CO2↑ |
| C.H2S+Cl2= 2HCl +S↓ | D.KI+AgNO3=KNO3+AgI↓ |
您最近一年使用:0次
填空与简答-流程题
|
较难
(0.4)
真题
【推荐2】化学小组欲测定某锌矿废渣(主要成分为Zn和少量CuO,其他杂质不溶于水且不参与反应)中锌的质量分数并回收金属铜。现利用稀硫酸、生铁粉末(Fe、C)等物质设计如下两个实验方案。
方案一:

方案二:

(1)方案一中,步骤Ⅰ所得固体与锌矿废渣的质量差为___________ 的质量。步骤Ⅲ所得滤液中的溶质是___________ ,对应滤渣的组成是___________ ;从该滤渣中回收金属铜,除稀硫酸外还需要的一种试剂是___________ 。
(2)方案二中,若不测滤渣的质量,结合下图所示实验装置,也可达成测定目的。除锌矿废渣质量外,还需测量的数据是___________ ;若省略步骤I,测定结果___________ (填“偏大”、“偏小”或“不变”)。
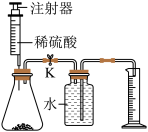
方案一:

方案二:

(1)方案一中,步骤Ⅰ所得固体与锌矿废渣的质量差为
(2)方案二中,若不测滤渣的质量,结合下图所示实验装置,也可达成测定目的。除锌矿废渣质量外,还需测量的数据是

您最近一年使用:0次
填空与简答-推断题
|
较难
(0.4)
【推荐3】如图所示,甲、乙、丙、丁、戊分别是铁、盐酸、氢氧化钡、硫酸铜、碳酸钠五种物质中的一种。相邻物质能够发生反应,甲是胃酸的主要成分。请回答下列问题:

(1)上述五种物质中,可用于配制波尔多液的是____ (填化学式);能相互反应生成气体的两种物质可能是____ 。
(2)若丙为氢氧化钡,则乙为___ ;戊为____ 。丙和丁发生反应的化学方程式为__ ,该反应属于____ (填基本反应类型)。

(1)上述五种物质中,可用于配制波尔多液的是
(2)若丙为氢氧化钡,则乙为
您最近一年使用:0次



