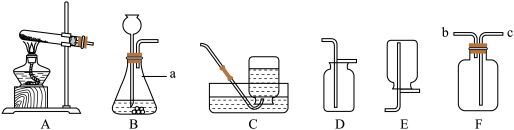
氢气是一种清洁、高能燃料。用图1、图2装置开展H2制取、性质的实验。
(1)如图1,制取氢气的化学方程式为______ ;可用排水法收集氢气的原因是______ ;当观察到______ 时,说明氢气已收集满。
(2)如图1,是H2还原CuO的实验。
①实验中要向试管内先通一会氢气,然后再加热的目的是______ 。
②反应过程中试管内固体由______ 色变红色,说明氢气具有还原性。
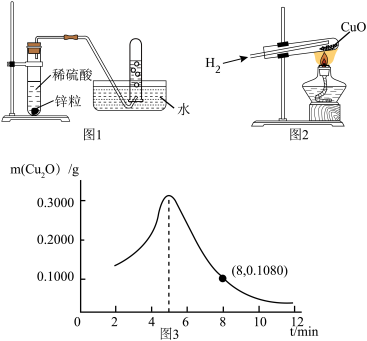
③称取0.6000g的CuO,用H2还原。用热分析仪检测到在不同时间(t)所得固体中Cu2O的质量(m)如图3所示。若反应进行至8分钟时,固体全部为红色。分析红色固体的组成及质量______ 。
(1)如图1,制取氢气的化学方程式为
(2)如图1,是H2还原CuO的实验。
①实验中要向试管内先通一会氢气,然后再加热的目的是
②反应过程中试管内固体由
③称取0.6000g的CuO,用H2还原。用热分析仪检测到在不同时间(t)所得固体中Cu2O的质量(m)如图3所示。若反应进行至8分钟时,固体全部为红色。分析红色固体的组成及质量
2024·上海崇明·二模 查看更多[1]
更新时间:2024-05-22 15:48:42
|
相似题推荐
实验题
|
适中
(0.65)
解题方法
【推荐1】某化学兴趣小组同学用下列仪器和装置制取乙烯(C2H4),并用过量的氧气将C2H4氧化成CO2和H2O,从而测定乙烯中碳、氢两种元素的质量比,如图所示,请回答下列问题。(据资料:有机物可能伴随少量不完全燃烧生成一种有毒气体;无水氯化钙是一种常见的吸水的干燥剂;NaOH固体可吸收二氧化碳气体。)
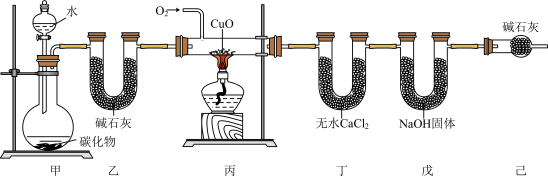
(1)实验室制备乙炔的化学方程式是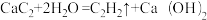 ;该小组同学受实验制备C2H2的启发,拟用Mg2C2与水反应来制备乙烯,写出该反应的化学方程式
;该小组同学受实验制备C2H2的启发,拟用Mg2C2与水反应来制备乙烯,写出该反应的化学方程式______ 。
(2)装置巳的作用是______ ;
(3)实验前称得丁、戊两装置的质量分别为m1g和n1g,实验完毕,称得丁、戊两装置的质量分别变为m2g和n2g,则测定乙烯中碳、氢两种元素的质量比为______ (列出算式)。
(4)若不接乙装置,则测定结果______ (填“偏高”、“偏低”或“不变”)。

(1)实验室制备乙炔的化学方程式是
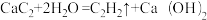 ;该小组同学受实验制备C2H2的启发,拟用Mg2C2与水反应来制备乙烯,写出该反应的化学方程式
;该小组同学受实验制备C2H2的启发,拟用Mg2C2与水反应来制备乙烯,写出该反应的化学方程式(2)装置巳的作用是
(3)实验前称得丁、戊两装置的质量分别为m1g和n1g,实验完毕,称得丁、戊两装置的质量分别变为m2g和n2g,则测定乙烯中碳、氢两种元素的质量比为
(4)若不接乙装置,则测定结果
您最近一年使用:0次
实验题
|
适中
(0.65)
解题方法
【推荐2】电石灯(如图一)是电力普及前最常用的照明工具之一,其剖面构造如图三所示。 电石灯的原理是利用固体电石(CaC2)与水反应生成氢氧化钙和可燃性的气体乙炔(C2H2),乙炔通过导管从出气口喷出,再被点燃就可以照明了。
请回答下列问题:
(1)照明时,电石放在___________ 腔室中(填“上”或“下”)。
(2)电石与水反应的化学方程式为___________ 。
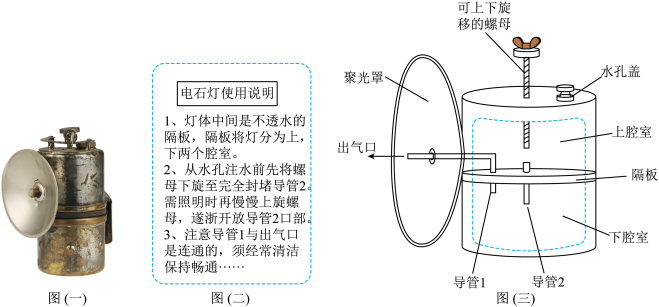
(3)如下图所示,在实验室提供的仪器中选择并组装一套模拟电石灯的装置,要求功能相仿,最佳组合方案是___________ (填标号)。
(4)下列与电石灯相关的说法正确的是___________(填标号)。
(5)9.6gCaC2与足量水充分反应产生的乙炔(C2H2)在灯口点燃,若消耗6.4g氧气,生成了2.7gH2O和2.2gCO2,则通过计算合理推测燃烧的产物除H2O和CO2外还有___________ (填化学式)。

请回答下列问题:
(1)照明时,电石放在
(2)电石与水反应的化学方程式为
(3)如下图所示,在实验室提供的仪器中选择并组装一套模拟电石灯的装置,要求功能相仿,最佳组合方案是

(4)下列与电石灯相关的说法正确的是___________(填标号)。
| A.电石应保存在湿润、阴凉处 |
| B.乙炔气体可用排水集气法收集 |
| C.19世纪初矿工使用电石灯在井下照明是因为其没有安全隐患 |
| D.实验室制取氧气和二氧化碳都可用与电石灯的结构相同的发生装置 |
| E.当电石灯照明产生大量黑烟时,说明乙炔燃烧不充分,此时应将螺母旋转上移 |
(5)9.6gCaC2与足量水充分反应产生的乙炔(C2H2)在灯口点燃,若消耗6.4g氧气,生成了2.7gH2O和2.2gCO2,则通过计算合理推测燃烧的产物除H2O和CO2外还有
您最近一年使用:0次
实验题
|
适中
(0.65)
【推荐3】二氧化锰因应用广泛而备受关注。某研究小组采用下图装置通过焙烧MnCO3制取MnO2,发生反应的化学方程式为: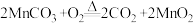 。
。
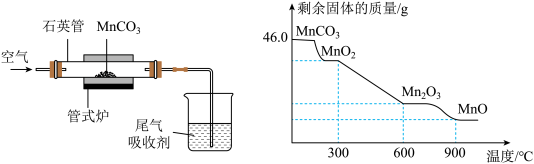
(1)实验过程中,石英管内剩余固体的质量和成分随温度的变化如上图所示,则焙烧MnCO3制取MnO2应该控制反应的温度不高于_______ ℃。
(2)若加热到300—900℃时,会分解产生一种常见气体,该气体为_______ (填化学式)。
(3)现有46.0gMnCO3,若把反应温度控制在900℃,充分反应后管内剩余固体的质量为___ g。
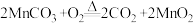 。
。
(1)实验过程中,石英管内剩余固体的质量和成分随温度的变化如上图所示,则焙烧MnCO3制取MnO2应该控制反应的温度不高于
(2)若加热到300—900℃时,会分解产生一种常见气体,该气体为
(3)现有46.0gMnCO3,若把反应温度控制在900℃,充分反应后管内剩余固体的质量为
您最近一年使用:0次
实验题
|
适中
(0.65)
【推荐1】探究可燃物燃烧条件的实验装置如图所示。
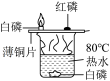
(1)薄铜片上的白磷燃烧而红磷不燃烧,由此说明可燃物燃烧需要什么条件?
(2)热水中的白磷没有燃烧,写出一种能使其燃烧的方法。
(3)写出白磷燃烧的化学方程式

(1)薄铜片上的白磷燃烧而红磷不燃烧,由此说明可燃物燃烧需要什么条件?
(2)热水中的白磷没有燃烧,写出一种能使其燃烧的方法。
(3)写出白磷燃烧的化学方程式
您最近一年使用:0次
实验题
|
适中
(0.65)
名校
解题方法
【推荐2】根据下列实验装置图,回答问题。
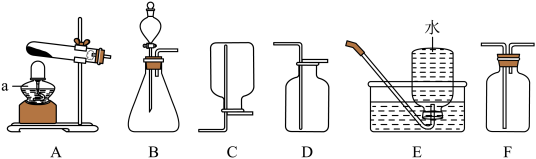
(1)A装置中,仪器a的名称是______ 。
(2)A装置可以制备的一种气体是______ ,试管口放一小团棉花的作用是______ ,制取该气体的化学方程式是______ ,检查装置气密性的方法是______ 。可用E装置收集该气体,其原因是______ ,还可以用于收集该气体的装置是______ (填图中字母序号,下同)。
(3)用B装置制备氧气的化学方程式是______ ,选择此装置的理由是______ 。
(4)现有如下资料:
①制取NO2的反应原理:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑ +2H2O。
②通常状况下,NO2是一种密度比空气大的有毒气体,能与水发生反应。
制取NO2气体应选用的发生装置是______ ,收集装置是______ 。

(1)A装置中,仪器a的名称是
(2)A装置可以制备的一种气体是
(3)用B装置制备氧气的化学方程式是
(4)现有如下资料:
①制取NO2的反应原理:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑ +2H2O。
②通常状况下,NO2是一种密度比空气大的有毒气体,能与水发生反应。
制取NO2气体应选用的发生装置是
您最近一年使用:0次
实验题
|
适中
(0.65)
解题方法
【推荐1】某混合气体可能有CO2、CO、H2中的一种或几种,某学习小组的同学为了研究气体的组成,设计了如图装置进行实验(夹持装置已省略)。实验后发现A装置中溶液变浑浊,C中的固体由黑色边红色,D中的固体有白色变蓝色,F装置中有水流入烧杯。
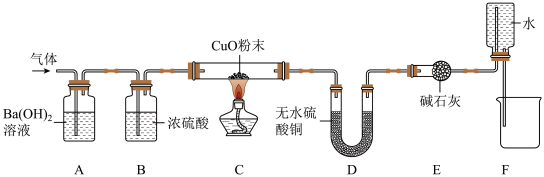
在反应前后对C、D装置进行了质量的测量(各步反应均完全),测量结果如表:
请分析回答下列问题:
(1)请写出A装置中反应的化学方程式____________________________ 。
(2)一定能证明混合气体中有氢气存在的实验现象是_____________________________ 。
(3)F装置的作用:①“抽气”;②______________ 。
(4)证明原混合气体中有CO存在的定量关系是______________ (用字母a、b、c、d表示)。

在反应前后对C、D装置进行了质量的测量(各步反应均完全),测量结果如表:
| 反应前后 | 反应前 | 反应后 |
| C装置中试管与固体的总质量(克) | a | c |
| D装置中U形管与固体的总质量(克) | b | d |
请分析回答下列问题:
(1)请写出A装置中反应的化学方程式
(2)一定能证明混合气体中有氢气存在的实验现象是
(3)F装置的作用:①“抽气”;②
(4)证明原混合气体中有CO存在的定量关系是
您最近一年使用:0次
实验题
|
适中
(0.65)
真题
【推荐2】化学是一门以实验为基础的科学。已知CuSO4(白色)+5H2O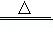 CuSO4•5H2O(蓝色),请根据下列仪器和实验装置回答有关问题。
CuSO4•5H2O(蓝色),请根据下列仪器和实验装置回答有关问题。
(1)E装置中X的名称是_____ 。
(2)氢气中混有的氯化氢气体可选用_____ 装置来除去,气流应从_____ 口进。
(3)已知氢气还原氧化铜可在E装置中完成,则反应过程中E装置中的现象是_____ ,验证E装置产生的水可选用_____ 装置。
(4)用所给仪器和药品制备纯净干燥的氢气来还原氧化铜并验证生成的水。请按气流从左到右方向,用仪器接口字母表示连接顺序_____ 。
 CuSO4•5H2O(蓝色),请根据下列仪器和实验装置回答有关问题。
CuSO4•5H2O(蓝色),请根据下列仪器和实验装置回答有关问题。
(1)E装置中X的名称是
(2)氢气中混有的氯化氢气体可选用
(3)已知氢气还原氧化铜可在E装置中完成,则反应过程中E装置中的现象是
(4)用所给仪器和药品制备纯净干燥的氢气来还原氧化铜并验证生成的水。请按气流从左到右方向,用仪器接口字母表示连接顺序
您最近一年使用:0次
实验题
|
适中
(0.65)
解题方法
【推荐3】实验室有一包久置的生铁粉末(成分为铁、碳和氧化铁)。为测定各组分的质量分数,将20g生铁粉末均分成两份,进行如下实验。(装置气密性良好)
实验一:测定碳的质量分数
(1)将10g样品于足量的稀硫酸反应,待反应结束,过滤,得滤渣0.36g,则碳的质量分数为________ 。
实验二:测定氧化铁的质量分数
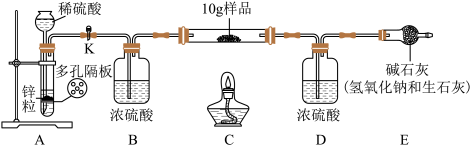
(2)按上图连接装置。点燃酒精灯前,先进行的操作是打开K并______ 。
(3)A装置发生反应的化学方程式______ 。
(4)反应一段时间,待D装置内的液体质量不再增加时,熄灭酒精灯。此时不宜关闭K,原因是______ 。
(5)若省略B装置,会导致测得氧化铁的质量分数_______ (选填“偏大”、“偏小”或“无影响”)。
(6)冷却至室温,关闭K,称得D装置反应前后增重了0.54g。若硬质玻璃管中剩余固体除了单质铁,还有碳,则10g样品中氧化铁的质量m合理的范围是______。
实验一:测定碳的质量分数
(1)将10g样品于足量的稀硫酸反应,待反应结束,过滤,得滤渣0.36g,则碳的质量分数为
实验二:测定氧化铁的质量分数

(2)按上图连接装置。点燃酒精灯前,先进行的操作是打开K并
(3)A装置发生反应的化学方程式
(4)反应一段时间,待D装置内的液体质量不再增加时,熄灭酒精灯。此时不宜关闭K,原因是
(5)若省略B装置,会导致测得氧化铁的质量分数
(6)冷却至室温,关闭K,称得D装置反应前后增重了0.54g。若硬质玻璃管中剩余固体除了单质铁,还有碳,则10g样品中氧化铁的质量m合理的范围是______。
| A.m<1.6 | B.1.6≤m<4.8 | C.1.6≤m<3.2 | D.3.2<m<4.8 |
您最近一年使用:0次
实验题
|
适中
(0.65)
名校
【推荐1】请根据下列装置如图,回答问题:
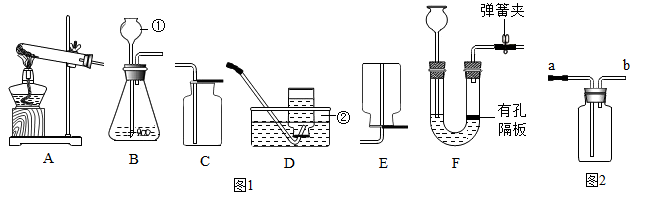
(1)写出标号①的仪器名称_______________ 。
(2)某同学想要用氯酸钾制取一瓶较干燥的氧气,他应该从装置A~F中选择(填番号)______ 进行组合,写出氯酸钾制取氧气的化学方程式__________ 。
(3)若选择装置F作为制取氢气的发生装置,其优点是_____ 。用图2所示的装置来收集,氢气应从_____ (选填“a”或“b”)导管口进入。

(1)写出标号①的仪器名称
(2)某同学想要用氯酸钾制取一瓶较干燥的氧气,他应该从装置A~F中选择(填番号)
(3)若选择装置F作为制取氢气的发生装置,其优点是
您最近一年使用:0次
【推荐2】实验室制取气体常常用到下列装置,根据给出的装置回答下列问题:
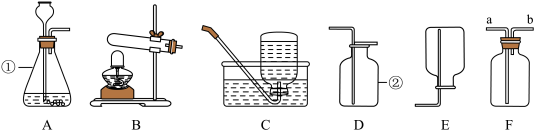
(1)写出标号仪器的名称:①________ ;②_______ 。
(2)若选择高锰酸钾制取并收集较纯净的O2,则应选择装置(填序号)_____ ,该套装置有一处不足的地方,请你加以改进________ ,该反应的化学方程式为________ 。
(3)用图F装置可以收集氧气,若用向上排气法,气体应从_______ (填“a”或“b”)端进入。
(4)用图F装置可以收集氢气,气体应从_______ (填“a”或b")端进入。
(5)小雄同学从上述装置图中选用适当的装置成功的制备和收集了二氧化碳,选用的A装置优点是________ 。

(1)写出标号仪器的名称:①
(2)若选择高锰酸钾制取并收集较纯净的O2,则应选择装置(填序号)
(3)用图F装置可以收集氧气,若用向上排气法,气体应从
(4)用图F装置可以收集氢气,气体应从
(5)小雄同学从上述装置图中选用适当的装置成功的制备和收集了二氧化碳,选用的A装置优点是
您最近一年使用:0次
【推荐3】如图是实验室制取气体的常用装置。___________ 。
(2)常温下金属锌和稀硫酸混合物可制取氢气,则制取纯净的氢气用的一套装置为___________ (填字母)。若用G装置收集氢气,则氢气从___________ (填“a”或“b”)端进入集气瓶。
(3)若选择气体发生装置B制取氧气,请写出有关反应的化学方程式___________ ;比起装置B,装置C的优点是__________ 。实验室可选择E装置收集氧气,验满的方法是__________ ;
(4)氧气的性质实验按如图所示进行,该实验能得出的结论是__________(选填序号)。
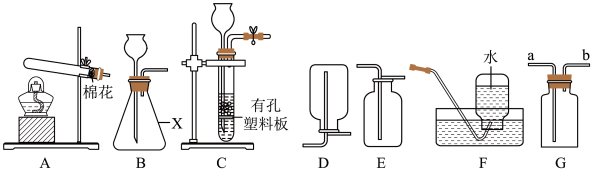
(2)常温下金属锌和稀硫酸混合物可制取氢气,则制取纯净的氢气用的一套装置为
(3)若选择气体发生装置B制取氧气,请写出有关反应的化学方程式
(4)氧气的性质实验按如图所示进行,该实验能得出的结论是__________(选填序号)。
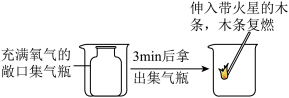
| A.氧气具有助燃性 | B.氧气密度比空气大 |
| C.分子在不断运动 | D.氧气不易溶于水 |
您最近一年使用:0次