某同学要探究燃烧的条件和空气中氧气的含量,进行了如下实验.
【实验一】(已知:白磷的着火点为40℃)
(1)对比步骤Ⅱ和Ⅳ的现象可知,可燃物燃烧的条件之一是_________
(2)待装置冷却一段时间后,打开K2,如果观察到__________ ,说明空气中氧气的体积约占1/5.若实验测得空气中氧气的体积分数小于1/5,原因可能是________ (答一条即可).
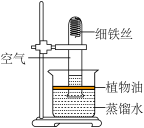
【实验二】用如图所示装置,利用铁生锈的原理也可以比较准确地测出空气中氧气的含量,若将此装置中的细铁丝换成足量的细铜丝进行实验,能否比较准确地测出空气中氧气的含量,并说明理由________ .【已知:铜能与空气中氧气、水、二氧化碳反应生成铜绿.化学方程式:2Cu+O2+H2O+CO2=Cu(OH)2CO3】
【实验一】(已知:白磷的着火点为40℃)
| 实验装置 | 实验步骤及现象 |
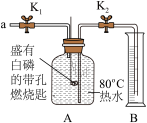 | 步骤Ⅰ 检验装置的气密性,气密性良好. 步骤Ⅱ 将盛有白磷的带孔燃烧匙伸入A瓶中,白磷不燃烧. 步骤Ⅲ 向A瓶中加满80℃热水,塞紧瓶塞,白磷不燃烧. 步骤Ⅳ 打开K1、K2,从a口向瓶中鼓入空气,待瓶中的液面低于燃烧匙底部时,关闭K1、K2.此时进入量筒B中水的体积为200mL,观察到A瓶中的白磷燃烧. |
(2)待装置冷却一段时间后,打开K2,如果观察到
【实验二】用如图所示装置,利用铁生锈的原理也可以比较准确地测出空气中氧气的含量,若将此装置中的细铁丝换成足量的细铜丝进行实验,能否比较准确地测出空气中氧气的含量,并说明理由

更新时间:2017-09-14 11:20:44
|
相似题推荐
科学探究题
|
适中
(0.65)
解题方法
【推荐1】某化学兴趣小组对课本实验“测定空气中氧气的含量”,实验完毕后集气瓶中是否还含有氧气产生质疑,于是同学们设计了如图1装置来探究磷在空气中燃烧后氧气浓度的变化情况。

【提出问题】足量红磷在密闭的四颈平底瓶内燃烧熄灭后,容器中是否有氧气剩余?
【作出猜想】猜想①:有氧气剩余;猜想②:无氧气剩余。
【实验验证】该小组同学按图1组装好实验装置,利用高能激光笔照射燃烧匙上的红磷,红磷燃烧直至熄灭;待装置完全冷却后,将装有白磷的燃烧匙提出水面,再次用高能激光笔照射,白磷居然也被点燃。
(1)激光笔的作用是___________ 。
(2)红磷燃烧产物产生大量白烟,其反应的文字或者符号表达式为___________ 。
【实验结论】
(3)根据上述实验现象,得出的结论是:猜想___________ 正确。
(4)课本上用红磷燃烧的方法___________ (填“能”或“不能”)精确地测定空气中氧气的含量,理由是___________ 。
【拓展延伸】
(5)图2是该小组同学从开始实验到最后装置冷却后的整个实验过程中,用传感器测量容器内氧气浓度变化的曲线图。在图2中___________ (填“A、B、C、D、E”)点时红磷燃烧熄灭;白磷开始燃烧至燃烧结束对应的曲线为___________ 段(用图2中字母表示)。
【反思与评价】
(6)兴趣小组分析对比曲线BC段和DE段,得出了“不同物质燃烧,需要的氧气浓度不一样”的结论。同学们由此联想到课本上的一个实验:___________ (填物质名称)在空气中不能点燃,但在氧气中能点燃并剧烈燃烧。

【提出问题】足量红磷在密闭的四颈平底瓶内燃烧熄灭后,容器中是否有氧气剩余?
【作出猜想】猜想①:有氧气剩余;猜想②:无氧气剩余。
【实验验证】该小组同学按图1组装好实验装置,利用高能激光笔照射燃烧匙上的红磷,红磷燃烧直至熄灭;待装置完全冷却后,将装有白磷的燃烧匙提出水面,再次用高能激光笔照射,白磷居然也被点燃。
(1)激光笔的作用是
(2)红磷燃烧产物产生大量白烟,其反应的文字或者符号表达式为
【实验结论】
(3)根据上述实验现象,得出的结论是:猜想
(4)课本上用红磷燃烧的方法
【拓展延伸】
(5)图2是该小组同学从开始实验到最后装置冷却后的整个实验过程中,用传感器测量容器内氧气浓度变化的曲线图。在图2中
【反思与评价】
(6)兴趣小组分析对比曲线BC段和DE段,得出了“不同物质燃烧,需要的氧气浓度不一样”的结论。同学们由此联想到课本上的一个实验:
您最近半年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐2】二百多年前,法国化学家拉瓦锡用定量的方法研究了空气的成分。仿照这个历史上著名实验的原理,教材中用红磷来测定空气中氧气的含量(如图所示)。

【提出问题】用红磷燃烧的方法为什么测出的氧气含量远低于21%?
【分析讨论】
(1)①实验装置漏气;②_______ ,导致装置内氧气有剩余;③……
【实验与交流】在老师的指导下,同学们查阅了红磷、白磷两种物质的着火点及其燃烧需要的最低含氧量如表:
甲、乙两小组分别用过量红磷、白磷进行该实验,用测氧气浓度的传感器测得反应后的氧气浓度分别为8.85%、3.21%,数据与表中的理论值基本一致。
(2)红磷燃烧的化学方程式为______ 。
(3)红磷和白磷相比,使用白磷消耗氧气要多一些,测量结果更准确,说明原因______ 。
(4)有同学提议选用木炭替代红磷做实验,在集气瓶底部预先放适量氢氧化钠溶液吸收生成的二氧化碳气体,小明认为该方案不可行,请说明他的理由______ 。

【提出问题】用红磷燃烧的方法为什么测出的氧气含量远低于21%?
【分析讨论】
(1)①实验装置漏气;②
【实验与交流】在老师的指导下,同学们查阅了红磷、白磷两种物质的着火点及其燃烧需要的最低含氧量如表:
| 可燃物 | 红磷 | 白磷 |
| 着火点/℃ | 240 | 40 |
| 最低含氧量/% | 8.0 | 4.0 |
(2)红磷燃烧的化学方程式为
(3)红磷和白磷相比,使用白磷消耗氧气要多一些,测量结果更准确,说明原因
(4)有同学提议选用木炭替代红磷做实验,在集气瓶底部预先放适量氢氧化钠溶液吸收生成的二氧化碳气体,小明认为该方案不可行,请说明他的理由
您最近半年使用:0次
科学探究题
|
适中
(0.65)
解题方法
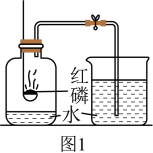
【推荐3】化学兴趣小组在完成“测定空气里氧气含量”(如图1)的实验后,欲对该实验可选用的药品进行继续探究,他们进行了如图实验:
【回顾旧知】
(1)红磷燃烧产生的明显现象是______ ;该反应的化学方程式______ 。
(2)该实验的原理:红磷燃烧消耗了空气中的氧气,瓶内的气压______ (填“增大”或“减小”),烧杯中的水倒吸进入瓶内,进入瓶内水的体积就是被消耗的氧气的体积。
【提出问题】能不能用硫代替红磷测定空气中氧气的含量?
【查阅资料】相同条件下,气体的压强与气体所占的体积成正比。
【设计与实验】小组同学按图2装置进行实验,分别将红磷、硫放入集气瓶中燃烧,采集数据如图3、图4(注:装置气密性良,P0是瓶内初始气压,P1和P2是反应结束恢复到室温时瓶内的气压)。

【问题与现象分析】
(3)开始反应时瓶内压强瞬间变大的主要原因是______ 。
【结论与反思】
(4)写出图2实验中硫燃烧的化学方程式______ ,由实验数据可知,______ (填“能”或“不能”)用硫代替红磷测定空气中氧气的含量。
(5)用燃烧法测定空气中氧气的含量,在选择药品时,对生成物应考虑的因素是______ 。
【拓展与延伸】同学查阅资料了解到不用燃烧法也能测定空气中氧气的含量。他们设计了图5装置再次进行实验(铁生锈会消耗氧气饱和食盐水、活性炭会加速铁生锈),记录数据如表。
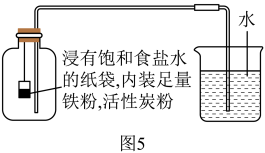
(6)根据表中数据计算,该实验测得空气中氧气的体积分数是______ (计算结果精确到0.1%)。
(7)与燃烧法测定空气中氧气的含量的实验相比,该实验的优点是______ (写一条)。

【回顾旧知】
(1)红磷燃烧产生的明显现象是
(2)该实验的原理:红磷燃烧消耗了空气中的氧气,瓶内的气压
【提出问题】能不能用硫代替红磷测定空气中氧气的含量?
【查阅资料】相同条件下,气体的压强与气体所占的体积成正比。
【设计与实验】小组同学按图2装置进行实验,分别将红磷、硫放入集气瓶中燃烧,采集数据如图3、图4(注:装置气密性良,P0是瓶内初始气压,P1和P2是反应结束恢复到室温时瓶内的气压)。

【问题与现象分析】
(3)开始反应时瓶内压强瞬间变大的主要原因是
【结论与反思】
(4)写出图2实验中硫燃烧的化学方程式
(5)用燃烧法测定空气中氧气的含量,在选择药品时,对生成物应考虑的因素是
【拓展与延伸】同学查阅资料了解到不用燃烧法也能测定空气中氧气的含量。他们设计了图5装置再次进行实验(铁生锈会消耗氧气饱和食盐水、活性炭会加速铁生锈),记录数据如表。

| 测量项目 | 实验前 | 实验后 | |
| 烧杯中水的体积 | 集气瓶(扣除内容物)和导管的容积 | 烧杯中剩余水的体积 | |
| 体积/mL | 80.0 | 180.0 | 43.1 |
(6)根据表中数据计算,该实验测得空气中氧气的体积分数是
(7)与燃烧法测定空气中氧气的含量的实验相比,该实验的优点是
您最近半年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐1】化学是以实验为基础的科学,某兴趣小组的同学在学习了探究“燃烧的条件”实验后,对书上的实验进行了改进,实验装置如下:利用下图微型装置探究燃烧的条件(整套装置气密性良好)。
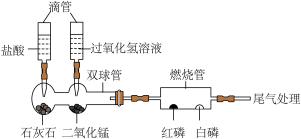
(1)【进行探究】
实验步骤如下:
①挤压左边滴管并微热燃烧管,白磷、红磷均不燃烧。
②挤压右边滴管并微热燃烧管,白磷燃烧而红磷不燃烧。
【实验结论】
步骤①说明燃烧的条件之一是__________ 。
(2)步骤②说明燃烧的条件之一为温度达到可燃物的__________ ;请写出该步骤中双球管内发生反应的化学方程式:__________ 。
(3)【实验交流】使用该装置进行实验的优点是________ 。(写一点即可)
(4)【实验反思】实验结束后,小明想到学习金属的化学性质时,老师讲到镁带不仅可以与空气中的氧气发生反应在,还能与空气中的CO2发生反应,小明对燃烧的条件及其应用有了新的认识。燃烧_________ (填“一定”或“不一定”)需要氧气。
(5)镁等活泼金属着火时,___________ (填能”或不能")用二氧化碳灭火。

(1)【进行探究】
实验步骤如下:
①挤压左边滴管并微热燃烧管,白磷、红磷均不燃烧。
②挤压右边滴管并微热燃烧管,白磷燃烧而红磷不燃烧。
【实验结论】
步骤①说明燃烧的条件之一是
(2)步骤②说明燃烧的条件之一为温度达到可燃物的
(3)【实验交流】使用该装置进行实验的优点是
(4)【实验反思】实验结束后,小明想到学习金属的化学性质时,老师讲到镁带不仅可以与空气中的氧气发生反应在,还能与空气中的CO2发生反应,小明对燃烧的条件及其应用有了新的认识。燃烧
(5)镁等活泼金属着火时,
您最近半年使用:0次
科学探究题
|
适中
(0.65)
【推荐2】某化学小组围绕燃烧与灭火的主题开展了相关活动。请你参与完成:
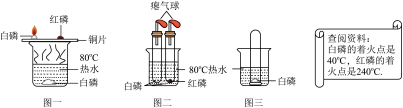
【知识回忆】
从图一中观察到的现象及所得到结论正确 的是____________ 。
A.实验中烧杯里的热水只起提高温度的作用
B.水下白磷未燃烧是由于没有与氧气接触
C.实验不能比较白磷和红磷的着火点高低
D.实验说明可燃物燃烧时,温度必须达到着火点或与氧气接触
由此可知可燃物燃烧的必备条件是_____________________________________________ ;
【交流讨论】
⑴改进后的装置(如图二)与图一相比,其优点是______________________________ 。欲使图二中的红磷着火,可将试管从水中取出并________ 后才能对试管加热。
⑵将装有某气体的大试管口朝下垂直插入水中,使试管罩住白磷(如图三所示),结果观察到了“水火相容”的奇观,则大试管所装气体可能是_________ ;
【综合应用】
⑴“水火不相容”是指水能灭火,其实水有时也可以“生火”,比如钾遇水会立刻着火,此时可以用___________ 灭火,原理是____________________________ 。
⑵学习化学的目的并不在于要成为化学家,重要的是善于用化学知识去分析、解决生产生活中的问题。从化学的角度看,下列做法中不正确 的是________ 。
A.家用电器着火,应先切断电源再用泡沫灭火器灭火
B.油锅着火,应迅速向锅中掺水,降低温度使其熄灭
C.大楼里着火时,应该用湿毛巾捂住口鼻,俯下身子逃出火灾区
D.室内起火时,应打开门窗,避免吸入浓烟
E.森林失火,向逆风方向奔跑逃离火灾区

【知识回忆】
从图一中观察到的现象及所得到结论
A.实验中烧杯里的热水只起提高温度的作用
B.水下白磷未燃烧是由于没有与氧气接触
C.实验不能比较白磷和红磷的着火点高低
D.实验说明可燃物燃烧时,温度必须达到着火点或与氧气接触
由此可知可燃物燃烧的必备条件是
【交流讨论】
⑴改进后的装置(如图二)与图一相比,其优点是
⑵将装有某气体的大试管口朝下垂直插入水中,使试管罩住白磷(如图三所示),结果观察到了“水火相容”的奇观,则大试管所装气体可能是
【综合应用】
⑴“水火不相容”是指水能灭火,其实水有时也可以“生火”,比如钾遇水会立刻着火,此时可以用
⑵学习化学的目的并不在于要成为化学家,重要的是善于用化学知识去分析、解决生产生活中的问题。从化学的角度看,下列做法中
A.家用电器着火,应先切断电源再用泡沫灭火器灭火
B.油锅着火,应迅速向锅中掺水,降低温度使其熄灭
C.大楼里着火时,应该用湿毛巾捂住口鼻,俯下身子逃出火灾区
D.室内起火时,应打开门窗,避免吸入浓烟
E.森林失火,向逆风方向奔跑逃离火灾区
您最近半年使用:0次
科学探究题
|
适中
(0.65)
解题方法
【推荐3】化学课上,周老师给同学们表演了一个“水能生火”的魔术(如图1),他将包有过氧化钠(Na2O2)粉末的脱脂棉放在陶土网上,向棉花上滴了几滴水,棉花立刻燃烧起来,同学们产生了浓厚的兴趣,为什么脱脂棉会燃烧起来呢?

【查阅资料】脱脂棉易吸水、易燃烧,是经过化学方法处理过的棉花。
【提出猜想】
(1)小红的猜想:过氧化钠与水反应生成了可以支持燃烧的物质;小芳的猜想:过氧化钠与水反应会___________ (填“吸收”或“放出”)热量。
【实验探究】同学们设计了如图2的实验装置:
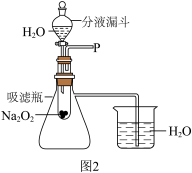
(2)打开分液漏斗的活塞,控制水滴加的速度,看到试管中有气泡产生,将带火星的木条靠近P出口,看到___________ ,由此验证了小红的猜想。
(3)实验中还观察到烧杯中导管口的现象是___________ ,由此验证了小芳的猜想。
(4)完成了以上实验,老师介绍过氧化钠(Na2O2)粉末与水反应的产物一共有两种,其中,可以支持燃烧的气体物质为___________ ,继续探究反应后生成的另一种物质是氢氧化钠(化学式为:NaOH),请写出过氧化钠(Na2O2)粉末与水反应的化学方程式:___________ 。
【拓展延伸】
(5)过氧化钠经常被用于潜水艇和防毒面具中提供氧气,反应的化学方程式为 ,则推测X的化学式为
,则推测X的化学式为___________ 。

【查阅资料】脱脂棉易吸水、易燃烧,是经过化学方法处理过的棉花。
【提出猜想】
(1)小红的猜想:过氧化钠与水反应生成了可以支持燃烧的物质;小芳的猜想:过氧化钠与水反应会
【实验探究】同学们设计了如图2的实验装置:

(2)打开分液漏斗的活塞,控制水滴加的速度,看到试管中有气泡产生,将带火星的木条靠近P出口,看到
(3)实验中还观察到烧杯中导管口的现象是
(4)完成了以上实验,老师介绍过氧化钠(Na2O2)粉末与水反应的产物一共有两种,其中,可以支持燃烧的气体物质为
【拓展延伸】
(5)过氧化钠经常被用于潜水艇和防毒面具中提供氧气,反应的化学方程式为
 ,则推测X的化学式为
,则推测X的化学式为
您最近半年使用:0次



