1 . 下列说法正确的是
| A.等质量的SO2和SO3中,硫元素的质量比为4∶5 |
| B.等质量的 NaHCO3和MgCO3分别与足量稀盐酸充分反应,生成CO2的质量相等 |
| C.高温条件下48g某铁的氧化物与足量CO充分反应,得到33.6gFe,该氧化物的化学式为Fe3O4 |
| D.把碳和铜的混合物与过量的氧气充分反应,所得固体质量等于原混合物的质量,该混合物中碳的质量分数为20% |
您最近一年使用:0次
2021-05-25更新
|
355次组卷
|
3卷引用:2022年中考风向标-天津-化学计算
解题方法
2 . 在生活和化学实验中,经常用到各种除湿剂(或干燥剂)。某化学实验小组的同学们关于除湿剂提出了下面两个问题,他们查阅资料,并进行下面的数字化实验探究。请回答下列问题:
【查阅资料】
(1) ①硅胶:无色或白色颗粒,吸水量为 30%~35%,加热到200~350℃可以反复使用。其主要成分可看作是SiO2,其中Si元素的化合价为______ 。
②生石灰:白色块状固体,吸水后生成熟石灰。
③浓硫酸:无色粘稠液体,有吸水性,在化学实验中常用它作干燥剂,但日常生活中却很少用它作除湿剂。其原因是______ (写出一条即可)。
【问题一】除湿剂是否真的可以除湿?
【实验一】探究浓硫酸对氧气的干燥情况。用10%的过氧化氢溶液和二氧化锰制取的氧气,通过浓硫酸两次干燥,将湿度传感器放入收集氧气的密封保鲜袋内,连接数据采集器和电脑。实验装置如图1,约采集5 min,得到变化曲线如图2。

(2)图1中发生的化学方程式为______ 。分析图2曲线,袋内湿度明显降低,说明______ 。随着时间变化,浓硫酸的吸水速率逐渐减小的原因是______ 。
【实验二】探究市售硅胶除湿剂是否真的可以除湿。实验如图3,用25 mL烧杯盛放等体积、等温度的两杯水,分别放在生化密闭实验器中,其中一个实验器中加20.0 g 硅胶,连接数据采集器和电脑。约采集 15 min,得到变化曲线如图4。
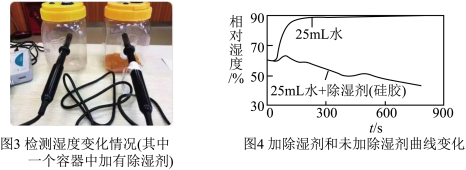
(3)分析图4曲线,未加硅胶的实验器内相对湿度增大的原因是______ (从微观角度解释)。加硅胶的实验器内______ ,说明硅胶除湿剂的确可以除湿。
【问题二】哪种成分的除湿剂除湿效果更好?
【实验三】探究不同成分的除湿剂的除湿效果。实验方法和实验装置与实验二相同,分别称取硅胶、蒙脱石、氯化钙除湿剂各20.0 g,放入3个相同的生化密闭实验器中,连接数据采集器和电脑。约采集 20 min,得到变化曲线如图 5。
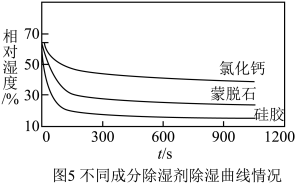
(4)分析图5曲线,这三种除湿剂中单位时间内吸附水速率的快慢和除湿效果的强弱顺序都是______ 。再通过图2、图5的曲线对比,发现______ 的干燥效果都低于其他除湿剂,这是生活中很少用它作除湿剂的另一个原因。
【实验结论】市售除湿剂的确可以除湿;对比的几种除湿剂中硅胶的除湿效果最好,速率最快。不同成分的除湿剂除湿效果除了与所含成分不同外,还可能与______ (写一条即可)等因素有关系。
【拓展提升】
(5)同学们查阅资料还发现:还原铁粉(灰色或黑色粉末,又称“双吸剂”),也能够吸收空气中的水分和氧气,常用于食品保鲜。检验使用一段时间后的“双吸剂”是否仍然有效的化学方法及现象是:______ 。已知某袋装食品的脱氧剂由活性炭、铁粉和食盐,按质量比为 2:2:1混合而成。求5.0 g未经使用的该脱氧剂最多能够吸收氧气______ g (保留两位小数)。
【查阅资料】
(1) ①硅胶:无色或白色颗粒,吸水量为 30%~35%,加热到200~350℃可以反复使用。其主要成分可看作是SiO2,其中Si元素的化合价为
②生石灰:白色块状固体,吸水后生成熟石灰。
③浓硫酸:无色粘稠液体,有吸水性,在化学实验中常用它作干燥剂,但日常生活中却很少用它作除湿剂。其原因是
【问题一】除湿剂是否真的可以除湿?
【实验一】探究浓硫酸对氧气的干燥情况。用10%的过氧化氢溶液和二氧化锰制取的氧气,通过浓硫酸两次干燥,将湿度传感器放入收集氧气的密封保鲜袋内,连接数据采集器和电脑。实验装置如图1,约采集5 min,得到变化曲线如图2。

(2)图1中发生的化学方程式为
【实验二】探究市售硅胶除湿剂是否真的可以除湿。实验如图3,用25 mL烧杯盛放等体积、等温度的两杯水,分别放在生化密闭实验器中,其中一个实验器中加20.0 g 硅胶,连接数据采集器和电脑。约采集 15 min,得到变化曲线如图4。

(3)分析图4曲线,未加硅胶的实验器内相对湿度增大的原因是
【问题二】哪种成分的除湿剂除湿效果更好?
【实验三】探究不同成分的除湿剂的除湿效果。实验方法和实验装置与实验二相同,分别称取硅胶、蒙脱石、氯化钙除湿剂各20.0 g,放入3个相同的生化密闭实验器中,连接数据采集器和电脑。约采集 20 min,得到变化曲线如图 5。

(4)分析图5曲线,这三种除湿剂中单位时间内吸附水速率的快慢和除湿效果的强弱顺序都是
【实验结论】市售除湿剂的确可以除湿;对比的几种除湿剂中硅胶的除湿效果最好,速率最快。不同成分的除湿剂除湿效果除了与所含成分不同外,还可能与
【拓展提升】
(5)同学们查阅资料还发现:还原铁粉(灰色或黑色粉末,又称“双吸剂”),也能够吸收空气中的水分和氧气,常用于食品保鲜。检验使用一段时间后的“双吸剂”是否仍然有效的化学方法及现象是:
您最近一年使用:0次
解题方法
3 . 下列说法中,正确的是
| A.质量相等的二氧化硫和三氧化硫中,氧元素的质量比为6:5 |
| B.某氮的氧化物中,氮、氧元素的质量比为7:12,该氧化物的化学式为N2O3 |
| C.将铁和碳的混合物ag,在氧气中充分灼烧,冷却后称量剩余固体的质量仍为ag,则混合物中碳的质量分数为30.0% |
| D.铜和氧化铜的混合物5.6g,与过量的一氧化碳充分反应后,得到固体物质为4.8g,则原混合物中铜单质的质量分数为28.6% |
您最近一年使用:0次
解题方法
4 . 化学实验离不开实验装置的改进和实验探究。
①根据以下实验回答问题:
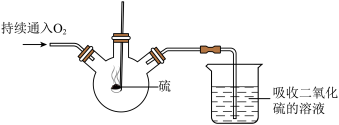
资料:甲酸(HCOOH)在热的浓硫酸中分解,生成CO和H2O。(夹持仪器省略)
实验一:观察到湿润的蓝色石蕊试纸变红,说明分子具有的性质______ 。
实验二:硫在氧气中燃烧时,产生明亮的_____ 色火焰;该实验装置的优点是_____ (写出一点即可)。
实验三:B处观察到的现象是_____ ;C处反应的化学方程式为____ ;为了排尽空气防止爆炸,应先点燃____ (选填“A”或“B”)处的酒精灯。
②兴趣小组对镁带变黑后的物质(主要成分是碱式碳酸镁)进行了探究。
【查阅资料】
Ⅰ.碱式碳酸镁的化学式可表示为Mga(OH)b(CO3)c,该物质加热后生成MgO、H2O、CO2三种氧化物;
Ⅱ.氢氧化钠溶液能吸收二氧化碳,生成碳酸钠和水。
【实验步骤和数据】为确定碱式碳酸镁的化学式,按如图所示装置进行实验。
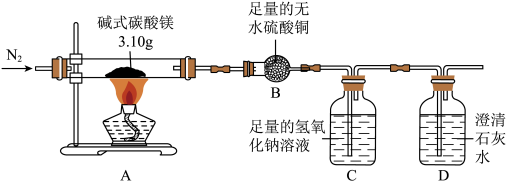
步骤一:夹住弹簧夹,微热A处玻璃管;
步骤二:点燃酒精灯,至固体完全分解;
步骤三:熄灭酒精灯,通入氮气至冷却。
称量B、C两处,所得数据如下表:(A处产生的水蒸气和二氧化碳全部被吸收)
【解释与结论】
Ⅰ.证明整套装置不漏气的现象是_______ ;
Ⅱ.B处反应的化学方程式为_______ ;
Ⅲ.通过上述数据计算可得:该碱式碳酸镁Mga(OH)b(CO3)c中a:b:c=_______ ;(忽略空气中成分及其它因素的影响)
①根据以下实验回答问题:
| 实验一:验证分子的性质 | 实验二:硫在氧气中燃烧 | 实验三:一氧化碳还原氧化铜 |
 |  | 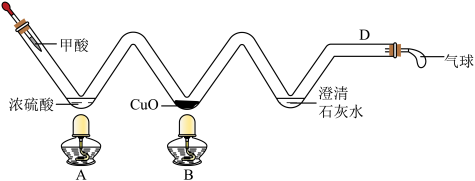 |
实验一:观察到湿润的蓝色石蕊试纸变红,说明分子具有的性质
实验二:硫在氧气中燃烧时,产生明亮的
实验三:B处观察到的现象是
②兴趣小组对镁带变黑后的物质(主要成分是碱式碳酸镁)进行了探究。
【查阅资料】
Ⅰ.碱式碳酸镁的化学式可表示为Mga(OH)b(CO3)c,该物质加热后生成MgO、H2O、CO2三种氧化物;
Ⅱ.氢氧化钠溶液能吸收二氧化碳,生成碳酸钠和水。
【实验步骤和数据】为确定碱式碳酸镁的化学式,按如图所示装置进行实验。

步骤一:夹住弹簧夹,微热A处玻璃管;
步骤二:点燃酒精灯,至固体完全分解;
步骤三:熄灭酒精灯,通入氮气至冷却。
称量B、C两处,所得数据如下表:(A处产生的水蒸气和二氧化碳全部被吸收)
| 反应前质量 | 反应后质量 | |
| B:干燥管和固体 | 51.10g | 51.28g |
| C:广口瓶和液体 | 82.00g | 83.32g |
Ⅰ.证明整套装置不漏气的现象是
Ⅱ.B处反应的化学方程式为
Ⅲ.通过上述数据计算可得:该碱式碳酸镁Mga(OH)b(CO3)c中a:b:c=
您最近一年使用:0次
名校
5 . 已知23g某化合物R在氧气中完全燃烧,生成44g二氧化碳和27g水,则下列有关R的元素组成说法正确的是
| A.一定含有碳、氢、氧三种元素 |
| B.一定含有碳元素和氢元素,可能含有氧元素 |
| C.一定含有碳元素和氢元素,一定不含氧元素 |
| D.无法确定 |
您最近一年使用:0次
2021-01-13更新
|
475次组卷
|
4卷引用:第十一讲 质量守恒定律-备战2024年中考化学一轮复习学·练·考(全国通用)
(已下线)第十一讲 质量守恒定律-备战2024年中考化学一轮复习学·练·考(全国通用)辽宁省锦州市2020-2021学年九年级上学期期末化学试题辽宁省沈阳市铁西区雨田中学2022-2023学年九年级上学期期末化学试题辽宁省沈阳市铁西区雨田中学2022-2023学年九年级上学期期末化学试题
6 . 根据下图所示装置回答问题:
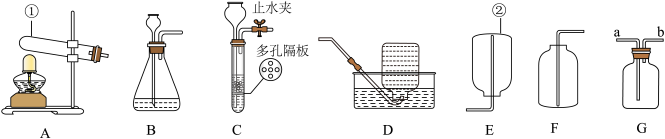
(1)写出下列仪器的名称:②是__________________ 。
(2)用高锰酸钾制取较纯净的氧气,选择的发生和收集装置组合是________ ;在收集时发现气体呈紫红色的原因是______________ ;写出该反应的化学方程式___________________ 。
(3)硫化氢是一种无色且有臭鸡蛋气味的气体,能溶于水,密度比空气大,实验室常用块状硫化亚铁跟稀硫酸反应制取硫化氢气体。试回答:实验室制取H2S气体时,若用G来收集H2S,H2S应从______ 进(选“a”或“b”),制取H2S的发生装置最好选择_____ (选择“B”或“C”),原因是__________ 。
(4)将氯酸钾和二氧化锰的固体混合物30.6克加热至质量不再改变为止,冷却后称量剩余固体物质的质量为21.0克。试问:
①生成氧气的质量是多少_____ ?
②氯酸钾中氧元素的质量分数为多少_____ ?
③多少克的氯酸钾中含有16克的氧元素_____ ?(本题各步均要求写出计算过程,结果均保留一位小数)

(1)写出下列仪器的名称:②是
(2)用高锰酸钾制取较纯净的氧气,选择的发生和收集装置组合是
(3)硫化氢是一种无色且有臭鸡蛋气味的气体,能溶于水,密度比空气大,实验室常用块状硫化亚铁跟稀硫酸反应制取硫化氢气体。试回答:实验室制取H2S气体时,若用G来收集H2S,H2S应从
(4)将氯酸钾和二氧化锰的固体混合物30.6克加热至质量不再改变为止,冷却后称量剩余固体物质的质量为21.0克。试问:
①生成氧气的质量是多少
②氯酸钾中氧元素的质量分数为多少
③多少克的氯酸钾中含有16克的氧元素
您最近一年使用:0次
7 . 某化学小组初步探究氢氧化钠的性质、变化和获得方法。
查阅相关资料:
Ⅰ.部分酸、碱和盐的溶解性表(室温)
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“﹣”表示那种物质不存在或遇到水就分解了。
Ⅱ.氢氧化钠的工业制法:电解氯化钠饱和溶液
【性质与变化】
(1)上表★处“溶”对应的物质是_____
(2)完成下列物质转化,各写出一个符合要求的化学方程式。
①
____
②
_____
【实践与应用】工业上常用电解氯化钠饱和溶液的方法生产氢氧化钠
(3)某化工厂计划生产16t氢氧化钠,请计算:
①氢氧化钠的相对分子质量是_____
②理论上需要氯化钠的质量是_____
(4)工业生产中可制得含NaOH溶质质量分数约为45%的液碱产品,经进一步处理还可以制得固体氢氧化钠产品。请根据已有知识,对“进一步处理”中使用的方法提出设想并简要说明理由_____
(5)工业固体氢氧化钠质量指标如图所示,请对产品中的杂质来源作出合理分析。
碳酸钠:_____
查阅相关资料:
Ⅰ.部分酸、碱和盐的溶解性表(室温)
| 阴离子/阳离子 | OH﹣ | NO | Cl﹣ | SO | CO |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| K+ | ★溶 | 溶 | 溶 | 溶 | 溶 |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ca2+ | 微 | 溶 | 溶 | 微 | 不 |
| Cu2+ | 不 | 溶 | 溶 | 溶 | ﹣﹣ |
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“﹣”表示那种物质不存在或遇到水就分解了。
Ⅱ.氢氧化钠的工业制法:电解氯化钠饱和溶液

【性质与变化】
(1)上表★处“溶”对应的物质是
(2)完成下列物质转化,各写出一个符合要求的化学方程式。
①

②

【实践与应用】工业上常用电解氯化钠饱和溶液的方法生产氢氧化钠
(3)某化工厂计划生产16t氢氧化钠,请计算:
①氢氧化钠的相对分子质量是
②理论上需要氯化钠的质量是
(4)工业生产中可制得含NaOH溶质质量分数约为45%的液碱产品,经进一步处理还可以制得固体氢氧化钠产品。请根据已有知识,对“进一步处理”中使用的方法提出设想并简要说明理由
(5)工业固体氢氧化钠质量指标如图所示,请对产品中的杂质来源作出合理分析。
| 工业固体氢氧化钠质量指标 (合格品) 氢氧化钠(NaOH)/%≥98.0 碳酸钠(Na2CO3)/%≤1.0 氯化钠(NaCl)/%≤0.08 |
碳酸钠:
您最近一年使用:0次
解题方法
8 . 现有一定质量的的氧化镁、碳酸镁的混合物,向其中加入20g一定质量分数的稀盐酸完全反应,得滤液的质量为22.8g,将产生的气体通入足量澄清石灰水中充分反应后过滤,得到滤液比澄清石灰水质量减少了2.8g,则混合物中氧元素的质量分数约为
| A.32% |
| B.22.4% |
| C.54.4% |
| D.11.35% |
您最近一年使用:0次
9 . 能源利用和环境保护是人类共同关注的问题。
(1)化石燃料主要包括煤、石油和_________ 。
(2)煤燃烧时排放出二氧化硫、二氧化氮等污染物,这些气体或气体在空气中发生反应后的生成物溶于雨水,会形成________________ 。为减少环境污染,我国已大力推广使用脱硫煤。
(3)为控制二氧化碳的排放量,科学家采取新技术,将二氧化碳和氢气在催化剂和加热条件下转化为重要的化工原料乙烯(C2H4)和水,反应的化学方程式为_____________________ 。
(4)乙醇可作燃料。现有一定量乙醇与一定量氧气混合于密闭容器内,在一定条件下反应生成16.2g水,同时得到一氧化碳和二氧化碳的混合物25.2g,参加反应的乙醇的质量为_________ g,混合物中一氧化碳与二氧化碳的质量比为_________ (填最简比)。
(1)化石燃料主要包括煤、石油和
(2)煤燃烧时排放出二氧化硫、二氧化氮等污染物,这些气体或气体在空气中发生反应后的生成物溶于雨水,会形成
(3)为控制二氧化碳的排放量,科学家采取新技术,将二氧化碳和氢气在催化剂和加热条件下转化为重要的化工原料乙烯(C2H4)和水,反应的化学方程式为
(4)乙醇可作燃料。现有一定量乙醇与一定量氧气混合于密闭容器内,在一定条件下反应生成16.2g水,同时得到一氧化碳和二氧化碳的混合物25.2g,参加反应的乙醇的质量为
您最近一年使用:0次
2020-07-20更新
|
1636次组卷
|
14卷引用:天津市2020年一、二模汇编-能源、资源、环保、低碳
(已下线)天津市2020年一、二模汇编-能源、资源、环保、低碳(已下线)必刷卷01-2021年中考化学考前信息必刷卷(天津专用)(已下线)2023年中考风向标-天津-能源与环境天津市2020年中考化学试题(已下线)课题2 燃料的合理利用与开发(好题精练)-2020-2021学年九年级化学上册同步课堂课件精讲及好题精练(人教版)(已下线)第04单元 燃料及其燃烧单元测试卷(B卷提升篇)-2020-2021学年九年级化学上册同步单元AB卷(沪教版上海)(已下线)第07单元 燃料及其利用单元测试卷(B卷提升篇)-2020-2021学年九年级化学上册同步单元AB卷(人教版)(已下线)第7单元 燃料及其利用(检测卷)-2020-2021学年九年级化学上册同步课堂课件精讲及好题精练(人教版)(已下线)第七单元 燃料及其利用(单元检测卷)-2022-2023学年九年级化学上册精品课堂课件精讲及好题精练(人教版)湖北省黄石市第八中学2021-2022学年九年化学试题湖北省黄石市阳新县潘桥中学2022-2023学年九年级上学期期末冲模拟化学试题湖北省黄石市阳新县北部联盟2022-2023学年九年级下学期第一次联考化学试题(已下线)课题2燃料的利用和对环境的影响(第1课时)-2023-2024学年九年级化学上册当堂清作业设计(人教版)2024年天津市第五十四中学中考化学模拟试题(三)
10 . 将一定质量的甲醇(CH3OH)和氧气(O2)置于密闭容器中点燃,一段时间后反应停止,测得反应后各物质的质量,相关数据如下表所示。下列说法不符合事实的是
| 物质 | CH3OH | O2 | H2O | CO2 | X |
| 反应前质量/g | m | 12.8 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 10.8 | 8.8 | n |
| A.m>n |
| B.X中一定含有碳元素 |
| C.无法判断X中是否含有氧元素 |
| D.生成物中C、H两种元素的质量比为3∶1 |
您最近一年使用:0次
2020-07-19更新
|
1792次组卷
|
31卷引用:专题12 微观模型图、质量守恒定律(考点专练)-备战2021年中考化学考点微专题
(已下线)专题12 微观模型图、质量守恒定律(考点专练)-备战2021年中考化学考点微专题(已下线)专题13: 质量守恒定律与化学方程式(讲练)--2021年中考化学一轮复习讲练测(人教版)(已下线)【万唯原创】2021年河北省中考化学面对面卷练习册九年级第5单元(已下线)考点18 根据化学方程式的计算-备战2022年中考化学一轮复习考点帮(已下线)重难点02 质量守恒定律图表图形专题突破-2023年中考化学【热点·重点·难点】专练(苏州专用)(已下线)重难点02 质量守恒定律图表图形专题突破-2023年中考化学【热点·重点·难点】专练(南京专用)(已下线)专题01 质量守恒定律的应用(题型专练)-备战2024年中考化学一轮复习考点帮(沪教版·全国)江苏省盐城市2020年中考化学试题江苏省苏州市常熟市常熟外国语中学2020-2021学年九年级下学期开学考试化学试题河南省洛阳市孟津县2020-2021学年九年级上学期期末化学试题山东省烟台市芝罘区(五四制)2020-2021学年九年级下学期期中化学试题2021年山东省威海市乳山市中考一模化学试题1(已下线)(无锡卷)2021年中考化学第一次模拟考试山东省烟台市海阳市2020-2021学年八年级下学期期末化学试题山东省威海市乳山市(五四制)2020-2021学年九年级下学期期中化学试题2021年甘肃省天水市麦积区天水七中中考二模化学试题江苏省常州市新北区实验中学2021-2022学年九年级上学期期中模拟化学试题B江苏省苏州市姑苏区振华中学校2021-2022学年九年级上学期阶段测试化学试题江苏省盐城市滨海县滨淮初中教育集团2021-2022学年九年级上学期第二次限时独立作业化学试题河南省南阳市桐柏县2021-2022学年九年级上学期第四阶段综合素质自测(期末)化学试题河南省南阳市桐柏县2021-2022学年九年级上学期期末化学试题2022年云南省昆明市初中学业水平考试训练化学试题(三)重庆市梁平区2021-2022学年九年级上学期期末质量监测化学(A卷)试题重庆市北碚区西南大学附属中学校2022-2023学年九年级上学期化学定时训练(三)2023年广西初中学业水平考试化学参考样卷2023年广西柳州市柳南区壶西实验中学中考模拟化学试题2023年广西玉林市兴业县北市镇第二初级中学中考模拟化学试题2023年广西梧州市蒙山县中考模拟化学试题2023年江苏省盐城市阜宁县中考二模化学试题广西壮族自治区柳州市第十一中学2022-2023学年九年级下学期开学考试化学试题广西柳州市城中区文华中学2022-2023学年九年级上学期期末化学试题



