解题方法
1 . 将6.5g锌投入100mL某浓度的稀硫酸中,锌和稀硫酸恰好完全反应(写出简要计算过程)。求:
(1)反应中生成的H2在标准状况下的体积为_______ L。
(2)若用98%的浓硫酸(ρ=1.84g/mL)来配置上述稀硫酸,需要浓硫酸的体体积为_______ mL(保留一位小数)。
(1)反应中生成的H2在标准状况下的体积为
(2)若用98%的浓硫酸(ρ=1.84g/mL)来配置上述稀硫酸,需要浓硫酸的体体积为
您最近一年使用:0次
名校
解题方法
2 . 在标准状况下,将aL NH3完全溶于水得到VmL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为w,溶质的物质的量浓度为c mol·L-1。下列叙述中错误的是
①w=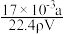 ×100% ②c=
×100% ②c=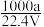 ③若上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w ④将50 g上述溶液加入一定量的水稀释成0.5c mol·L-1,则加入水的体积应大于50 mL
③若上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w ④将50 g上述溶液加入一定量的水稀释成0.5c mol·L-1,则加入水的体积应大于50 mL
①w=
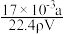 ×100% ②c=
×100% ②c=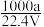 ③若上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w ④将50 g上述溶液加入一定量的水稀释成0.5c mol·L-1,则加入水的体积应大于50 mL
③若上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5w ④将50 g上述溶液加入一定量的水稀释成0.5c mol·L-1,则加入水的体积应大于50 mL| A.①④ | B.①③ | C.③④ | D.②④ |
您最近一年使用:0次
2021-01-28更新
|
378次组卷
|
2卷引用:江西省抚州市临川第一中学2020-2021学年高一上学期期末统考化学试题
解题方法
3 . 工业锅炉长期煮烧会形成锅垢(主要成分 、
、 ),必须定期除去。已知:
),必须定期除去。已知: 微溶于水,可加入氯氧化钠并通入
微溶于水,可加入氯氧化钠并通入 使其转化为
使其转化为 ,然后加盐酸浸泡除去。现需三个配制80 mL 1.0
,然后加盐酸浸泡除去。现需三个配制80 mL 1.0  浸泡所需的稀盐酸,而实验室只有12.0
浸泡所需的稀盐酸,而实验室只有12.0  的浓盐酸。
的浓盐酸。
(1)配制稀盐酸时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需要的仪器有______ 。
(2)需要用量筒取12.0 的浓盐酸
的浓盐酸______ mL。
(3)下列操作会导致所配盐酸的物质的量浓度偏低的是______ (填字母序号)。
A.稀释的盐酸转移到容量瓶中未洗涤烧杯
B.定容时俯视液面
C.摇匀后发现液面低于刻度线,于是加水至刻度线
D.配制前容量瓶中有少量水
(4)写出用所配的稀盐酸去除水垢中 的离子方程式
的离子方程式______ 。
 、
、 ),必须定期除去。已知:
),必须定期除去。已知: 微溶于水,可加入氯氧化钠并通入
微溶于水,可加入氯氧化钠并通入 使其转化为
使其转化为 ,然后加盐酸浸泡除去。现需三个配制80 mL 1.0
,然后加盐酸浸泡除去。现需三个配制80 mL 1.0  浸泡所需的稀盐酸,而实验室只有12.0
浸泡所需的稀盐酸,而实验室只有12.0  的浓盐酸。
的浓盐酸。(1)配制稀盐酸时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需要的仪器有
(2)需要用量筒取12.0
 的浓盐酸
的浓盐酸(3)下列操作会导致所配盐酸的物质的量浓度偏低的是
A.稀释的盐酸转移到容量瓶中未洗涤烧杯
B.定容时俯视液面
C.摇匀后发现液面低于刻度线,于是加水至刻度线
D.配制前容量瓶中有少量水
(4)写出用所配的稀盐酸去除水垢中
 的离子方程式
的离子方程式
您最近一年使用:0次
名校
解题方法
4 . 下列溶液的物质的量浓度是1 mol·L-1的是
| A.将40 g NaOH溶解于1 L水中 |
| B.0.5 mol Na2O加入适量水中,配成1 L溶液 |
| C.将1 L 10 mol·L-1的盐酸与9 L水混合 |
| D.将11.2 L HCl气体通入水配成0.5 L的溶液 |
您最近一年使用:0次
2021-01-22更新
|
488次组卷
|
4卷引用:宁夏石嘴山市第三中学2020-2021学年高一上学期期末考试化学试题
名校
解题方法
5 . 用单位体积溶液里所含溶质的质量来表示溶液的组成,称为质量—体积浓度,单位为 。现有一种
。现有一种 时的
时的 饱和溶液,密度为
饱和溶液,密度为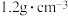 ,质量—体积浓度为
,质量—体积浓度为 。下列说法错误的是
。下列说法错误的是
 。现有一种
。现有一种 时的
时的 饱和溶液,密度为
饱和溶液,密度为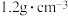 ,质量—体积浓度为
,质量—体积浓度为 。下列说法错误的是
。下列说法错误的是A.该溶液中溶质的质量分数为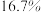 |
B.该溶液中溶质的物质的量浓度为 |
C. 时,硫酸铜的溶解度为 时,硫酸铜的溶解度为 |
D. 时,把 时,把 溶解于 溶解于 水中恰好得到饱和溶液 水中恰好得到饱和溶液 |
您最近一年使用:0次
2021-01-19更新
|
296次组卷
|
3卷引用:辽宁省朝阳市第一高级中学2020-2021学年高一上学期期末考试化学试题
名校
6 . (1)有下列物质:①氧化钠固体②熔融氯化钠③稀盐酸④蔗糖⑤二氧化碳。请用序号填空:属于电解质的是__ ,属于非电解质的是__ 。
(2)要配制450mL1mol/L稀硫酸溶液需要的仪器除了玻璃棒、量筒、烧杯还需要__ ,并用量筒量取18.4mol/L浓硫酸__ mL。
(3)将一小块钠投入到盛CuSO4溶液的烧杯中,则其总反应的离子方程式为__ 。
(4)标准状况下,CH4和O2组成的混合气体6.72L,质量为6.0g,则CH4与O2的体积比为___ 。
(2)要配制450mL1mol/L稀硫酸溶液需要的仪器除了玻璃棒、量筒、烧杯还需要
(3)将一小块钠投入到盛CuSO4溶液的烧杯中,则其总反应的离子方程式为
(4)标准状况下,CH4和O2组成的混合气体6.72L,质量为6.0g,则CH4与O2的体积比为
您最近一年使用:0次
名校
7 . 下列说法正确的是
| A.配制480 mL 0.5 mol/L的CuSO4溶液,需称量62.5 g胆矾 |
| B.完全中和100 mL 1 mol/L的H2SO4溶液,需要消耗4.0 g NaOH |
| C.1 L水中溶解了58.5 g NaCl,则该溶液的物质的量浓度为1 mol/L |
| D.从1 L 2 mol/L的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol/L |
您最近一年使用:0次
2021-01-16更新
|
397次组卷
|
3卷引用:湖南省长沙市雅礼中学2020-2021学年高一上学期期中考试化学试题
解题方法
8 . 如图为配制250 mL 0.2 mol/L Na2CO3溶液的示意图。
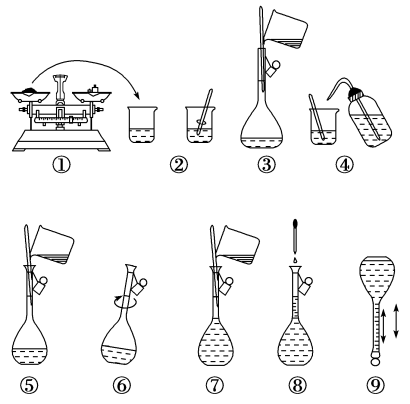
回答下列问题:
(1)①中称得Na2CO3________ g。
(2)玻璃棒在②③两步中的作用分别是__________ 、________ 。
(3)若出现如下情况,对所配溶液浓度有何影响?(填“偏高”、“偏低”或“无影响”)
A.某同学在第⑧步观察液面时俯视________ ;
B.没有进行操作步骤④和⑤________ ;
C.在第⑤步不慎有少量液体流到容量瓶外________ 。
D.溶解后溶液未冷却进行移液_________

回答下列问题:
(1)①中称得Na2CO3
(2)玻璃棒在②③两步中的作用分别是
(3)若出现如下情况,对所配溶液浓度有何影响?(填“偏高”、“偏低”或“无影响”)
A.某同学在第⑧步观察液面时俯视
B.没有进行操作步骤④和⑤
C.在第⑤步不慎有少量液体流到容量瓶外
D.溶解后溶液未冷却进行移液
您最近一年使用:0次
解答题-实验探究题
|
较易(0.85)
|
解题方法
9 . 如图是硫酸试剂瓶标签上的内容。

(1)该硫酸的物质的量浓度为___ ;
(2)实验室用该硫酸配制240mL0.46mol/L的稀硫酸,则
①需要该硫酸的体积为___ mL;
②现有以下仪器:烧杯、量筒、玻璃棒、托盘天平(带砝码)、胶头滴管,配制时,还必须的一种玻璃仪器___ 。
③配制过程中有几个关键的步骤和操作如图所示:将上述实验步骤A—F按实验过程先后次序排列___ 。
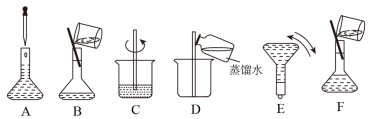
④该同学实际配制得到的浓度为0.45mol/L,可能的原因是___ 。
A.量取浓H2SO4时仰视刻度
B.容量瓶洗净后未经干燥处理
C.没有将洗涤液转入容量瓶
D.定容时仰视刻度

(1)该硫酸的物质的量浓度为
(2)实验室用该硫酸配制240mL0.46mol/L的稀硫酸,则
①需要该硫酸的体积为
②现有以下仪器:烧杯、量筒、玻璃棒、托盘天平(带砝码)、胶头滴管,配制时,还必须的一种玻璃仪器
③配制过程中有几个关键的步骤和操作如图所示:将上述实验步骤A—F按实验过程先后次序排列

④该同学实际配制得到的浓度为0.45mol/L,可能的原因是
A.量取浓H2SO4时仰视刻度
B.容量瓶洗净后未经干燥处理
C.没有将洗涤液转入容量瓶
D.定容时仰视刻度
您最近一年使用:0次
名校
解题方法
10 . 过氧乙酸(CH3COOOH)是无色透明液体,易溶于水、易挥发,见光易分解,具有强氧化性的高效消毒剂。
(1)某学生在实验室用5.0 mol/L工业品过氧乙酸配制0.1 mol/L过氧乙酸溶液250 mL,该生用量筒量取工业品过氧乙酸体积_______ mL,除量筒、玻璃棒、烧杯外还需要的其它仪器是_______ 。
(2)若出现如下情况,对所配溶液浓度将有何影响(选填“偏高”、“偏低”或“无影响”)?
a.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水________ ;
b.转移溶液时,不慎有少量溶液洒在容量瓶外_______ ;
c.量取的工业品过氧乙酸时,仰视量筒_______ ;
(3)下列叙述正确的是_______ (填字母)。

A.可用过滤的方法将过氧乙酸溶液中混有的NaCl除掉
B.过氧乙酸包装上应贴的危险警告标签应如图所示
C.过氧乙酸应注意密闭、低温保存于棕色细口瓶中
D.过氧乙酸是一种有机物,它可以用于萃取碘水中的碘单质
(1)某学生在实验室用5.0 mol/L工业品过氧乙酸配制0.1 mol/L过氧乙酸溶液250 mL,该生用量筒量取工业品过氧乙酸体积
(2)若出现如下情况,对所配溶液浓度将有何影响(选填“偏高”、“偏低”或“无影响”)?
a.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
b.转移溶液时,不慎有少量溶液洒在容量瓶外
c.量取的工业品过氧乙酸时,仰视量筒
(3)下列叙述正确的是

A.可用过滤的方法将过氧乙酸溶液中混有的NaCl除掉
B.过氧乙酸包装上应贴的危险警告标签应如图所示
C.过氧乙酸应注意密闭、低温保存于棕色细口瓶中
D.过氧乙酸是一种有机物,它可以用于萃取碘水中的碘单质
您最近一年使用:0次



