解题方法
1 . 高纯硝酸锶[Sr( NO3)2]用于制造信号灯、光学玻璃等。
I.工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。提纯硝酸锶的实验步骤如下:
①取含杂质的硝酸锶样品,向其中加入浓HNO3 溶解,搅拌。
②过滤,并用浓HNO3 洗涤滤渣。
③将滤渣溶于水中,加略过量CrO3 使Ba2+ 沉淀,静置后加入肼( N2H4)将过量CrO3还原,调节pH 至7~8,过滤。
④将滤液用硝酸调节pH 至2~3,蒸发浓缩,冷却结晶,过滤,洗涤。
⑤将得到的Sr( NO3)2·2H2O 晶体在100℃条件下干燥,得到高纯硝酸锶。
(1)步骤②用浓HNO3洗涤滤渣的目的是______________ 。
(2)步骤③中肼将CrO3 还原为Cr3+,同时产生一种无色无味的气体,该反应的离子方程式为_____________ 。
(3)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧,现欲除去100L锅炉水中的溶解氧( 含氧气8.8mg/L),需要肼的质量为__________ 。
Ⅱ. Sr(NO3)2 受热易分解,生成Sr(NO2)2 和O2;在500℃时Sr(NO2)2 进一步分解生成SrO 及氮氧化物。
(4)取一定质量含Sr(NO2)2 的Sr(NO3)2 样品,加热至完全分解,得到7.28gSrO固体和6.92 g混合气体。计算该样品中Sr(NO3)2 的质量分数__________ (写出计算过程,计算结果精确到0.01% )。
I.工业级硝酸锶中常含有硝酸钙、硝酸钡等杂质,其中硝酸钙可溶于浓硝酸,而硝酸锶、硝酸钡不溶于浓硝酸。提纯硝酸锶的实验步骤如下:
①取含杂质的硝酸锶样品,向其中加入浓HNO3 溶解,搅拌。
②过滤,并用浓HNO3 洗涤滤渣。
③将滤渣溶于水中,加略过量CrO3 使Ba2+ 沉淀,静置后加入肼( N2H4)将过量CrO3还原,调节pH 至7~8,过滤。
④将滤液用硝酸调节pH 至2~3,蒸发浓缩,冷却结晶,过滤,洗涤。
⑤将得到的Sr( NO3)2·2H2O 晶体在100℃条件下干燥,得到高纯硝酸锶。
(1)步骤②用浓HNO3洗涤滤渣的目的是
(2)步骤③中肼将CrO3 还原为Cr3+,同时产生一种无色无味的气体,该反应的离子方程式为
(3)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧,现欲除去100L锅炉水中的溶解氧( 含氧气8.8mg/L),需要肼的质量为
Ⅱ. Sr(NO3)2 受热易分解,生成Sr(NO2)2 和O2;在500℃时Sr(NO2)2 进一步分解生成SrO 及氮氧化物。
(4)取一定质量含Sr(NO2)2 的Sr(NO3)2 样品,加热至完全分解,得到7.28gSrO固体和6.92 g混合气体。计算该样品中Sr(NO3)2 的质量分数
您最近一年使用:0次
名校
解题方法
2 . 锡及其化合物在生产、生活中有着重要的用途。已知:Sn的熔点为231℃;Sn2+易水解、易被氧化;SnCl4极易水解、熔点为-33℃、沸点为114℃。
2H++SnO22- Sn(OH)2
Sn(OH)2 Sn2++2OH-
Sn2++2OH-
请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为_______ 。
(2)用于微电子器件生产的锡粉纯度测定:
① 取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
② 加入过量的Fe2(SO4)3;③ 用0.1000 mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。
步骤② 中加入Fe2(SO4)3的作用是_______ ;此锡粉样品中锡的质量分数________ 。
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如图所示:
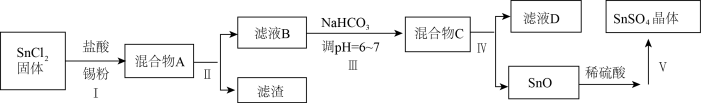
① 步骤I加入Sn粉的作用:___________ 及调节溶液pH。
② 步骤Ⅲ生成SnO的离子方程式:____________________ 。
③ 以锡单质为阳极,铁片为阴极,SnSO4溶液为电解质溶液,在铁片上镀锡,阴极反应式是____________ ,镀锡铁破损后在潮湿的环境中容易发生腐蚀的原因是_________ ,若是在较弱的酸性环境中发生腐蚀,正极反应式是____________ 。
(4)SnCl4蒸气遇水汽呈浓烟状,因而叮制作烟幕弹, 其反应的化学方程式为___________ 。
(5)锡的+2价化合物应具有较强的还原性,已知Sn2+的还原性比 Fe2+的还原性强,PbO2的氧化性比Cl2的氧化性强。试写出下列反应的化学方程式:
① 将SnCl4溶液蒸干灼烧得到的固体物质是________ ;
② 若用SnCl2溶液与过量的碱溶液反应制Sn(OH)2,该碱溶液可选用________ 。
2H++SnO22-
 Sn(OH)2
Sn(OH)2 Sn2++2OH-
Sn2++2OH-请按要求回答下列相关问题:
(1)元素锡比同主族碳的周期数大3,锡的原子序数为
(2)用于微电子器件生产的锡粉纯度测定:
① 取1.19g试样溶于稀硫酸中(杂质不参与反应),使Sn完全转化为Sn2+;
② 加入过量的Fe2(SO4)3;③ 用0.1000 mol/LK2Cr2O7溶液滴定(产物中Cr呈+3价),消耗20.00 mL。
步骤② 中加入Fe2(SO4)3的作用是
(3)用于镀锡工业的硫酸亚锡(SnSO4)的制备路线如图所示:

① 步骤I加入Sn粉的作用:
② 步骤Ⅲ生成SnO的离子方程式:
③ 以锡单质为阳极,铁片为阴极,SnSO4溶液为电解质溶液,在铁片上镀锡,阴极反应式是
(4)SnCl4蒸气遇水汽呈浓烟状,因而叮制作烟幕弹, 其反应的化学方程式为
(5)锡的+2价化合物应具有较强的还原性,已知Sn2+的还原性比 Fe2+的还原性强,PbO2的氧化性比Cl2的氧化性强。试写出下列反应的化学方程式:
① 将SnCl4溶液蒸干灼烧得到的固体物质是
② 若用SnCl2溶液与过量的碱溶液反应制Sn(OH)2,该碱溶液可选用
您最近一年使用:0次
2017-05-15更新
|
706次组卷
|
2卷引用:山西省阳泉市第一中学校2022-2023学年高三上学期11月期中考试化学试题



