名校
解题方法
1 . 某研究小组探究NaClO溶液的性质,设计了下列实验方案,依据实验现象,有关判断不正确的
(已知含有Fe3+的盐溶液遇到KSCN溶液变成红色)
| 装置图 | 试剂X | 实验现象 | |
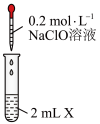 | ① | 0.2mol•L-1盐酸 | 产生黄绿色气体 |
| ② | 0.2mol•L-1淀粉-KI溶液 | 溶液变蓝 | |
| ③ | 0.2mol•L-1FeSO4(H+)和KSCN混合溶液 | 溶液变红 | |
| ④ | 0.2mol•L-1AlCl3溶液 | 产生白色沉淀 | |
| A.实验①中发生的反应:HClO+HCl=Cl2↑+H2O |
| B.实验②中发生的反应:ClO-+2I-+H2O=Cl-+I2+2OH- |
| C.实验③条件下氧化性强弱:Fe3+>ClO- |
| D.实验④中说明ClO-与Al3+不能大量共存 |
您最近一年使用:0次
2022-11-16更新
|
185次组卷
|
2卷引用:湖南省长沙市湖南师范大学附属中学2022-2023学年高一上学期期中考试化学试题
名校
2 . 水合肼(N2H4·H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl

实验一:制备NaClO溶液。(实验装置如图1所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有______ (填标号)。
A.玻璃棒 B.烧杯 C.烧瓶 D.容量瓶 E.胶头滴管
(2)锥形瓶中发生反应的离子方程式是___________________ 。
实验二:制取水合肼。(实验装置如图2所示)
(3)①仪器A的名称为_______________ 。
②反应过程中需控制反应温度,同时将分液漏斗中溶液缓慢滴入A中,如果滴速过快则会导致产品产率降低,同时产生大量氮气,写出该过程的化学反应方程式:__________ ,故分液漏斗中的溶液是______ (填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO
③充分反应后,加热蒸馏A内的溶液,收集108~114℃馏分,即可得到水合肼的粗产品。
实验三:测定馏分中肼含量。
(4)称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2〜3滴淀粉溶液,用0.10mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定时,碘的标准溶液盛放在______ (填"酸式”或“碱式”)滴定管中,本实验滴定终点的现象为____________________ 。
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为__________ 。

实验一:制备NaClO溶液。(实验装置如图1所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有
A.玻璃棒 B.烧杯 C.烧瓶 D.容量瓶 E.胶头滴管
(2)锥形瓶中发生反应的离子方程式是
实验二:制取水合肼。(实验装置如图2所示)
(3)①仪器A的名称为
②反应过程中需控制反应温度,同时将分液漏斗中溶液缓慢滴入A中,如果滴速过快则会导致产品产率降低,同时产生大量氮气,写出该过程的化学反应方程式:
A.CO(NH2)2溶液 B.NaOH和NaClO
③充分反应后,加热蒸馏A内的溶液,收集108~114℃馏分,即可得到水合肼的粗产品。
实验三:测定馏分中肼含量。
(4)称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加2〜3滴淀粉溶液,用0.10mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定时,碘的标准溶液盛放在
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为
您最近一年使用:0次
2017-04-07更新
|
741次组卷
|
3卷引用:湖南省衡阳市第八中学2017届高三实验班第一次模拟考试理科综合化学试题



