1 . 如图:A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
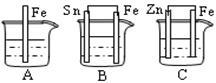
(1)A中反应的离子方程式为___________ 。
(2)B中Sn极的电极反应式为________ 。Sn极附近溶液的pH值_______________ (填“变大”、“变小”、“不变”)
(3)C中被腐蚀的金属是___________________ ,该电极电极反应式为_____________________ ,比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为____________________ 。

(1)A中反应的离子方程式为
(2)B中Sn极的电极反应式为
(3)C中被腐蚀的金属是
您最近一年使用:0次
2 . 下列叙述的说法不正确的是
| A.金属的电化学腐蚀比化学腐蚀更普遍 |
| B.用牺牲锌块的方法来保护船身 |
| C.用铝质铆钉铆接铁板,铁板易被腐蚀 |
| D.在镀件上电镀锌,用锌作阳极 |
您最近一年使用:0次
3 . 下列关于铜电极的叙述中不正确的是
| A.铜锌原电池中铜是正极 |
| B.铁壳船底部镶嵌铜块,铜块更易被腐蚀 |
| C.用电解法精炼粗铜时粗铜作阳极 |
| D.在镀件上镀铜是可用金属铜作阳极 |
您最近一年使用:0次
4 . 下列说法正确的是
| A.马口铁(锡铁)镀层破损后被腐蚀时,首先是镀层被氧化 |
| B.原电池反应是导致金属腐蚀的主要原因,故不能用于减缓金属的腐蚀 |
| C.钢铁电化学腐蚀的两种主要类型其主要区别在于水膜的pH不同引起负极反应的不同 |
| D.无论哪种类型的金属腐蚀,其实质都是金属被氧化 |
您最近一年使用:0次
11-12高二下·福建福州·期中
5 . 下列说法不正确的是
| A.铸铁输油管道应埋在干燥致密不透气的土壤中 |
| B.在空气中,金属铝表面能迅速被氧化形成保护膜,因此铝不容易被腐蚀 |
| C.钢铁发生电化学腐蚀时,负极发生的反应是2H2O+O2+4e-= 4OH- |
| D.白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化 |
您最近一年使用:0次
6 . 下列说法不正确的是
| A.铸铁输油管道应埋在干燥致密不透气的土壤中 |
| B.白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化 |
| C.钢铁发生电化学腐蚀时,负极发生的反应是2H2O+O2+4e﹣=4OH﹣ |
| D.在空气中,金属铝表面能迅速被氧化形成保护膜,因此铝不容易被腐蚀 |
您最近一年使用:0次
7 . 下列说法正确的是
| A.水库中的钢闸门通常连接锌块,是采用了牺牲阳极的阴极保护法 |
| B.化学电源都是一次能源 |
| C.铁的表面镀铜的过程中,铜极连接电源负极 |
| D.合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其组成成分金属强 |
您最近一年使用:0次
8 . 钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为 2Fe+2H2O+O2═2Fe(OH)2.以下说法正确的是
| A.钢柱在水下部分比在空气与水交界处更容易腐蚀 |
| B.正极发生的反应为 2H2O+O2+2e﹣═4OH﹣ |
| C.原电池是将电能转变为化学能的装置 |
| D.负极发生的反应为 Fe﹣2e﹣═Fe2+ |
您最近一年使用:0次
11-12高二上·福建厦门·期中
解题方法
9 . 有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000 mL水,加入一定量的NaCl 固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm的细钢丝,将钢丝放入试管中,加入约 10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如右下图。过一会儿:
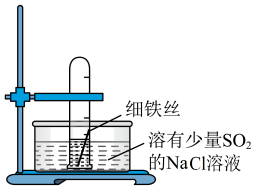
(1)观察到试管中的液面逐渐下降,这说明
在该条件下,铁丝发生了______________ 腐蚀,
正极材料是______ 电极反应是__________________
(2)再过一段时间发现液面停止下降,并且开始逐渐
上升,露在液面上的铁丝表面由原来的银白色变棕褐色,这说明在该条件下,铁丝发生了
___________ 腐蚀,正极的电极反应为___________________________________
①总反应为:____________________________________ ;①反应的产物极易被进一步氧化,生成红褐色物质,②该反应的化学方程式为:____________________________ 若铁锈的组成为:Fe2O3·xH2O ,试写出由②反应的产物在通常条件下生成铁锈的反应方程式:
③__________________________________________________________________
(3)已知原来铁丝质量为2 g,发生(1)情况时,依液面下降的高度折为标准状况下的体积是5.6mL,则此时,铁丝的质量变为_________ g ,随后液面开始上升,即发生(2)的变化,依最终液面上升的高度折算为标准状况下的体积比最开始刚倒扣于水槽中试管中溶液的体积多了1.12mL,通过计算,(2)的过程共消耗氧气_______ mL,若x值为2,那么铁丝的质量应为___________ g(以上计算有效数字保留至小数点后三位)

(1)观察到试管中的液面逐渐下降,这说明
在该条件下,铁丝发生了
正极材料是
(2)再过一段时间发现液面停止下降,并且开始逐渐
上升,露在液面上的铁丝表面由原来的银白色变棕褐色,这说明在该条件下,铁丝发生了
①总反应为:
③
(3)已知原来铁丝质量为2 g,发生(1)情况时,依液面下降的高度折为标准状况下的体积是5.6mL,则此时,铁丝的质量变为
您最近一年使用:0次
10 . 化学在日常生产生活中有着重要的应用.下列说法不正确的是
| A.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 |
| B.钢铁发生吸氧腐蚀的正极反应式为O2+2H2O+4e﹣═4OH﹣ |
| C.在海轮外壳上镶入锌块,锌作负极,可减缓船体的腐蚀速率 |
| D.在潮湿的空气中,镀锌铁板比镀锡铁板更耐腐蚀 |
您最近一年使用:0次



