1 . 钢铁不是纯净的铁,通常含有少量的碳,在潮湿的空气中易形成原电池而腐蚀,下列说法正确的是
| A.铁为正极,发生还原反应 | B.铁为负极,发生氧化反应 |
| C.碳为正极,发生氧化反应 | D.碳为负极,发生还原反应 |
您最近半年使用:0次
2024-01-09更新
|
321次组卷
|
4卷引用:6.1.2化学反应与电能课后作业巩固篇
(已下线)6.1.2化学反应与电能课后作业巩固篇海南省海口市长流中学2022-2023学年高一下学期期中考试化学试题B卷(已下线)专题05 化学反应与能量变化(考题猜想)(8大题型)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)河北省保定市高碑店市崇德实验中学2023-2024学年高一下学期3月考试化学试题
解题方法
2 . 将一根较纯铁棒垂直没入水中,由于深水处溶氧量较少,一段时间后发现AB段产生较多铁锈,BC段腐蚀严重,下列关于此现象的说法错误的是
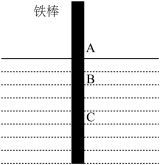

| A.铁棒AB段发生的反应为O2+2H2O+4e-=4OH- |
| B.腐蚀过程中在铁棒上会产生微电流,且方向是从BC段到AB段 |
| C.向水中加入一定量硫酸钾固体后,对铁棒的生锈速率几乎无影响 |
| D.产生这种现象的本质是铁棒所处的化学环境不同 |
您最近半年使用:0次
名校
3 . 埋在地下的铸铁输油管道,在下列各种情况下,被腐蚀速率最慢的是
| A.在含铁元素较多的酸性土壤中 |
| B.在潮湿疏松的碱性土壤中 |
| C.在干燥致密不透气的土壤中 |
| D.在含碳粒较多,潮湿透气的中性土壤中 |
您最近半年使用:0次
2023-08-26更新
|
162次组卷
|
3卷引用:第4节 金属的腐蚀与防护
4 . 研究能量的转化与利用具有重要的现实意义。
(1)依据下列金属腐蚀的有关示意图回答问题。
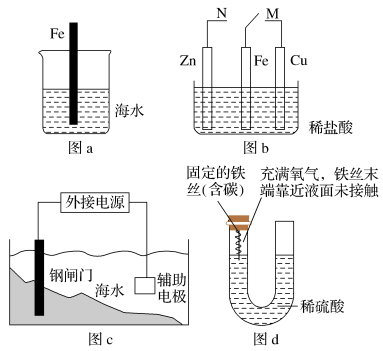
①图a插入海水中的铁棒(含碳量为10.8%)越靠近烧杯底部发生电化学腐蚀就越______________ (填“轻微”或“严重”)。
②图b铁棒上的接触导线由N改置于M时,铁的腐蚀速率________________ (填“减小”或“增大”)。
③图c为牺牲阳极的阴极保护法,钢闸门应与外接电源的________________ 极相连。
④图d在反应过程中U形管内左侧液面的变化是:____________________ 。
(2)应用电化学原理回答下列问题。

①上述三个装置中,负极反应物在化学性质上的共同特点是:________ 。
②甲中电流计指针偏移时,含KCl的盐桥中Cl-离子移向电极所在的溶液是:________ 。
③乙中电池工作时,负极区KOH溶液的浓度将逐渐________ 。
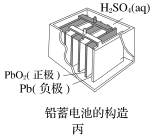
④丙放电一段时间后进行充电,充电时该电池发生反应的化学方程式为______ 。
(3)铁及其化合物在处理工业废水、废气过程中发挥着重要作用。
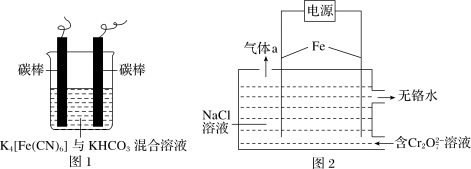
①工业上用铁的化合物除硫化氢:2[Fe(CN)6]3-+CO +HS-=2[Fe(CN)6]4-+HCO
+HS-=2[Fe(CN)6]4-+HCO +S↓,可通过图1使[Fe(CN)6]3-再生。电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生。电解时,阳极的电极反应式为_______________ ;电解过程中阴极区溶液的pH________ (填“变大” “变小”或“不变”)。
②图2以铁作电极电解除铬。已知转化反应:Cr2O +H2O
+H2O 2CrO
2CrO +2H+,电解过程中主要反应之一:Cr2O
+2H+,电解过程中主要反应之一:Cr2O +6Fe2++17H2O=2Cr(OH)3↓+6Fe(OH)3↓+10H+;图中气体a的主要成分是
+6Fe2++17H2O=2Cr(OH)3↓+6Fe(OH)3↓+10H+;图中气体a的主要成分是________________ 。
(1)依据下列金属腐蚀的有关示意图回答问题。

①图a插入海水中的铁棒(含碳量为10.8%)越靠近烧杯底部发生电化学腐蚀就越
②图b铁棒上的接触导线由N改置于M时,铁的腐蚀速率
③图c为牺牲阳极的阴极保护法,钢闸门应与外接电源的
④图d在反应过程中U形管内左侧液面的变化是:
(2)应用电化学原理回答下列问题。


①上述三个装置中,负极反应物在化学性质上的共同特点是:
②甲中电流计指针偏移时,含KCl的盐桥中Cl-离子移向电极所在的溶液是:
③乙中电池工作时,负极区KOH溶液的浓度将逐渐
④丙放电一段时间后进行充电,充电时该电池发生反应的化学方程式为
(3)铁及其化合物在处理工业废水、废气过程中发挥着重要作用。

①工业上用铁的化合物除硫化氢:2[Fe(CN)6]3-+CO
 +HS-=2[Fe(CN)6]4-+HCO
+HS-=2[Fe(CN)6]4-+HCO +S↓,可通过图1使[Fe(CN)6]3-再生。电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生。电解时,阳极的电极反应式为②图2以铁作电极电解除铬。已知转化反应:Cr2O
 +H2O
+H2O 2CrO
2CrO +2H+,电解过程中主要反应之一:Cr2O
+2H+,电解过程中主要反应之一:Cr2O +6Fe2++17H2O=2Cr(OH)3↓+6Fe(OH)3↓+10H+;图中气体a的主要成分是
+6Fe2++17H2O=2Cr(OH)3↓+6Fe(OH)3↓+10H+;图中气体a的主要成分是
您最近半年使用:0次
解题方法
5 . 《本草纲目》中载有一药物,名“铜青”。陈藏器曰:生熟铜皆有青,即是铜之精华,大者即空绿,以次空青也。铜青则是铜器上绿色者,淘洗用之。反应原理为
| A.析氢腐蚀 | B.吸氧腐蚀 |
| C.化学腐蚀 | D.置换反应 |
您最近半年使用:0次
解题方法
6 . 铁及其化合物在生产和生活中有着广泛的应用。
(1)某研究性学习小组设计了如图1所示装置探究钢铁的腐蚀与防护。
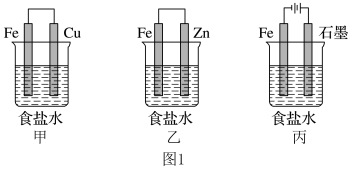
①在相同条件下,三组装置中铁电极腐蚀最快的是________ (填装置序号)。
②乙装置中,Fe电极的电极反应式为__________________________ 。
③装置丙中总反应的离子方程式为_______________________ 。
(2)利用图2装置,可以模拟铁的电化学防护。
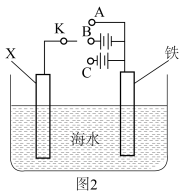
①若X为碳电极,为减缓铁的腐蚀,开关K应置于____________ (填“A”“B”或“C”)处。
②若X为锌电极,开关K置于A处,该电化学保护法称为__________ 。
(1)某研究性学习小组设计了如图1所示装置探究钢铁的腐蚀与防护。

①在相同条件下,三组装置中铁电极腐蚀最快的是
②乙装置中,Fe电极的电极反应式为
③装置丙中总反应的离子方程式为
(2)利用图2装置,可以模拟铁的电化学防护。

①若X为碳电极,为减缓铁的腐蚀,开关K应置于
②若X为锌电极,开关K置于A处,该电化学保护法称为
您最近半年使用:0次
解题方法
7 . 在一定条件下,某含碳钢腐蚀情况与溶液pH的关系如表所示,下列说法正确的是
pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
腐蚀快慢 | 较快 | 慢 | 较快 | ||||
主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO | |||
| A.当pH<4时,碳钢主要发生化学腐蚀 |
| B.当pH<4和pH>13.5时,碳钢主要发生析氢腐蚀 |
| C.pH越大,碳钢的腐蚀速率越慢 |
D.pH=14时,负极反应为4OH-+Fe-3e-=FeO +2H2O +2H2O |
您最近半年使用:0次
8 . 在潮湿的深层中性土壤中,钢管主要发生厌氧腐蚀,有关厌氧腐蚀的机理有多种,其中一种理论为厌氧细菌可促使SO 与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图Ⅰ所示,因此埋在地下的钢管常需要加以保护,使其免受腐蚀,所用装置如图Ⅱ所示。下列说法正确的是
与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图Ⅰ所示,因此埋在地下的钢管常需要加以保护,使其免受腐蚀,所用装置如图Ⅱ所示。下列说法正确的是
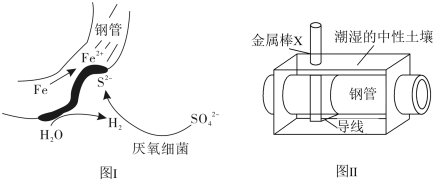
 与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图Ⅰ所示,因此埋在地下的钢管常需要加以保护,使其免受腐蚀,所用装置如图Ⅱ所示。下列说法正确的是
与H2反应生成S2-,加速钢管的腐蚀,其反应原理如图Ⅰ所示,因此埋在地下的钢管常需要加以保护,使其免受腐蚀,所用装置如图Ⅱ所示。下列说法正确的是
| A.图Ⅱ中钢管附近土壤的pH可能会下降 |
| B.图Ⅰ中钢管腐蚀的含铁产物只有FeS |
| C.图Ⅱ中金属棒X可能为铜,可使钢管表面腐蚀电流接近于零 |
| D.图Ⅱ中金属棒X的作用是作为损耗负极材料和传递电流 |
您最近半年使用:0次
9 . 下列装置能达到设计目的的是


| A.装置①中M可用石墨代替 |
| B.装置②用于深浸在海水中的钢闸门的防腐 |
| C.装置③用于验证铁的吸氧腐蚀 |
| D.装置④用于模拟粗铜的电解精炼 |
您最近半年使用:0次
名校
10 . 下列对如图所示的实验装置的判断中错误的是


| A.若X为碳棒,开关K置于A处,可减缓铁的腐蚀 |
| B.若X为锌棒,开关K置于A或B处,均可减缓铁的腐蚀 |
| C.若X为锌棒,开关K置于B处时,为牺牲阳极的阴极保护法 |
| D.若X为碳棒,开关K置于B处时,铁电极上发生的反应为2H++2e-=H2↑ |
您最近半年使用:0次




