1 . 将纯锌片和纯铜片按图所示插入相同浓度的稀硫酸中,以下有关叙述正确的是( )
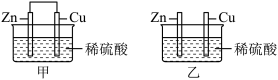

| A.甲装置中电能转化为化学能 | B.乙装置中电能转化为化学能 |
| C.甲装置中铜片表面有气泡产生 | D.乙装置中铜片表面有气泡生成 |
您最近一年使用:0次
2019-06-24更新
|
223次组卷
|
7卷引用:2010年黑龙江省哈六中高一下学期期中考试化学试题
(已下线)2010年黑龙江省哈六中高一下学期期中考试化学试题(已下线)2009—2010学年聊城三中高一第二学期第四次阶段性测试化学试题(已下线)2012-2013学年甘肃省兰州一中高一下学期期末考试化学试卷2015-2016学年陕西省宝鸡市岐山县高一下期末质检化学试卷吉林省白山市第十九中学2018-2019学年高一下学期期中考试化学试题新疆维吾尔自治区吐鲁番市高昌区第二中学2019-2020学年高二上学期期末考试化学试题河南省体育中学2022-2023学年高二上学期期中测试化学试题
名校
2 . 新型LiFePO4可充电锂离子动力电池以其独特的优势成为绿色能源的新宠。已知该电池放电时的电极反应式为:正极:FePO4+ Li++ e-=LiFePO4,负极:Li-e-=Li+。下列说法中正确的是
| A.充电时电池反应为FePO4+Li++e-=LiFePO4 |
| B.放电时电池内部Li+向负极移动 |
| C.充电时动力电池的阳极应与外接电源的正极相连 |
| D.放电时,在正极上Li+得电子被还原 |
您最近一年使用:0次
2019-06-10更新
|
172次组卷
|
3卷引用:河南省长葛市第一高级中学2020-2021学年高二上学期阶段性测试试卷化学试题
3 . 锌空气电池具有蓄电量大、充电循环次数多等优点(Zn与Al的化学性质相似)。下列有关说法错误的是( )
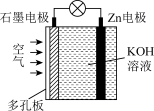

| A.电池放电时Zn电极逐渐溶解 | B.电池放电时化学能转化为电能 |
| C.电子由石墨经导线流向Zn片 | D.石墨为正极 |
您最近一年使用:0次
9-10高一下·河南郑州·阶段练习
名校
4 . 如图为某兴趣小组制作的番茄电池,下列说法正确的是
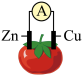

| A.电子由锌通过导线流向铜 |
| B.该装置将电能转化为化学能 |
| C.锌电极发生还原反应 |
| D.铜电极上无气泡产生 |
您最近一年使用:0次
2019-05-05更新
|
371次组卷
|
6卷引用:09-10年郑州盛同学校高一下学期阶段测试(二)化学卷
(已下线)09-10年郑州盛同学校高一下学期阶段测试(二)化学卷【全国百强校】贵州省铜仁市第一中学2018-2019学年高一下学期期中考试化学试题云南省屏边县第一中学2019-2020学年高二上学期12月月考化学试题广东省茂名地区2017-2018学年高二上学期期中考试化学(文)试题鲁科版(2019)高一必修第二册 第2章 化学键 反应规律 第二节 化学反应与能量转化(已下线)第2章 化学反应与能量(基础过关卷)-2020-2021学年高一化学必修2章末集训必刷卷(人教版)
5 . 正确认识和使用电池有利于我们每一个人的日常生活。
I.电化学法处理SO2是目前研究的热点。利用双氧水氧化吸收SO2可消除SO2污染,设计装置如图所示(已知石墨只起导电作用,质子交换膜只允许H+通过)。
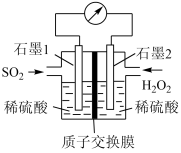
(1)石墨1为____ (填“正极”或“负极”),正极的电极反应式为______ 。
(2)反应的总方程式为_______ 。
(3)H+的迁移方向为由_____ 到____ 。(填“左”或“右”)
(4)若11.2L(标准状况)SO2参与反应,则迁移H+的物质的量为____ 。
(5)某同学关于原电池的笔记中,不合理的有____ 。
①原电池两电极材料活泼性一定不同
②原电池负极材料参与反应,正极材料都不参与反应
③Fe-NaOH溶液-Si原电池,Fe是负极
④原电池是将化学能转变为电能的装置
Ⅱ.航天技术中使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有多种。
(1)某碱式氢氧燃料电池的电解质溶液是KOH溶液,则其负极反应为_____ ;某熔盐氢氧燃料电池的电解质是熔融的碳酸钾,则其负极反应为_____ 。
(2)氢氧燃料电池用于航天飞船,电极反应产生的水,经过冷凝后可用作航天员的饮用水,当得到1.8g饮用水时,转移的电子数约为_____ 。
I.电化学法处理SO2是目前研究的热点。利用双氧水氧化吸收SO2可消除SO2污染,设计装置如图所示(已知石墨只起导电作用,质子交换膜只允许H+通过)。

(1)石墨1为
(2)反应的总方程式为
(3)H+的迁移方向为由
(4)若11.2L(标准状况)SO2参与反应,则迁移H+的物质的量为
(5)某同学关于原电池的笔记中,不合理的有
①原电池两电极材料活泼性一定不同
②原电池负极材料参与反应,正极材料都不参与反应
③Fe-NaOH溶液-Si原电池,Fe是负极
④原电池是将化学能转变为电能的装置
Ⅱ.航天技术中使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有多种。
(1)某碱式氢氧燃料电池的电解质溶液是KOH溶液,则其负极反应为
(2)氢氧燃料电池用于航天飞船,电极反应产生的水,经过冷凝后可用作航天员的饮用水,当得到1.8g饮用水时,转移的电子数约为
您最近一年使用:0次
2019-04-26更新
|
458次组卷
|
2卷引用:【全国百强校】河南省郑州市第一中学2018-2019学年高一下学期期中考试化学试题
名校
6 . a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b 相连时,电流由a经导线流向b,c、d相连时,电子由d到c;a、c相连时,a极上产生大量气泡,b、d相连时,H+移向d极,则四种金属的活动性顺序由强到弱的顺序为
| A.a>b>c>d | B.a>c>d>b | C.c>a>b>d | D.b>d>c>a |
您最近一年使用:0次
2019-04-15更新
|
1669次组卷
|
20卷引用:河南省平顶山市鲁山县第一高级中学2019-2020学年高一6月月考化学试题
河南省平顶山市鲁山县第一高级中学2019-2020学年高一6月月考化学试题【全国百强校】江苏省海安高级中学2018-2019学年高一下学期3月月考化学试题2【市级联考】贵州省遵义市2018-2019学年高一下学期期中考试化学试题课时2 原电池的原理及应用——A学习区 夯实基础(鲁科版(2019)第二册)课时1 利用化学反应制备物质——A学习区 夯实基础(鲁科版必修2)山东省潍坊市五县市2019-2020学年高一下学期期中考试化学试题鲁科版(2019)高一必修第二册 第2章 化学键 反应规律 第二节 化学反应与能量转化 方法帮山西省朔州市怀仁县大地学校2019-2020学年高一下学期期末考试化学试题湖南省长沙县第九中学2019-2020学年高一上学期第一次月考化学试题辽宁省锦州市义县高级中学2020-2021学年高二12月月考化学试题安徽省蚌埠田家炳中学2020-2021学年高二12月月考化学试题山东省临朐县实验中学2020-2021学年高一下学期4月月考化学试题重庆市第七中学校2020-2021学年高一下学期半期考试化学试题重庆市四川外语学院重庆第二外国语学校2021-2022学年高一下学期期中考试化学试题广西钦州市第一中学2021-2022学年高二下学期期中考试理科综合化学试题北京市第五中学2021-2022学年高一下学期期中考试化学试题第一节 原电池 第1课时 原电池的工作原理四川省凉山州西昌市2021-2022学年高一下学期期中考试化学试题山东省文登第一中学2022-2023学年高二上学期1月期末考试化学试题四川省宜宾市叙州区第一中学校2022-2023学年高一下学期4月月考化学试题
名校
7 . 如图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。下列说法不正确的是( )
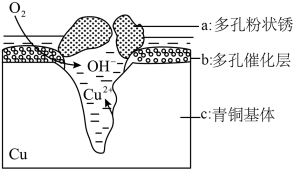

| A.腐蚀过程中,负极是c |
| B.正极反应是O2 + 4e-+2H2O=4OH- |
| C.若生成4.29gCu2(OH)3Cl,则理论上耗氧体积为0.224L (相对原子质量Cu 64,Cl35.5) |
| D.环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ |
您最近一年使用:0次
2019-04-15更新
|
245次组卷
|
7卷引用:2016-2017学年河南省南阳市新野高级中学高二上第二次月考化学卷
8 . 我国科研人员借助太阳能,将光解水制H2与脱硫结合起来,既能大幅度提高光解水制H2的效率,又能脱除SO2,工作原理如图所示。下列说法不正确 的是
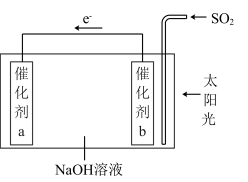

| A.该装置可将太阳能转化为化学能 |
| B.催化剂a表面发生还原反应,产生H2 |
| C.催化剂b附近的溶液pH增大 |
| D.吸收1 mol SO2,理论上能产生1 mol H2 |
您最近一年使用:0次
2019-04-04更新
|
1280次组卷
|
7卷引用:【区级联考】北京市朝阳区2019届高三下学期一模考试化学试题
名校
9 . 铁及铁的化合物应用广泛,如氯化铁可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)氯化铁溶液腐蚀印刷电路铜板的离子方程式是_______ 。
(2)若将(1)中的反应设计成原电池,可用____ 作负极,____ 作正极,______ 作电解质溶液。
(3)负极反应式是___________ ,正极反应式是________________ 。
(1)氯化铁溶液腐蚀印刷电路铜板的离子方程式是
(2)若将(1)中的反应设计成原电池,可用
(3)负极反应式是
您最近一年使用:0次
2019-04-03更新
|
269次组卷
|
3卷引用:河南省林州市第一中学2019-2020学年高一3月线上考试化学试题
名校
10 . 含氰化物的废液乱倒或与酸混合,均易生成有剧毒且易挥发的氰化氢。工业上常采用碱性氯化法来处理高浓度氰化物污水,发生的主要反应为:CN-+OH-+Cl2→CO2+N2+Cl-+H2O(未配平)。下列说法错误的是(其中 NA表示阿伏伽德罗常数的值)( )
| A.Cl2是氧化剂,CO2和N2是氧化产物 |
| B.上述离子方程式配平后,氧化剂、还原剂的化学计量数之比为 2:5 |
| C.该反应中,若有1mol CN-发生反应,则有5NA电子发生转移 |
| D.若将该反应设计成原电池,则CN-在负极区发生反应 |
您最近一年使用:0次
2019-03-25更新
|
1361次组卷
|
12卷引用:河南省鹤壁市高中2020-2021学年高二上学期第四次段考化学试题
河南省鹤壁市高中2020-2021学年高二上学期第四次段考化学试题【市级联考】湖南省株洲市2019届高三下学期一模化学试题【全国百强校】湖北省荆州市沙市中学2018-2019学年高一下学期期中考试化学试题【全国百强校】江西省新余市第一中学2018-2019学年高一下学期第二次(5月)段考化学试题(已下线)专题04 氧化还原反应——2019年高考真题和模拟题化学分项汇编(已下线)专题2.3 氧化还原反应(练)-《2020年高考一轮复习讲练测》2019年广东省梅州市高三上学期第一次质量检测化学试题2020届高考化学知识点必练——氧化还原反应的本质及相关概念(已下线)第4单元 氧化还原反应(A卷 基础过关检测)-2021年高考化学一轮复习单元滚动双测卷山东省济南历城第二中学2021届高三上学期期中考试化学试题山东省济南市2021届高三上学期期中考试化学试题黑龙江省齐齐哈尔三立高级中学2022届高三上学期开学考试化学试题



