名校
解题方法
1 . 铜锌原电池为电化学建构认识模型奠定了重要的基础,懂得原理才能真正做到举一反三,应用到其他复杂的电池分析中。盐桥中装有琼脂凝胶,内含氯化钾。下面两种原电池说法错误的是

| A.原电池Ⅰ和Ⅱ的反应原理都是Zn+Cu2+=Zn2++Cu |
| B.电池工作时,导线中电子流向为Zn→Cu |
| C.正极反应为Zn-2e-=Zn2+,发生还原反应 |
| D.电池工作时,盐桥中的K+向右侧烧杯移动,Cl-向左侧烧杯移动 |
您最近一年使用:0次
2021-12-06更新
|
1986次组卷
|
13卷引用:黑龙江省牡丹江市第三高级中学2021-2022学年高二上学期期末考试化学试题
黑龙江省牡丹江市第三高级中学2021-2022学年高二上学期期末考试化学试题福建省宁德市同心顺联盟校2021—2022学年高二上学期期中联考化学试题江西省吉安市峡江中学2021-2022学年高二上学期开学考试化学(理科)试题重庆市缙云教育联盟2021-2022学年高二下学期4月质量检测化学试题第一节 原电池 第1课时 原电池的工作原理福建省南平市高级中学2022-2023学年高二上学期期中考试化学(选考)试题(已下线)第29讲 第四章《化学反应与电能》单元测试(培优提升)-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)辽宁省大石桥市第三高级中学2021-2022学年高二12月月考化学试题福建省福清西山学校2021-2022学年高二上学期12月月考化学试题(已下线)第06讲 化学电源-【寒假自学课】2022年高一化学寒假精品课(苏教版必修第二册)新疆昌吉州行知学校2021-2022学年高一下学期期中考试化学试题(已下线)题型02 电化学图像分析-2024年高考化学答题技巧与模板构建(已下线)专题05 化学反应与能量变化(考点清单)(讲+练)-2023-2024学年高一化学下学期期中考点大串讲(人教版2019必修第二册)
2 . 十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。硫化氢-空气质子交换膜燃料电池实现了发电、环保的有效结合,已知:2H2S(g)+O2(g)=S2(s)+2H2O(l) ∆H=-632kJ/mol,下列说法中错误的是


| A.电子从电极a流出,经负载流向电极b |
| B.当电极a的质量增加64g时,电池内部释放632kJ的热能 |
C.电极b上发生的电极反应为 |
| D.标准状况下,每11.2LH2S参与反应,有1molH+经固体电解质膜进入正极区 |
您最近一年使用:0次
2022-02-27更新
|
752次组卷
|
4卷引用:江西省景德镇市乐平中学2021-2022学年高二下学期期末质量检测化学试题
江西省景德镇市乐平中学2021-2022学年高二下学期期末质量检测化学试题广东省汕头市金山中学2021-2022学年高二下学期期中考试化学试题(已下线)专题06 电化学原理应用—2022年高考化学二轮复习讲练测(全国版)-测试广东省六校联盟2021届高三下学期考前热身试题化学试题
解题方法
3 . 我国科学家发明的一种可控锂水电池的工作原理如图所示。下列有关说法正确的是
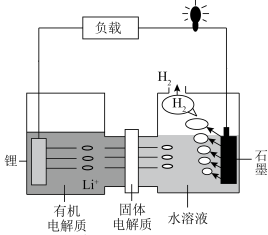
| A.锂为负极,发生还原反应 |
B. 移向正极并在正极得电子 移向正极并在正极得电子 |
| C.电子由锂→有机电解质→固体电解质→水溶液→石墨 |
D.电池工作时的总反应为: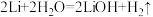 |
您最近一年使用:0次
2024-03-01更新
|
621次组卷
|
2卷引用:广东省广州市天河区2023-2024学年高二上学期期末化学试卷
4 . 中科院科学家设计出一套利用SO2和太阳能综合制氢方案,其基本工作原理如图所示,下列说法错误的是
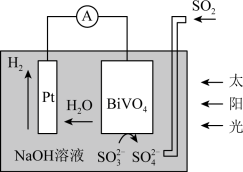

| A.该电化学装置中,Pt电极作正极 |
B.BiVO4电极上的反应孔为 -2e-+2OH-= -2e-+2OH-= +H2O +H2O |
| C.Pt电极的电势高于BiVO4电极的电势 |
| D.电子流向:Pt电极→外电路→BiVO4电极 |
您最近一年使用:0次
2022-01-23更新
|
668次组卷
|
3卷引用:江西省赣州市2021-2022学高二上学期期末考试化学试题
江西省赣州市2021-2022学高二上学期期末考试化学试题广东省惠州市2022-2023学年高三第三次调研考试试题化学试题(已下线)化学-2023年高考押题预测卷03(广东卷)(含考试版、全解全析、参考答案、答题卡)
5 . 某Mg-Al原电池的示意图如图,下列说法正确的是
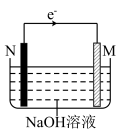
| A.M电极的材料为Mg |
| B.N电极上发生氧化反应,得到电子 |
C.电池工作时, 向M电极移动 向M电极移动 |
| D.电池工作时,电路中电子的流动方向为N→导线→M→NaOH溶液→N |
您最近一年使用:0次
2023-04-22更新
|
612次组卷
|
3卷引用:甘肃省白银市2022-2023学年高二下学期开学考(上学期期末)联考化学试题
名校
解题方法
6 . 通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是
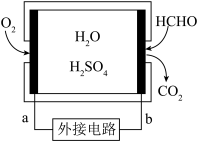
| A.a为电池的正极,发生还原反应 |
| B.b极的电极反应为HCHO+H2O-4e−=CO2+4H+ |
| C.传感器工作过程中,电解质溶液中H+向a极移动 |
| D.外电路中的电流方向为由b到a |
您最近一年使用:0次
2023-09-16更新
|
593次组卷
|
6卷引用:新疆维吾尔自治区喀什第二中学2022-2023学年高二上学期1月期末考试化学试题
新疆维吾尔自治区喀什第二中学2022-2023学年高二上学期1月期末考试化学试题(已下线)专题09 原电池-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(人教版2019)四川省泸县第一中学2023-2024学年高二上学期10月月考化学试题内蒙古自治区优质高中联考2023-2024学年高二上学期11月期中化学试题河南省唐河县鸿唐高级中学2023-2024学年高二上学期10月月考化学试题福建省莆田三中2023-2024学年高二上学期第一次月考化学试题
名校
解题方法
7 . 某原电池总反应的离子方程式是2Fe3++Fe=3Fe2+,不能实现该反应的原电池是
| A.正极是Cu,负极是Fe,电解质是FeCl3溶液 |
| B.正极是C,负极是Fe,电解质是Fe(NO3)3溶液 |
| C.正极是Fe,负极是Zn,电解质是Fe2(SO4)3溶液 |
| D.正极是Ag,负极是Fe,电解质是FeCl3溶液 |
您最近一年使用:0次
2022-01-02更新
|
716次组卷
|
3卷引用:黑龙江省双鸭山市第一中学2021-2022学年高二上学期期末考试化学试题
名校
8 . 硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC), 由于具有效率高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池。其工作原理如下图所示,下列说法正确的是
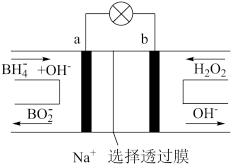

| A.电池的负极反应为BH4-+2H2O-8e-=BO2-+8H+ |
| B.放电时,每转移2mol电子,理论上需要消耗9.5gNaBH4 |
| C.电池放电时Na+从b极区移向a极区 |
| D.电极a采用MnO2,MnO2既作电极材料又有催化作用 |
您最近一年使用:0次
2019-07-16更新
|
3278次组卷
|
11卷引用:广东省揭阳市2018-2019学年高二下学期期末考试理综化学试题
广东省揭阳市2018-2019学年高二下学期期末考试理综化学试题广东省潮州市2019-2020学年高二下学期期末统考化学试题河南省驻马店市第二高级中学2019-2020学年高二下学期期末考试化学试题黑龙江省大庆铁人中学2020-2021学年高二上学期第一次月考化学试题江西省赣县第三中学2021-2022学年高二上学期入学考试化学试题河南省信阳高级中学2021-2022学年高二上学期9月月考化学试题海南省琼海市嘉积第二中学2021-2022学年高二下学期教学质量监测(段考)化学科试题 人教版2019必修第二册 第六章 专题强化练2 电极反应式的书写及新型电源四川省内江市第六中学2020-2021学年高一下期期中考试化学试题福建省福建师范大学附属中学2021-2022学年高一下学期期中考试化学试题(已下线)【知识图鉴】单元讲练测必修第二册第六单元01讲核心
名校
解题方法
9 . 原电池揭示了氧化还原反应的本质是电子转移,实现了化学能转化成电能,使氧化还原反应在现代生活中获得重大应用,从而改变了人们的生活方式。
某兴趣小组为探究原电池工作原理,利用金属Zn与稀H2SO4反应,通过如图所示装置A、B进行实验,实验过程中装置A内溶液的温度升高,装置B的电流计指针发生偏转。
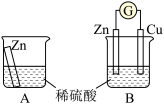
根据所学知识,完成下列各题:
(1)装置B为原电池,则Cu作_______ (填“正”或“负”)极,Zn电极上的电极反应式为_______ ,Cu电极上的现象是_______ 。请简述确定Cu电极没有参与反应的实验依据或方案_______ 。
(2)一般把金属导线称为“电子导体”,把电解质溶液称为“离子导体”。装置B中电池工作时“电子导体”中电子的流动方向可描述为_______ ;“离子导体”中主要离子的移动方向可描述为_______ 。
(3)从能量转化的角度来看,装置A中反应物的总能量_______ (填“高于”、“低于”或“=”)生成物的总能量;从反应速率的角度上看,可以观察到A中反应比B中_______ (填“快”或“慢”)。
(4)装置B中稀H2SO4用足量CuSO4溶液代替,起始时Zn电极和Cu电极的质量相等,当导线中有0.2mol电子转移时,Zn电极和Cu电极的质量差为_______ 。
(5)该小组同学由此得出的结论错误的是_______。(多选)
某兴趣小组为探究原电池工作原理,利用金属Zn与稀H2SO4反应,通过如图所示装置A、B进行实验,实验过程中装置A内溶液的温度升高,装置B的电流计指针发生偏转。

根据所学知识,完成下列各题:
(1)装置B为原电池,则Cu作
(2)一般把金属导线称为“电子导体”,把电解质溶液称为“离子导体”。装置B中电池工作时“电子导体”中电子的流动方向可描述为
(3)从能量转化的角度来看,装置A中反应物的总能量
(4)装置B中稀H2SO4用足量CuSO4溶液代替,起始时Zn电极和Cu电极的质量相等,当导线中有0.2mol电子转移时,Zn电极和Cu电极的质量差为
(5)该小组同学由此得出的结论错误的是_______。(多选)
| A.任何自发进行的氧化还原反应均可以设计成原电池 |
| B.装置B中Cu电极不可用碳棒代替 |
| C.原电池的负极发生还原反应 |
| D.原电池装置中化学能全部转化为电能 |
您最近一年使用:0次
2022-12-11更新
|
825次组卷
|
3卷引用:上海市致远高级中学2022-2023学年高二上学期期末教学评估化学等级考试题
名校
解题方法
10 . 目前锌铁液流电池是电化学储能的热点技术之一。某酸碱混合锌铁液流电池的两极电解质分别呈酸性和碱性,其工作原理如下图所示。下列有关说法正确的是
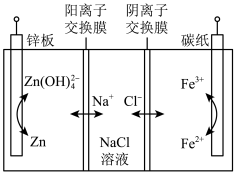

| A.放电时,电子从锌板电极经电解质溶液流向碳纸电极 |
| B.储能时,应将该电池的碳纸电极连接外接电源的正极 |
C.放电时,每转移 电子,中间腔室内的溶液中将减少 电子,中间腔室内的溶液中将减少 |
D.放电时,锌板上发生的电极反应为: |
您最近一年使用:0次
2022-12-04更新
|
721次组卷
|
4卷引用:黑龙江省哈尔滨师范大学附属中学2022-2023学年高二上学期期末考试化学试题
黑龙江省哈尔滨师范大学附属中学2022-2023学年高二上学期期末考试化学试题云南省保山市高(完)中C、D类学校2022~2023学年高二下学期3月份联考化学试题江苏省苏州市八校联盟、南京市第一中学、南京市中华中学2022-2023学年高三上学期12月联考化学试题(已下线)广东省东莞市2022-2023学年高三上学期期末教学质量检查变式汇编(11-16)



