1 . CO2电化学传感器是将环境中CO2浓度转变为电信号的装置,工作原理如图所示,其中YSZ是固体电解质,当传感器在一定温度下工作时,在熔融Li2CO3和YSZ之间的界面X会生成固体Li2O。下列说法错误的是
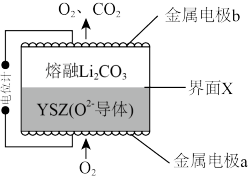
A.CO 迁移方向为界面X →电极b 迁移方向为界面X →电极b |
| B.电极a上消耗的O2和电极b上产生的CO2的物质的量之比为1:1 |
C.电极b为负极,发生的电极反应为2CO -4e-=O2↑+2CO2↑ -4e-=O2↑+2CO2↑ |
| D.电池总反应为Li2CO3=Li2O+CO2↑ |
您最近一年使用:0次
2022-05-27更新
|
5934次组卷
|
11卷引用:2024届东北三省四市教研联合体高三下学期高考模拟(二)化学试卷
2024届东北三省四市教研联合体高三下学期高考模拟(二)化学试卷 (已下线)题型11 新型电化学装置分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)2024届黑龙江省齐齐哈尔市高三下学期联合考试模拟预测化学试题东北三省四市教研联合体2024届高三下学期高考模拟(二)化学试题重庆市2021年高考真题化学试题(已下线)专题12 电化学的综合应用(已下线)专题12 电化学的综合应用(已下线)第16练 原电池 新型电池 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)四川省成都市第七中学2023-2024学年高二上学期10月月考化学试题浙江省余姚中学2023-2024学年高二上学期第一次月考化学试题四川省仁寿第一中学校南校区2023-2024学年高三上学期11月期中考试理综化学试题
名校
解题方法
2 . 2023年星恒电源发布“超钠F1”开启钠电在电动车上产业化元年。该二次电池的电极材料为 (普鲁士白)和
(普鲁士白)和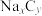 (嵌钠硬碳)。下列说法中错误的是
(嵌钠硬碳)。下列说法中错误的是
 (普鲁士白)和
(普鲁士白)和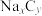 (嵌钠硬碳)。下列说法中错误的是
(嵌钠硬碳)。下列说法中错误的是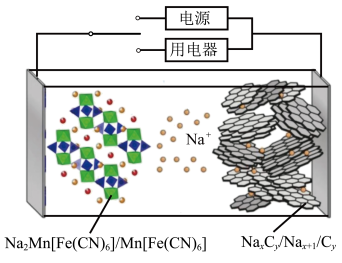
| A.放电时,左边电极电势高 |
B.放电时,负极的电极反应式可表示为: |
C.充电时,电路中每转移 电子,阳极质量增加 电子,阳极质量增加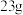 |
| D.比能量:锂离子电池高于钠离子电池 |
您最近一年使用:0次
2024-01-13更新
|
1332次组卷
|
9卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三上学期1月期末化学试题
吉林省通化市梅河口市第五中学2023-2024学年高三上学期1月期末化学试题2024届辽宁省沈阳市高三教学质量检测(一模)化学试题(已下线)T10-电化学基础(已下线)选择题6-10四川省仁寿第一中学校(北校区)2023-2024学年高三上学期期末考试理综试题-高中化学(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)辽宁省沈阳市2024届高三一模化学试题(已下线)T12-电化学基础辽宁省沈阳市部分高中2023-2024学年高三上学期教学质量监测(一)化学试题
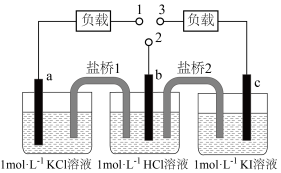
3 . 如图,b为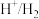 标准氢电极,可发生还原反应(
标准氢电极,可发生还原反应(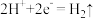 )或氧化反应(
)或氧化反应(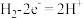 ),a、c分别为
),a、c分别为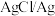 、
、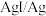 电极。实验发现:1与2相连a电极质量减小,2与3相连c电极质量增大。下列说法正确的是
电极。实验发现:1与2相连a电极质量减小,2与3相连c电极质量增大。下列说法正确的是
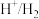 标准氢电极,可发生还原反应(
标准氢电极,可发生还原反应(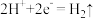 )或氧化反应(
)或氧化反应(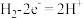 ),a、c分别为
),a、c分别为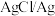 、
、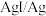 电极。实验发现:1与2相连a电极质量减小,2与3相连c电极质量增大。下列说法正确的是
电极。实验发现:1与2相连a电极质量减小,2与3相连c电极质量增大。下列说法正确的是
| A.1与2相连,盐桥1中阳离子向b电极移动 |
B.2与3相连,电池反应为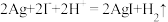 |
| C.1与3相连,a电极减小的质量等于c电极增大的质量 |
D.1与2、2与3相连,b电极均为 流出极 流出极 |
您最近一年使用:0次
2024-01-22更新
|
1291次组卷
|
7卷引用:2024年1月吉林、黑龙江普通高等学校招生考试适应性测试化学试题
2024年1月吉林、黑龙江普通高等学校招生考试适应性测试化学试题(已下线)选择题11-15(已下线)2024年1月“九省联考”黑龙江、吉林卷真题完全解读与考后提升辽宁省沈阳市东北育才学校高中部2023-2024学年高三下学期第六次模拟考试化学试题四川省成都市武侯区某校2023-2024学年高三下学期入学考试理综试卷-高中化学(已下线)专题05 化学反应与能量-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)山东省济宁市第一中学2023-2024学年高三下学期3月月考化学试题
名校
4 .  的脱除与
的脱除与 的制备反应自发协同转化装置如图所示(在电场作用下,双极膜中间层的
的制备反应自发协同转化装置如图所示(在电场作用下,双极膜中间层的 解离为
解离为 和
和 并向两极迁移;忽略溶液体积的变化,
并向两极迁移;忽略溶液体积的变化, 极区域
极区域 浓度保持不变)。下列说法正确的是
浓度保持不变)。下列说法正确的是
 的脱除与
的脱除与 的制备反应自发协同转化装置如图所示(在电场作用下,双极膜中间层的
的制备反应自发协同转化装置如图所示(在电场作用下,双极膜中间层的 解离为
解离为 和
和 并向两极迁移;忽略溶液体积的变化,
并向两极迁移;忽略溶液体积的变化, 极区域
极区域 浓度保持不变)。下列说法正确的是
浓度保持不变)。下列说法正确的是
A.电子从 电极经导线流向 电极经导线流向 电极 电极 |
B.电路中转移 电子,理论上正极区域溶液增重 电子,理论上正极区域溶液增重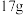 |
C.两极参与反应的 与 与 的物质的量之比为 的物质的量之比为 |
D.双极膜中 的解离可不断提供 的解离可不断提供 和 和 ,故无需补加 ,故无需补加 |
您最近一年使用:0次
2024-04-11更新
|
649次组卷
|
4卷引用:吉林省长春市2023-2024学年高三下学期质量监测(三)化学试题
吉林省长春市2023-2024学年高三下学期质量监测(三)化学试题(已下线)东北三省四城市联考暨沈阳市高三下学期质量监测(二)化学试题东北三省四市2024届高三教研联合体高考模拟(一)化学试卷东北三省四城市联考暨沈阳市高三下学期质量监测(二)化学试题
名校
解题方法
5 . 目前,中国汽车行业已经发生翻天覆地的变化,电动汽车的发展异常耀眼。新能源汽车最重要的部件就是电池,现有一款铅酸电池,放电时的电池反应: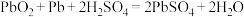 。据此判断下列叙述正确的是
。据此判断下列叙述正确的是
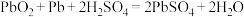 。据此判断下列叙述正确的是
。据此判断下列叙述正确的是| A.放电时,电能转化为化学能 | B.Pb是负极 |
C. 得电子,被氧化 得电子,被氧化 | D.电池放电时,溶液酸性增强 |
您最近一年使用:0次
2024-01-09更新
|
590次组卷
|
6卷引用:吉林省洮南市第一中学2023-2024学年高一下学期第一次月考化学试题
名校
解题方法
6 . 近日,我国化学家通过对过渡金属基尖晶石氧化物(NiCo2O4)进行性能优化,成功开发出锌-空气二次电池,其工作原理如图所示。下列说法正确的是
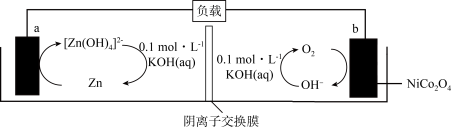

| A.放电时,a极反应:Zn+4OH- -2e-=[Zn(OH)4]2- |
| B.充电时,b极与电源的负极相连 |
| C.放电时,当电路中有4 mole-通过时,b极消耗22.4 L O2 |
| D.放电过程中,a、b电极附近溶液pH均不变 |
您最近一年使用:0次
2023-11-30更新
|
587次组卷
|
3卷引用:选择题11-15
名校
解题方法
7 . 普通水泥在固化过程中其自由水分子减少并形成碱性溶液。根据这一物理、化学特点,科学家发明了电动势法测水泥的初凝时间。此法的原理如图所示,反应的总方程式为2Cu+Ag2O=Cu2O+2Ag。下列有关说法正确的是
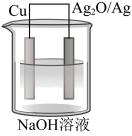
| A.负极的电极反应式为Ag2O+2e-+H2O=2Ag+2OH- |
| B.测量原理示意图中,电子从Cu经溶液流向Ag2O/Ag电极 |
| C.电池工作时,OH-向Cu电极移动 |
| D.电池工作时,OH-浓度增大 |
您最近一年使用:0次
2023-04-14更新
|
508次组卷
|
6卷引用:吉林省四平市第一高级中学2023-2024学年高一下学期第一次月考化学试题
名校
解题方法
8 . 科学家提出一种基于电催化多硫化物循环的自供能产氢体系(如下图所示),通过将锌-多硫化物电池与电解制氢装置集成,最大化利用了间歇性太阳光,实现日夜不间断的自供电的H2生产。下列说法错误的是
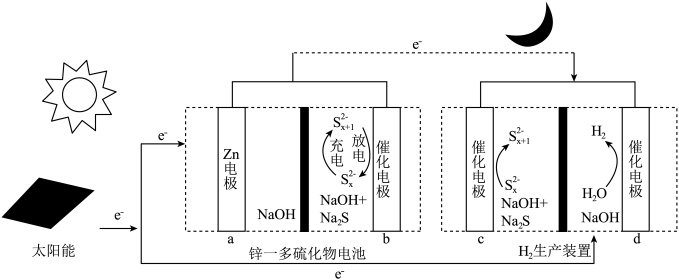
| A.锌-多硫化物电池日间做电解池,夜间做电池 |
| B.夜间工作时,应将电极ac、bd分别连接 |
C.日间工作时,b极的电极反应式为 |
| D.H2生产装置中可以使用钠离子交换膜 |
您最近一年使用:0次
2024-04-11更新
|
468次组卷
|
3卷引用:吉林省长春市2023-2024学年高三下学期质量监测(三)化学试题
名校
9 . 一种新型富含氧空位的 双功能催化剂,可对
双功能催化剂,可对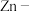 空气电池的充放电过程双向催化。电池的工作原理及催化路径如图所示。
空气电池的充放电过程双向催化。电池的工作原理及催化路径如图所示。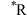 表示R基团在催化剂表面的吸附态。下列说法错误的是
表示R基团在催化剂表面的吸附态。下列说法错误的是
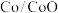 双功能催化剂,可对
双功能催化剂,可对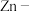 空气电池的充放电过程双向催化。电池的工作原理及催化路径如图所示。
空气电池的充放电过程双向催化。电池的工作原理及催化路径如图所示。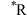 表示R基团在催化剂表面的吸附态。下列说法错误的是
表示R基团在催化剂表面的吸附态。下列说法错误的是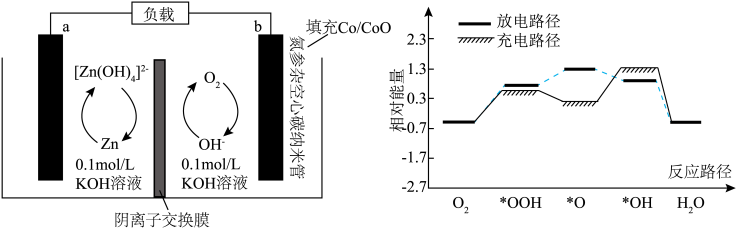
| A.充电时,b极与直流电源的正极相连 |
B.放电时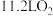 (标准状况)参与反应,有 (标准状况)参与反应,有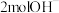 由a极区移向b极区 由a极区移向b极区 |
C.充电过程中a极的电极反应为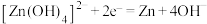 |
D.充电时决速步反应为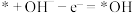 ,氧空位提供更多反应位点,降低了反应的活化能 ,氧空位提供更多反应位点,降低了反应的活化能 |
您最近一年使用:0次
7日内更新
|
229次组卷
|
4卷引用:2024届吉林省长春吉大附中实验学校高三下学期考前适应考试化学试题
2024届吉林省长春吉大附中实验学校高三下学期考前适应考试化学试题2024届河北省唐山市高三下学期二模考试化学试题(已下线)山东师范大学附属中学2024届高三下学期考前预测化学试题2024届广东省高州市第一中学高三下学期5月考前热身训练化学试题
名校
10 . 任何化学反应都伴随着能量的变化,通过化学反应化学能可转化为热能、电能等不同形式的能量。
(1) 可用于工业合成氨气,已知常温常压下拆开1mol
可用于工业合成氨气,已知常温常压下拆开1mol 键、1mol
键、1mol 键分别需要吸收的能量为436kJ、946kJ,形成1mol
键分别需要吸收的能量为436kJ、946kJ,形成1mol 键会放出391kJ能量。
键会放出391kJ能量。
根据上述数据判断工业合成氨的反应是______ (填“吸热”或“放热”)反应;
若消耗1mol 和3mol
和3mol ,理论上放出或吸收热量为
,理论上放出或吸收热量为 ,则
,则 为
为______ kJ;
(2)用图甲、乙所示装置进行实验,以下叙述中,正确的是___。
b.两烧杯中溶液的 均增大
均增大
c.两烧杯中铜片表面均有气泡产生
d.若反应过程中有0.2mol电子转移,生成的氢气在标况下的体积均为2.24L
(3)某同学依据氧化还原反应: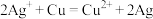 设计的原电池如下图所示:
设计的原电池如下图所示:______ ,发生的电极反应为______ 。
当反应进行一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移的电子数目是______ 。
(1)
 可用于工业合成氨气,已知常温常压下拆开1mol
可用于工业合成氨气,已知常温常压下拆开1mol 键、1mol
键、1mol 键分别需要吸收的能量为436kJ、946kJ,形成1mol
键分别需要吸收的能量为436kJ、946kJ,形成1mol 键会放出391kJ能量。
键会放出391kJ能量。根据上述数据判断工业合成氨的反应是
若消耗1mol
 和3mol
和3mol ,理论上放出或吸收热量为
,理论上放出或吸收热量为 ,则
,则 为
为(2)用图甲、乙所示装置进行实验,以下叙述中,正确的是___。

b.两烧杯中溶液的
 均增大
均增大c.两烧杯中铜片表面均有气泡产生
d.若反应过程中有0.2mol电子转移,生成的氢气在标况下的体积均为2.24L
(3)某同学依据氧化还原反应:
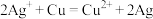 设计的原电池如下图所示:
设计的原电池如下图所示: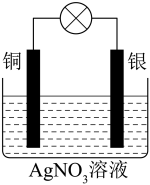
当反应进行一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移的电子数目是
您最近一年使用:0次



