解题方法
1 . 下图是元素周期表的一部分。按要求填写下列空白:
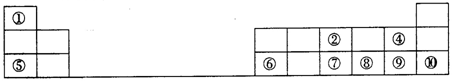
(1)元素⑦在周期表中的位置可表示为_______ 。
(2)①~⑩元素的最高价氧化物对应的水化物中,酸性最强的是_______ (填化学式)。
(3)④⑧⑨三种元素形成的气态氢化物稳定性由大到小的顺序是_______ (用化学式表示)。
(4)⑤和⑥两种元素的最高价氧化物对应的水化物反应的离子方程式为_______ 。
(5)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是_______ 。
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
(6)铁元素处在周期表第四周期第Ⅷ族,它在地壳中含量仅次于铝。全世界每年都有大量的钢铁因生锈而损失。钢铁发生电化学腐蚀时,负极反应是_______ 。

(1)元素⑦在周期表中的位置可表示为
(2)①~⑩元素的最高价氧化物对应的水化物中,酸性最强的是
(3)④⑧⑨三种元素形成的气态氢化物稳定性由大到小的顺序是
(4)⑤和⑥两种元素的最高价氧化物对应的水化物反应的离子方程式为
(5)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
(6)铁元素处在周期表第四周期第Ⅷ族,它在地壳中含量仅次于铝。全世界每年都有大量的钢铁因生锈而损失。钢铁发生电化学腐蚀时,负极反应是
您最近一年使用:0次
名校
2 . 能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。
(1)天然气和可燃冰(mCH4·nH2O)既是高效洁净的能源,也是重要的化工原料,
①甲烷分子的空间构型为__________ ,可燃冰(mCH4·nH2O)属于________ 晶体。
②已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.65kJ热量,则该条件下反应
CH4(g)+2O2(g)=CO2(g)+2H2O(l)的△H=______ kJ·mol-1
(2)用甲烷-氧气碱性(KOH溶液)燃料电池作电源,电解CuCl2溶液。反应装置如下图所示:
①b电极名称为___________ ,d电极的电极反应式为_________ 。
②假设CuCl2溶液足量,当某电极上析出3.2g金属Cu时,理论上燃料电池消耗氧气在标准状况下的体积是______ mL。
(3)在相同条件下,下面各组热化学方程式中,△H1<△H2的是________ 。(填字母)
A组:2H2(g)+O2(g)=2H2O(g) △H12H2(g)+O2(g)═2H2O(l) △H2
B组:S(g)+O2(g)=SO2(g) △H1S(s)+O2(g)=SO2(g) △H2
C组:C(s)+1/2O2(g)=CO(g) △H1C(s)+O2(g)=CO2(g) △H2
D组:CO(g)+1/2O2(g)=CO2(g) △H12CO(g)+O2(g)=2CO2(g) △H2
(4)25℃,10lkPa条件下,14gN2和3gH2应生成NH3的能量变化如下图所示:
已知:①x=1127;
②25℃101kPa下,N2(g)+3H2(g) 2NH3(g) △H=-92kJ·mol-1。则y=
2NH3(g) △H=-92kJ·mol-1。则y=___________ 。
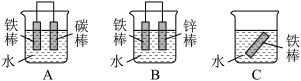
(5)金属材料的腐蚀是人类面临的严重问题,金属的防腐对节约能源、保护环境起着十分重要的作用。下列三个装置中,铁被腐蚀速率由快到慢的顺序为_________ (填字母)。
(1)天然气和可燃冰(mCH4·nH2O)既是高效洁净的能源,也是重要的化工原料,
①甲烷分子的空间构型为
②已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.65kJ热量,则该条件下反应
CH4(g)+2O2(g)=CO2(g)+2H2O(l)的△H=
(2)用甲烷-氧气碱性(KOH溶液)燃料电池作电源,电解CuCl2溶液。反应装置如下图所示:

①b电极名称为
②假设CuCl2溶液足量,当某电极上析出3.2g金属Cu时,理论上燃料电池消耗氧气在标准状况下的体积是
(3)在相同条件下,下面各组热化学方程式中,△H1<△H2的是
A组:2H2(g)+O2(g)=2H2O(g) △H12H2(g)+O2(g)═2H2O(l) △H2
B组:S(g)+O2(g)=SO2(g) △H1S(s)+O2(g)=SO2(g) △H2
C组:C(s)+1/2O2(g)=CO(g) △H1C(s)+O2(g)=CO2(g) △H2
D组:CO(g)+1/2O2(g)=CO2(g) △H12CO(g)+O2(g)=2CO2(g) △H2
(4)25℃,10lkPa条件下,14gN2和3gH2应生成NH3的能量变化如下图所示:

已知:①x=1127;
②25℃101kPa下,N2(g)+3H2(g)
 2NH3(g) △H=-92kJ·mol-1。则y=
2NH3(g) △H=-92kJ·mol-1。则y=(5)金属材料的腐蚀是人类面临的严重问题,金属的防腐对节约能源、保护环境起着十分重要的作用。下列三个装置中,铁被腐蚀速率由快到慢的顺序为
您最近一年使用:0次
2017-05-03更新
|
338次组卷
|
2卷引用:江苏省宿迁市名校2016-2017学年高一下学期期中考试化学试题
11-12高二上·江苏无锡·期中
3 . “阳光”牌小包装“脱氧剂”成分为Fe粉、活性炭及少量NaCl、水,使用一段时间后Fe粉会变质。某校化学兴趣小组欲探究使用过的 “脱氧剂”的变质程度(已变质的Fe粉占变质前Fe粉的质量分数),设计并进行了如下探究过程,请你参与实验并回答有关问题。
步骤⑴取某食品包装袋中的“阳光”牌“脱氧剂”一袋,将里面的固体倒在滤纸上,仔细观察,固体为灰黑色粉末,夹杂着一些红棕色粉末。由此得出的结论为上述“脱氧剂”中的铁已变质,发生了_______ 腐蚀,生成的铁锈主要成分是________ (填化学式);
步骤⑵将步骤⑴中的固体溶于水,过滤,将滤渣洗涤、干燥。该步骤的目的是_________ ;
步骤⑶ 取步骤⑵中的滤渣,将其分为两等份,每一份质量为8.0g。将其中一份在氧气流中充分灼烧,生成的气体全部通入足量的澄清石灰水,得到干燥、纯净的沉淀20.0 g。据此计算8.0 g滤渣中活性炭的质量为_______________ ;
步骤⑷ 将步骤⑶中的另一份滤渣放入烧杯中,加入一定体积2.0mol/L的稀H2SO4,微热至反应完全。为保证滤渣充分溶解,加入的稀H2SO4的体积应大于或等于__________ mL;
步骤⑸ 向步骤⑷中的混合物中加入过量的氢氧化钠溶液,得到的固体经洗涤后转移到坩埚中充分加热,冷却、称量,得到6.86g固体。
结论:该“脱氧剂”中的Fe粉和活性炭质量之比为_______________ 。
步骤⑴取某食品包装袋中的“阳光”牌“脱氧剂”一袋,将里面的固体倒在滤纸上,仔细观察,固体为灰黑色粉末,夹杂着一些红棕色粉末。由此得出的结论为上述“脱氧剂”中的铁已变质,发生了
步骤⑵将步骤⑴中的固体溶于水,过滤,将滤渣洗涤、干燥。该步骤的目的是
步骤⑶ 取步骤⑵中的滤渣,将其分为两等份,每一份质量为8.0g。将其中一份在氧气流中充分灼烧,生成的气体全部通入足量的澄清石灰水,得到干燥、纯净的沉淀20.0 g。据此计算8.0 g滤渣中活性炭的质量为
步骤⑷ 将步骤⑶中的另一份滤渣放入烧杯中,加入一定体积2.0mol/L的稀H2SO4,微热至反应完全。为保证滤渣充分溶解,加入的稀H2SO4的体积应大于或等于
步骤⑸ 向步骤⑷中的混合物中加入过量的氢氧化钠溶液,得到的固体经洗涤后转移到坩埚中充分加热,冷却、称量,得到6.86g固体。
结论:该“脱氧剂”中的Fe粉和活性炭质量之比为
您最近一年使用:0次



