1 . 元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表列出了七种元素在元素周期表中的位置,回答下列问题:
(1)表中C在周期表的位置是___________ 。
(2)元素E与元素H相比,金属性较强的是___________ (用元素符号表示),下列表述中能证明这一事实的是___________ (填字母序号)。
a.H的最高价氧化物对应的水化物的碱性比E的强
b.E的化合价比H的低
c.常温下E的单质与水反应的程度很剧烈,而H的单质在加热条件下才能与水反应
(3)画出硫的原子结构示意图:___________ ;画出氧离子的结构示意图:___________ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | |||||
| 3 | E | F | ||||||
| 4 | H |
(2)元素E与元素H相比,金属性较强的是
a.H的最高价氧化物对应的水化物的碱性比E的强
b.E的化合价比H的低
c.常温下E的单质与水反应的程度很剧烈,而H的单质在加热条件下才能与水反应
(3)画出硫的原子结构示意图:
您最近半年使用:0次
2 . 短周期主族元素A、B、C、D、E在周期表中的位置如图所示,其中,常温下E常见的单质为气体。
请回答下列问题:
(1)C元素在周期表中的位置为___________
(2)B、C、D的最简单氢化物中沸点由高到低的顺序是___________ (用化学式表示)。
(3)比较B、C的最高价氧化物对应水化物的酸性强弱关系:___________ >___________ 。(填化学式)
(4)表中能形成两性氢氧化物的元素是___________ (填元素符号),写出该元素的氧化物与E的最高价氧化物对应的水化物反应的离子方程式:___________ 。
(5)用电子式表示B和D元素的原子形成化合物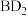 的过程:
的过程:___________ 。
(6)E元素氢化物的化学式为___________ ,常温下,该氢化物溶于水所得水溶液的
___________ (填“>”、“<”或“=”)7。
(7)D的某种氢化物含有18个 ,则该氢化物含有的化学键的类型为
,则该氢化物含有的化学键的类型为___________ 。
| B | C | D | ||
| A | E |
(1)C元素在周期表中的位置为
(2)B、C、D的最简单氢化物中沸点由高到低的顺序是
(3)比较B、C的最高价氧化物对应水化物的酸性强弱关系:
(4)表中能形成两性氢氧化物的元素是
(5)用电子式表示B和D元素的原子形成化合物
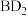 的过程:
的过程:(6)E元素氢化物的化学式为

(7)D的某种氢化物含有18个
 ,则该氢化物含有的化学键的类型为
,则该氢化物含有的化学键的类型为
您最近半年使用:0次
2022-01-27更新
|
118次组卷
|
3卷引用:广东省清远市2021-2022学年高一上学期期末教学质量检测化学试题
21-22高一上·浙江·阶段练习
解题方法
3 . A、 B、C、D、E是5种短周期主族元素,它们的原子序数依次增大。A原子次外层电子数与最外层电子数之比为1:2;B的阴离子和C的阳离子具有相同的电子层结构,B与C的单质在不同条件下反应,生成两种阴阳离子个数比都为1:2的化合物F和G,G的相对分子质量大于F,D的L层电子数等于K、M两个电子层上的电子数之和,完成下列空格:
(1)请在下图中用“实线”画出金属元素与非金属元素的分界线,并在相应的位置上填上A、B两种元素的元素符号_______ 。
(2) D元素位于周期表是 _______ 。
(3)写出C元素的最高价氧化物对应水化物和E元素的最高价氧化物对应水化物反应的化学方程式:_______ 。
(4)将FeSO4溶液加到少量G粉末中,溶液中产生红褐色沉淀,溶液表面没有气泡,写出反应的离子方程式:_______ 。
(5)B、E两元素氢化物沸点高低顺序是_______ (用分子式表示),并用物质结构知识解释原因_______ 。
(6)非金属性强弱比较:D_______ E(填写“>”“=”或“<”),写出一个化学方程式加以验证:_______ 。
(7)化合物H由D和B两种元素组成,且所有原子的最外层均满足8电子稳定结构,写出H的结构式:_______ 。
(8)已知铁原子最外层有2个电子,画出铁的原子结构示意图:_______ 。
(1)请在下图中用“实线”画出金属元素与非金属元素的分界线,并在相应的位置上填上A、B两种元素的元素符号
| H | He | |||||||||||||||||
| Fr | Og |
(3)写出C元素的最高价氧化物对应水化物和E元素的最高价氧化物对应水化物反应的化学方程式:
(4)将FeSO4溶液加到少量G粉末中,溶液中产生红褐色沉淀,溶液表面没有气泡,写出反应的离子方程式:
(5)B、E两元素氢化物沸点高低顺序是
(6)非金属性强弱比较:D
(7)化合物H由D和B两种元素组成,且所有原子的最外层均满足8电子稳定结构,写出H的结构式:
(8)已知铁原子最外层有2个电子,画出铁的原子结构示意图:
您最近半年使用:0次



