名校
1 . 1869年,俄国化学家门捷列夫提出了元素周期律,并在此基础上发表了第一张元素周期表。为了纪念元素周期表诞生150年,联合国将2019年定为“国际化学元素周期表年”,并认为元素周期表是“科学共同的语言”。
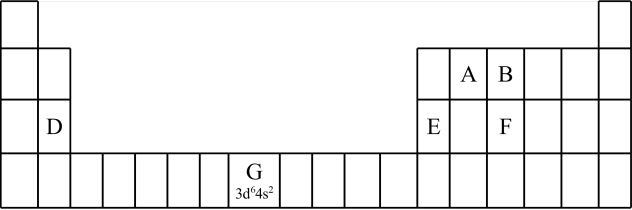
(1)认识元素周期表的结构:___________ 区。
②2017年5月9日我国发布了113号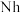 、115号
、115号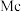 、117号
、117号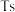 、118号
、118号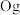 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是___________ (填字母序号)。
a.113号元素在周期表中的位置是第七周期 族
族
b.117号元素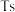 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体
c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:
(2)认识原子结构与元素周期表的关系:见表中元素 的信息,其中 “
的信息,其中 “ ”称为该元素原子的
”称为该元素原子的___________ ,该元素 能层上具有
能层上具有___________ 种不同运动状态的电子。
(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D_______ E(填“>” “<”或“=”)。
②气态氢化物的沸点:B_____ F (填“>”“<”或“=”),理由是___________ 。B的另一种氢化物可以作为火箭推进剂的燃料之一,其电子式为___________ 。
(1)认识元素周期表的结构:
②2017年5月9日我国发布了113号
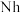 、115号
、115号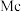 、117号
、117号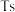 、118号
、118号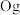 四种元素,则下列说法正确的是
四种元素,则下列说法正确的是a.113号元素在周期表中的位置是第七周期
 族
族b.117号元素
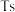 位于金属与非金属分界线上,属于准金属,可能是半导体
位于金属与非金属分界线上,属于准金属,可能是半导体c.这四种元素都是主族元素
d.最高价氧化物的水化物的碱性:

(2)认识原子结构与元素周期表的关系:见表中元素
 的信息,其中 “
的信息,其中 “ ”称为该元素原子的
”称为该元素原子的 能层上具有
能层上具有(3)认识元素周期律及其应用:
①第三周期元素的第一电离能:D
②气态氢化物的沸点:B
您最近半年使用:0次
名校
解题方法
2 . 五种短周期元素在周期表中的位置如图所示。已知:W元素原子的最外层电子数是次外层的2倍,下列说法正确的是

| A.5种元素最高价氧化物的水化物都是酸 |
| B.WZ4、MX2中所含化学键类型相同,熔点都很高 |
| C.简单氢化物的稳定性:X>Y |
| D.只有一种X的氢化物与Y的氧化物发生反应生成强酸 |
您最近半年使用:0次
3 . 元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表列出了七种元素在元素周期表中的位置,回答下列问题:
(1)表中C在周期表的位置是___________ 。
(2)元素E与元素H相比,金属性较强的是___________ (用元素符号表示),下列表述中能证明这一事实的是___________ (填字母序号)。
a.H的最高价氧化物对应的水化物的碱性比E的强
b.E的化合价比H的低
c.常温下E的单质与水反应的程度很剧烈,而H的单质在加热条件下才能与水反应
(3)画出硫的原子结构示意图:___________ ;画出氧离子的结构示意图:___________ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | |||||
| 3 | E | F | ||||||
| 4 | H |
(2)元素E与元素H相比,金属性较强的是
a.H的最高价氧化物对应的水化物的碱性比E的强
b.E的化合价比H的低
c.常温下E的单质与水反应的程度很剧烈,而H的单质在加热条件下才能与水反应
(3)画出硫的原子结构示意图:
您最近半年使用:0次
4 . A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,A形成的单质为密度最小的气体,B、W同周期,A、D同主族,A与W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。回答下列问题:
(1)E元素在周期表中的位置为_______ 。
(2)D的一种氧化物可与B的最高价氧化物反应生成W的单质,试写出反应的化学方程式:_______ 。
(3)D形成的单质在一定条件下能与A形成的单质化合生成一种化合物DA,DA能与水反应放出氢气,写出该反应的化学方程式:_______ 。
(4)若要比较D和E的失电子能力强弱,下列实验方法可行的是_______ (填字母)。
a.将D形成的单质置于E的盐溶液中,若D形成的单质不能置换出E形成的单质,说明D的失电子能力比E的弱
b.在常温下,将少量D、E形成的单质分别投入到水中,若D形成的单质和水反应而E形成的单质不和水反应,说明D的失电子能力比E的强
c.比较相同条件下D和E的最高价氧化物对应的水化物的溶解性,若前者比后者的溶解度大,说明D的失电子能力比E的强
(1)E元素在周期表中的位置为
(2)D的一种氧化物可与B的最高价氧化物反应生成W的单质,试写出反应的化学方程式:
(3)D形成的单质在一定条件下能与A形成的单质化合生成一种化合物DA,DA能与水反应放出氢气,写出该反应的化学方程式:
(4)若要比较D和E的失电子能力强弱,下列实验方法可行的是
a.将D形成的单质置于E的盐溶液中,若D形成的单质不能置换出E形成的单质,说明D的失电子能力比E的弱
b.在常温下,将少量D、E形成的单质分别投入到水中,若D形成的单质和水反应而E形成的单质不和水反应,说明D的失电子能力比E的强
c.比较相同条件下D和E的最高价氧化物对应的水化物的溶解性,若前者比后者的溶解度大,说明D的失电子能力比E的强
您最近半年使用:0次
名校
5 . W、X、Y是三种短周期主族元素且分别位于三个周期,X和Y位于同一主族且原子序数存在2倍关系。 (M=278g/mol)的热重曲线(空气中加热)如图所示。下列说法不正确的是
(M=278g/mol)的热重曲线(空气中加热)如图所示。下列说法不正确的是

 (M=278g/mol)的热重曲线(空气中加热)如图所示。下列说法不正确的是
(M=278g/mol)的热重曲线(空气中加热)如图所示。下列说法不正确的是
| A.X和Y的简单氢化物稳定性:X>Y |
| B.W和金属钠形成的化合物为离子化合物 |
| C.最终曲线Q所得到的物质为Z3X4 |
D.热重曲线的第1、2、3个拐点失去的都是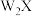 |
您最近半年使用:0次
2024-01-09更新
|
440次组卷
|
3卷引用:新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高三上学期第二次月考化学试题
新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高三上学期第二次月考化学试题广西钦州市第四中学2023-2024学年高一上学期12月考试化学试卷(已下线)题型08 元素周期律推断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
名校
解题方法
6 . 中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量含氧橄榄石矿物(ZxW2-xRX4)。已知前四周期元素X、Y、Z、R、W的原子序数依次增大,Y的氢化物常用于雕刻玻璃,R元素的一种氧化物可制作光导纤维,W的合金材料是生活中用途最广泛的金属材料,基态Z原子核外s,p能级上电子总数相等。下列叙述正确的是
| A.原子半径:Z>R>Y>X |
| B.X的第一电离能比同周期相邻元素小 |
| C.X的简单氢化物的热稳定性强于Y的简单氢化物 |
| D.熔点:ZY2>RX2 |
您最近半年使用:0次
2023-10-26更新
|
952次组卷
|
6卷引用:湖南省郴州市2024届高三上学期一模化学试题
湖南省郴州市2024届高三上学期一模化学试题湖南省邵阳市绥宁县世贤中学2023-2024学年高三上学期12月月考化学试题广西名校2023-2024学年高三上学期仿真卷(一)化学试题湖南省常德市 临澧县第一中学2023-2024学年高三上学期第五次阶段性考试化学试题(已下线)专题04 物质结构与性质 元素推断-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)2024届海南省海南中学高三下学期第一次模拟化学试题
名校
7 . 元素在周期表中的位置,反映了元素的原子结构和性质。如图是元素周期表的一部分,请按照要求回答下列问题:
(1)①的元素符号是______ ,元素②位于周期表中的第______ 周期第______ 族。
(2)②、③两种元素中,非金属性较强的是______ (填元素符号)
(3)①、②、④三种元素中,原子半径最大的是______ (填元素符号)。
(4)④、⑤两种元素中最高价氧化物对应的水化物,属于两性氢氧化物的是______ (填化学式)。
(5)常温下,将元素⑥的单质通入 溶液中可制得漂白液,其有效成分是
溶液中可制得漂白液,其有效成分是 ,请写出该反应的离子方程式
,请写出该反应的离子方程式______
| 族 周期 | IA | 0 | ||||||
| 1 | IIA | IIIA | IVA | VA | VIA | VIIA | ||
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | |||||
(2)②、③两种元素中,非金属性较强的是
(3)①、②、④三种元素中,原子半径最大的是
(4)④、⑤两种元素中最高价氧化物对应的水化物,属于两性氢氧化物的是
(5)常温下,将元素⑥的单质通入
 溶液中可制得漂白液,其有效成分是
溶液中可制得漂白液,其有效成分是 ,请写出该反应的离子方程式
,请写出该反应的离子方程式
您最近半年使用:0次
2023-06-08更新
|
157次组卷
|
2卷引用:云南省普通高中2021-2022学年高一下学期期末学业水平考试化学试题
解题方法
8 . 有五种短周期主族元素X、Y、Z、R、Q,它们的原子序数依次增大,其中X、Y、R、Q在周期表中位置如表;R的简单离子半径是同周期中最小的;Z是一种金属元素,其原子的第一至第四电离能分别是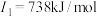 ,
, ,
, ,
, 。下列说法正确的是
。下列说法正确的是
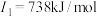 ,
, ,
, ,
, 。下列说法正确的是
。下列说法正确的是| X | Y | |
| R | Q |
| A.第一电离能:Q>R>Z |
| B.X和Y的单质熔点:X<Y |
| C.工业上都用电解其氧化物的方法制Z、R、Q单质 |
| D.Y的简单氢化物可与盐酸反应生成既有离子键又有共价键的化合物 |
您最近半年使用:0次
解题方法
9 . 下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
(1)e原子的基态核外电子具有___________ 种不同的空间运动状态。
(2)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:___________ 。
(3)o、p两元素的部分电离能数据列于下表:
比较两元素的 、
、 可知,气态
可知,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子困难。对此,你的解释是
再失去一个电子困难。对此,你的解释是___________ 。
(4)第3周期8种元素按单质熔点高低的顺序如图(Ⅰ)所示,其中电负性最大的是___________ (填Ⅰ图中的序号)。表中所列的某主族元素的电离能情况如图(Ⅱ)所示,则该元素是___________ (填元素名称)。

(5)a、d、l三种元素可形成一种离子化合物,其中的化学键类型除了离子键,还包括___________ 。
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | p | |||||||||||||||
(2)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:
(3)o、p两元素的部分电离能数据列于下表:
| 元素 | o | p | |
电离能/ |  | 717 | 759 |
 | 1509 | 1561 | |
 | 3248 | 2957 | |
 、
、 可知,气态
可知,气态 再失去一个电子比气态
再失去一个电子比气态 再失去一个电子困难。对此,你的解释是
再失去一个电子困难。对此,你的解释是(4)第3周期8种元素按单质熔点高低的顺序如图(Ⅰ)所示,其中电负性最大的是

(5)a、d、l三种元素可形成一种离子化合物,其中的化学键类型除了离子键,还包括
您最近半年使用:0次
名校
解题方法
10 . 已知短周期元素M、N、X、Y、Z分布在三个周期,N、X最外层电子数相同,Z原子序数大于X,其中Z的简单离子半径在同周期中最小,X单质极易与常见无色无味液态物质发生置换反应且做氧化剂,在短周期中Y的最高价氧化物对应水化物的碱性最强。回答下列问题:
(1)Y在周期表中的位置是_______ ,写出YM的电子式:_______ 。
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):_______ 。
(3)在 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取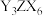 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:_______ 。
(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是_______ 。
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性: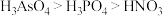
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为_______ 。
(5) 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
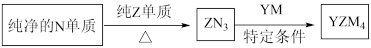
利用 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。
①其反应的化学方程式为_______ 。
②取样品a g,若实验测得氢气的体积为V mL(标准状态),则 样品纯度为
样品纯度为_______ (用代数式表示)。
(1)Y在周期表中的位置是
(2)N、X、Y、Z简单离子的半径由大到小的顺序(用对应离子符号表示):
(3)在
 与YX的混合液中,通入足量
与YX的混合液中,通入足量 ,是工业制取
,是工业制取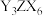 的一种方法,写出该反应的化学方程式:
的一种方法,写出该反应的化学方程式:(4)镓(31Ga)的化合物氮化镓(GaN)和砷化镓(GaAs)作为第三代半导体材料,具有耐高温、耐高电压等特性,随着5G技术的发展,它们的商用价值进入“快车道”。
①下列有关说法正确的是
a.Ga位于元素周期表第四周期ⅣA族
b.Ga为门捷列夫预言的“类铝”
c.Ga的最高价氧化物对应水化物的碱性比Z元素最高价氧化物对应水化物的碱性强
d.酸性:
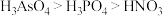
②废弃的含GaAs的半导体材料可以用浓硝酸溶解,放出
 气体,同时生成
气体,同时生成 和
和 ,写出该反应的化学方程式为
,写出该反应的化学方程式为(5)
 是有机合成的重要还原剂,其合成路线如图所示。
是有机合成的重要还原剂,其合成路线如图所示。
利用
 遇水反应生成的氢气的体积测定
遇水反应生成的氢气的体积测定 样品纯度。
样品纯度。①其反应的化学方程式为
②取样品a g,若实验测得氢气的体积为V mL(标准状态),则
 样品纯度为
样品纯度为
您最近半年使用:0次



