1 . 元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表列出了七种元素在元素周期表中的位置,回答下列问题:
(1)表中C在周期表的位置是___________ 。
(2)元素E与元素H相比,金属性较强的是___________ (用元素符号表示),下列表述中能证明这一事实的是___________ (填字母序号)。
a.H的最高价氧化物对应的水化物的碱性比E的强
b.E的化合价比H的低
c.常温下E的单质与水反应的程度很剧烈,而H的单质在加热条件下才能与水反应
(3)画出硫的原子结构示意图:___________ ;画出氧离子的结构示意图:___________ 。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | B | C | D | |||||
| 3 | E | F | ||||||
| 4 | H |
(2)元素E与元素H相比,金属性较强的是
a.H的最高价氧化物对应的水化物的碱性比E的强
b.E的化合价比H的低
c.常温下E的单质与水反应的程度很剧烈,而H的单质在加热条件下才能与水反应
(3)画出硫的原子结构示意图:
您最近半年使用:0次
2 . A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,A形成的单质为密度最小的气体,B、W同周期,A、D同主族,A与W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。回答下列问题:
(1)E元素在周期表中的位置为_______ 。
(2)D的一种氧化物可与B的最高价氧化物反应生成W的单质,试写出反应的化学方程式:_______ 。
(3)D形成的单质在一定条件下能与A形成的单质化合生成一种化合物DA,DA能与水反应放出氢气,写出该反应的化学方程式:_______ 。
(4)若要比较D和E的失电子能力强弱,下列实验方法可行的是_______ (填字母)。
a.将D形成的单质置于E的盐溶液中,若D形成的单质不能置换出E形成的单质,说明D的失电子能力比E的弱
b.在常温下,将少量D、E形成的单质分别投入到水中,若D形成的单质和水反应而E形成的单质不和水反应,说明D的失电子能力比E的强
c.比较相同条件下D和E的最高价氧化物对应的水化物的溶解性,若前者比后者的溶解度大,说明D的失电子能力比E的强
(1)E元素在周期表中的位置为
(2)D的一种氧化物可与B的最高价氧化物反应生成W的单质,试写出反应的化学方程式:
(3)D形成的单质在一定条件下能与A形成的单质化合生成一种化合物DA,DA能与水反应放出氢气,写出该反应的化学方程式:
(4)若要比较D和E的失电子能力强弱,下列实验方法可行的是
a.将D形成的单质置于E的盐溶液中,若D形成的单质不能置换出E形成的单质,说明D的失电子能力比E的弱
b.在常温下,将少量D、E形成的单质分别投入到水中,若D形成的单质和水反应而E形成的单质不和水反应,说明D的失电子能力比E的强
c.比较相同条件下D和E的最高价氧化物对应的水化物的溶解性,若前者比后者的溶解度大,说明D的失电子能力比E的强
您最近半年使用:0次
名校
3 . W、X、Y是三种短周期主族元素且分别位于三个周期,X和Y位于同一主族且原子序数存在2倍关系。 (M=278g/mol)的热重曲线(空气中加热)如图所示。下列说法不正确的是
(M=278g/mol)的热重曲线(空气中加热)如图所示。下列说法不正确的是

 (M=278g/mol)的热重曲线(空气中加热)如图所示。下列说法不正确的是
(M=278g/mol)的热重曲线(空气中加热)如图所示。下列说法不正确的是
| A.X和Y的简单氢化物稳定性:X>Y |
| B.W和金属钠形成的化合物为离子化合物 |
| C.最终曲线Q所得到的物质为Z3X4 |
D.热重曲线的第1、2、3个拐点失去的都是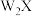 |
您最近半年使用:0次
2024-01-09更新
|
454次组卷
|
3卷引用:新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高三上学期第二次月考化学试题
新疆维吾尔自治区阿克苏地区第二中学2023-2024学年高三上学期第二次月考化学试题广西钦州市第四中学2023-2024学年高一上学期12月考试化学试卷(已下线)题型08 元素周期律推断-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)
名校
解题方法
4 . 中国第一辆火星车“祝融号”成功登陆火星。探测发现火星上存在大量含氧橄榄石矿物(ZxW2-xRX4)。已知前四周期元素X、Y、Z、R、W的原子序数依次增大,Y的氢化物常用于雕刻玻璃,R元素的一种氧化物可制作光导纤维,W的合金材料是生活中用途最广泛的金属材料,基态Z原子核外s,p能级上电子总数相等。下列叙述正确的是
| A.原子半径:Z>R>Y>X |
| B.X的第一电离能比同周期相邻元素小 |
| C.X的简单氢化物的热稳定性强于Y的简单氢化物 |
| D.熔点:ZY2>RX2 |
您最近半年使用:0次
2023-10-26更新
|
1006次组卷
|
7卷引用:湖南省邵阳市绥宁县世贤中学2023-2024学年高三上学期12月月考化学试题
湖南省邵阳市绥宁县世贤中学2023-2024学年高三上学期12月月考化学试题湖南省常德市 临澧县第一中学2023-2024学年高三上学期第五次阶段性考试化学试题湖南省郴州市2024届高三上学期一模化学试题广西名校2023-2024学年高三上学期仿真卷(一)化学试题(已下线)专题04 物质结构与性质 元素推断-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)2024届海南省海南中学高三下学期第一次模拟化学试题重庆市江北区2023-2024学年高三下学期模拟测试化学试题(七)
名校
5 . 元素在周期表中的位置,反映了元素的原子结构和性质。如图是元素周期表的一部分,请按照要求回答下列问题:
(1)①的元素符号是______ ,元素②位于周期表中的第______ 周期第______ 族。
(2)②、③两种元素中,非金属性较强的是______ (填元素符号)
(3)①、②、④三种元素中,原子半径最大的是______ (填元素符号)。
(4)④、⑤两种元素中最高价氧化物对应的水化物,属于两性氢氧化物的是______ (填化学式)。
(5)常温下,将元素⑥的单质通入 溶液中可制得漂白液,其有效成分是
溶液中可制得漂白液,其有效成分是 ,请写出该反应的离子方程式
,请写出该反应的离子方程式______
| 族 周期 | IA | 0 | ||||||
| 1 | IIA | IIIA | IVA | VA | VIA | VIIA | ||
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | |||||
(2)②、③两种元素中,非金属性较强的是
(3)①、②、④三种元素中,原子半径最大的是
(4)④、⑤两种元素中最高价氧化物对应的水化物,属于两性氢氧化物的是
(5)常温下,将元素⑥的单质通入
 溶液中可制得漂白液,其有效成分是
溶液中可制得漂白液,其有效成分是 ,请写出该反应的离子方程式
,请写出该反应的离子方程式
您最近半年使用:0次
2023-06-08更新
|
163次组卷
|
2卷引用:云南省宣威市第三中学2023-2024学年高二上学期第二次月考化学试题
解题方法
6 . 最近,科学家发现对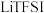 (一种亲水有机盐)进行掺杂和改进,能显著提高锂离子电池传输电荷的能力。
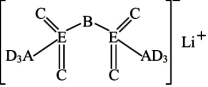
(一种亲水有机盐)进行掺杂和改进,能显著提高锂离子电池传输电荷的能力。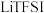 的结构如图所示,其中A、B、C、D为同一短周期元素,C与E位于同一主族。下列叙述正确的是
的结构如图所示,其中A、B、C、D为同一短周期元素,C与E位于同一主族。下列叙述正确的是
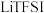 (一种亲水有机盐)进行掺杂和改进,能显著提高锂离子电池传输电荷的能力。
(一种亲水有机盐)进行掺杂和改进,能显著提高锂离子电池传输电荷的能力。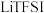 的结构如图所示,其中A、B、C、D为同一短周期元素,C与E位于同一主族。下列叙述正确的是
的结构如图所示,其中A、B、C、D为同一短周期元素,C与E位于同一主族。下列叙述正确的是
| A.简单气态氢化物的稳定性:D>C>E |
| B.C是空气中含量最高的元素 |
| C.该化合物中只有A、C、D元素原子的最外层满足8电子稳定结构 |
D. 与E的简单阴离子在溶液中能大量共存 与E的简单阴离子在溶液中能大量共存 |
您最近半年使用:0次
名校
解题方法
7 . 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。请回答下列问题:

(1)Q元素在元素周期表中的位置为_______ 。
(2)Q元素的非金属性(原子的得电子能力)弱于W元素的非金属性,能证明这一事实的化学方程式为_______ 。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_______ 。
(4)R、T、W元素形成的简单离子的半径由小到大的顺序为_______ (用离子符号表示)。
(5)R有多种氧化物,其中甲的相对分子质量最小。一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是_______ 。
(6)W的单质能溶于Q和W形成的一种化合物中,用电子式表示该化合物的形成过程:_______ 。

(1)Q元素在元素周期表中的位置为
(2)Q元素的非金属性(原子的得电子能力)弱于W元素的非金属性,能证明这一事实的化学方程式为
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为
(4)R、T、W元素形成的简单离子的半径由小到大的顺序为
(5)R有多种氧化物,其中甲的相对分子质量最小。一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是
(6)W的单质能溶于Q和W形成的一种化合物中,用电子式表示该化合物的形成过程:
您最近半年使用:0次
名校
8 . 元素X、Y、Z、W的原子序数依次增大,这些元素组成的物质之间的转化关系如图。m、p、r是常见的单质,其中p是元素W的单质;n由两种元素组成,通常为液态, 中含有
中含有 质子;q是一种强碱,二氧化碳与其反应后溶液的焰色试验呈黄色;s是一种磁性氧化物。下列说法错误的是
质子;q是一种强碱,二氧化碳与其反应后溶液的焰色试验呈黄色;s是一种磁性氧化物。下列说法错误的是

 中含有
中含有 质子;q是一种强碱,二氧化碳与其反应后溶液的焰色试验呈黄色;s是一种磁性氧化物。下列说法错误的是
质子;q是一种强碱,二氧化碳与其反应后溶液的焰色试验呈黄色;s是一种磁性氧化物。下列说法错误的是
| A.r是一种最理想的清洁能源 |
| B.q为离子化合物,含有离子键和共价键 |
C.由元素Z和Y组成的化合物中阴阳离子个数比为 |
D.n和p的反应中,每消耗 ,反应中转移电子的物质的量为 ,反应中转移电子的物质的量为 |
您最近半年使用:0次
2022-05-20更新
|
675次组卷
|
3卷引用:山东省高密市第三中学2022-2023学年高一下学期3月月考化学试题
名校
解题方法
9 . X、Y、Z是原子序数依次增大的短周期元素,可“组合”成一种具有高效催化性能的超分子,其结构如图(注:实线代表共价键,其他Y原子之间的重复单元中的W、X未展开标注),W、X、Z分别位于不同周期, Z是同周期中金属性最强的元素。下列说法不正确的是
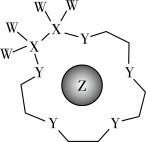
| A.Y位于第二周期第ⅥA族 |
| B.XW4形成的晶体堆积属于分子密堆积 |
| C.X单质不存在能导电的晶体 |
| D.Y与Z可组成阴阳离子数之比为1:2的离子晶体 |
您最近半年使用:0次
2022-05-02更新
|
936次组卷
|
5卷引用:陕西省西安市第八十三中学2023-2024学年高二下学期第一次月考化学试题
陕西省西安市第八十三中学2023-2024学年高二下学期第一次月考化学试题山东省淄博市2021-2022学年高二下学期期中考试化学试题东北育才学校超常教育实验部(少32届)2022届高三第十次模拟考试化学试题辽宁省大连市第一〇三中学2022届高三第八次考试化学试题(已下线)河北省部分学校2022-2023学年高三上学期期末考试变式汇编(10-13)
名校
解题方法
10 . 短周期主族元素W、X、Y、Z的原子序数依次增大,W、Z同主族,X原子的最外层电子数是Y原子最外层电子数的6倍。p、q、r分别为W、X、Z的单质,s、t、u为W、X、Z三种元素形成的二元化合物,上述物质的转化关系如图所示(反应条件略去),下列说法不正确的是
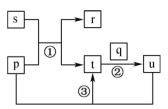
| A.原子半径:Y>Z>W>X |
| B.反应①可用于工业上制备Z的单质 |
| C.s、t、u均能与Y的最高价氧化物对应的水化物的溶液反应 |
| D.X、Y、Z三种元素形成的一种化合物的水溶液可做木材防火剂 |
您最近半年使用:0次
2022-04-23更新
|
1405次组卷
|
10卷引用:福建省部分名校2021-2022学年高三上学期11月联合测评化学试题
福建省部分名校2021-2022学年高三上学期11月联合测评化学试题四川省成都市成都七中22021-2022学年高二下学期理科化学6月阶段性考试试卷四川省成都外国语学校2021-2022学年高一下学期6月月考化学试题黑龙江省牡丹江市第二高级中学2022-2023学年高三上学期第三次月考化学试题天津市第二十中学2023-2024学年高一下学期 化学学情调研(一)试卷河北省石家庄市2021届高三教学质量检测(二)化学试题福建省厦门外国语学校2021届高三5月高考适应性考试化学试题(已下线)专题五 能力提升检测卷 (测) — 2022年高考化学一轮复习讲练测(新教材新高考)河北省石家庄市第二中学2021-2022学年高三上学期期中考试化学试题湖南省常德市桃源县第一中学2022届高三下学期第二次模拟化学试题



